基于分子对接技术的黄芩提取物包合作用研究*
雷奇林,苏 青,2△,凌保东,2,曹祥菊,潘映桥,杨 逍,刘 洁
1. 成都医学院药学院(成都 610500);2. 四川省高校结构特异性小分子药物重点实验室(成都 610500)
中药治疗疾病是多成分的整体作用[1],将黄芩提取物整体入药可以实现其药用价值的最大化。黄芩具有清热燥湿、止血安胎、泻火解毒、抗癌、抗菌、抗病毒等功效[2-7]。黄芩提取物中的黄酮类化合物是其主要的药效组分[8],包括:黄芩苷、黄芩素、汉黄芩苷、汉黄芩素[9]。其中,黄芩素与汉黄芩素是游离苷元,加之分子平面结构的平面性较强,分子排列紧密,分子间引力较大,难溶于水;黄芩苷、汉黄芩苷属于酚苷,但由于糖基的影响,也使得其几乎不溶于水[10]。由于黄芩提取物中的主要成分是黄芩苷,其在胃中属于中等程度吸收[11],限制其生物利用度的主要因素是溶解度。因此,提高黄芩提取物中主要成分的溶解度是提高其生物利用度的有效办法。
β-环糊精(β-cyclodextrin,β-CD)是一类由D-吡喃型葡萄糖通过α-1,4-糖苷键连接而成的一种低聚糖,其分子呈上宽下窄中空的环筒状,可以与多种客体以偶极力、范德华力、疏水作用、空间匹配效应及氢键等相互作用形成主客体包合物[12],是一种良好的天然包合材料。在现代药剂学中,β-CD及其衍生物因能增加药物溶解度,提高药物生物利用度而得到广泛应用[13],如宋全道等[14]用部分甲基化-β-CD与槲皮素形成包合物,增加了桷皮素的溶解度,提高了药效;于生兰等[15]制备黄芩苷β-CD包合物,从而提高了水溶性和稳定性,降低了药物苦味;程建明等[16]将黄芩苷和羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrins,HP-β-CD)包合物制备成注射剂,改善了剂型,提高了药物的生物利用度。
本研究希望利用分子对接的方法来比较不同环糊精对黄芩提取物整体包合效果的不同,以期找到包合效果最好的环糊精,为黄芩的制剂研究提供参考。本研究构建了环糊精其衍生物与黄芩提取物中主要成分的分子模型,通过将环糊精及其衍生物与黄芩提取物主要成分两两对接,得到了它们之间的平均作用能,并参考黄芩提取物中各成分的含量,计算出不同环糊精对黄芩提取物的总体包合效果,以筛选出整体包合效果好的环糊精(或其衍生物)。并以β-CD为例,通过构象分析筛选合理的构象,初步探索它们相互作用模式以及使得包合物稳定的因素。
1 仪器与方法
1.1 实验软件
化学结构绘制软件ChemOffice 2008;分子对接软件AutoDock(Version 4.02.Autodock);分子显示软件PyMOL1.5.0;量子化学计算软件Gaussian 03;分子格式转化软件Open Babel GUI 。
1.2 分子模型构建
1.2.1 环糊精及其衍生物分子模型建立 1)β-CD模型:从蛋白质晶体数据库PDB(www.rcsb.org)中得到β-CD与酶复合物的晶体结构文件(3CGT)[17],在清除蛋白质与H2O的坐标文件后,保存为GJF文件,采用半经验算法中的PM3基组进行频率计算与几何构型优化,未发现虚频,证明优化后的分子构象处于最小的能量状态,并用Open Babel软件将输出文件转化为环糊精分子的pdb文件格式,用于后面对接过程。2)单取代2-HP-β-CD模型:将用PM3优化得到的β-CD模型用ChemOffice软件打开,将7个葡萄糖单元中的1个2位羟基固定,按照SN2取代物机制,用2-羟基丙基(使用正常键长与键角)替换2位羟基,在优化键长与键角之后,按照上述步骤得到HP-β-CD模型,并保存为pdb文件格式,用于后续运算。3)双取代羧甲基-β-环糊精(carboxymethyl-β-cyclodextrin,CM-β-CD)、双取代磺丁基醚-β-环糊精(sulfobutylether-β-cyclodextrin,SBE-β-CD)和双取代甲基-β-环糊精(methyl-β-cyclodextrin,Me-β-CD)分子模型:将用PM3优化得到的β-CD模型用ChemOffice软件打开,将7个葡萄糖单元中的1个2位羟基和其对位的葡萄糖单元中的6位羟基固定,按照SN2亲和取代机制,分别用羧甲基、磺丁基与甲基(使用正常键长与键角)替换2位和6位上羟基上的氢,在优化键长与键角之后,按照上述步骤分别得到CM-β-CD、SBE-β-CD和Me-β-CD模型,并保存为pdb文件格式用于后续运算。
1.2.2 黄芩苷、黄芩素、汉黄芩苷、汉黄芩素分子模型建立 用ChemOffice软件建立4种分子的分子模型(表1),用Chem3d中的MM2方法对建立起的分子模型进行优化,得到分子的最小能量构象,并保存为pdb格式,用于后续的对接步骤。
1.3 分子对接
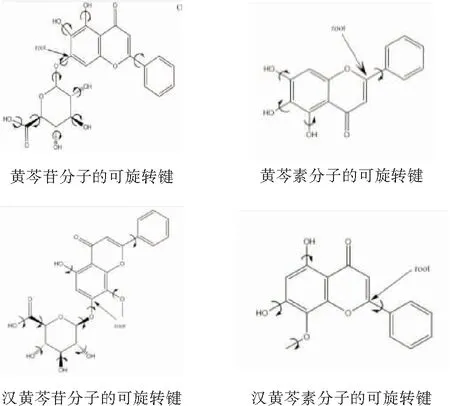
用AutoDockTools软件准备受体(环糊精及衍生物)与配体(黄芩苷、黄芩素、汉黄芩苷、汉黄芩素)的坐标文件,添加H原子与原子电荷,并设置配体分子内可旋转单键数量及根原子(表1)。分别保存为pdbqt格式文件(扩展pdb格式,用于存储坐标、电荷及原子类型等信息)。在分子对接过程中,均以受体几何中心为对接盒子的中心点,盒子尺寸、对接参数均使用默认值,搜索参数选用遗传算法,对接方法采用刚性对接,对接100次。
表1配体分子及配体分子的可旋转键配体分子的可旋转键
2 结果
2.1 β-CD与黄芩提取物的分子对接结果分析
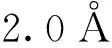
1)

表2 β-CD与黄芩苷分子对接结果的成簇分析及结合能
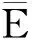
β-CD与黄芩苷分子的平均结合能为-4.394 5 kCal/mol。
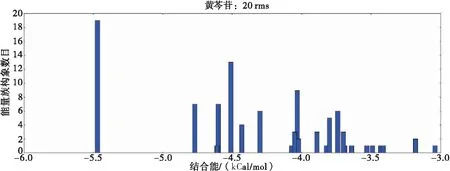
图1 β-CD与黄芩苷分子对接结果的成簇分析图
查看所有的对接构象,没有出现黄芩苷分子脱离环糊精空腔的情况,说明黄芩苷分子能和环糊精形成稳定包合物,其构象及相互作用如下所示,黄芩苷分子中的羧基、羟基与环糊精7个葡萄糖单元中的某两个-OH形成氢键,这样的构象有两个优势:1)氢键结合降低能量;2)黄芩苷分子在环糊精内呈倾斜状,使得苯环能收缩在疏水空腔内,使得包合物体积紧凑,能量降低。在对接结果中,β-CD与黄芩苷的最低能量构象如下所示,黄芩苷分子几乎全部包合在环糊精空腔内部,几何中心与环糊精空腔中心非常接近,苯环位于环糊精空腔的窄开口端,黄芩苷分子中的羧基位于环糊精空腔的宽开口端。从电性因素来看,黄芩苷分子中的羧基极性比苯环强,苯环与之相比有进入空腔内优势,因而暴露于空腔外(图2A)。
用同样的方法分析β-CD与黄芩素、汉黄芩苷、汉黄芩素的对接结果,其构象与相互作用分别如下所示。均未发现配体分子脱离β-CD空腔的解,说明β-CD能与黄芩提取物中的4种主要成分形成稳定包合物。β-CD与黄芩素、汉黄芩苷、汉黄芩素的最低结合能分别为-5.84 kCal/mol、-5.02 kCal/mol、-5.70 kCal/mol,分别占对接结果的48%、23%、21%。对接中最低构象能量越低,所占比例越大,说明对接收敛性越好,形成的包合物也越稳定。在形成包合物的过程中,该过程是自发进行的[18]。按式1计算出其平均结合能分别为:-5.813 2 kCal/mol、-4.366 5 kCal/mol、-5.228 8 kCal/mol。β-CD对黄芩提取物中4种主要成分的包合能力为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷(图2B~D)。
2.2 环糊精衍生物与黄芩提取物4种主要成分对接结果分析
依照相同方法,分析剩下4种环糊精的衍生物(HP-β-CD、CM-β-CD、SBE-β-CD、Me-β-CD)与黄芩提取物中的4种主要成分的对接结果,均未发现脱离空腔的解,说明环糊精衍生物与黄芩提取物之间能形成稳定包合物。按式1计算出它们之间的平均作用能(表3)。通过比较平均结合能的大小可知,HP-β-CD对4种配体的包合效果为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷;CM-β-CD对4种配体的包合能力为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷;SBE-β-CD对4种配体的包合能力为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷;Me-β-CD对4种配体的包合能力为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷。通过以上分析可知:5种环糊精对4种主要成分(黄芩苷、黄芩素、汉黄芩苷、汉黄芩素)的包合顺序是一致的,均为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷。这是因为相较于黄芩苷与汉黄芩苷而言,黄芩素与汉黄芩素为苷元,其分子更小(表1),进入环糊精及其衍生物空腔后,能更完全的被空腔所包裹,使得体系的能量更低,包合物更加稳定。而黄芩苷与汉黄芩苷分子更大,在形成包合物后,它们的苯环伸出了环糊精空腔外(图2),这就降低了黄芩苷和汉黄芩苷与环糊精之间的结合能,使得体系能量升高,包合物稳定性降低。另外,由于作为苷元的黄芩素分子相较于汉黄芩素而言,黄芩素分子中多了两个羟基,更易与环糊精上的羟基形成氢键,从而增加了黄芩素与环糊精形成包合物的稳定性。黄芩苷与汉黄芩苷之间的差异也是同样原因。因而就苷元与苷来说,苷元的结合能力比苷强。就两种苷与两种苷元来说,黄芩苷的结合能力高于汉黄芩苷,黄芩素高于汉黄芩素。
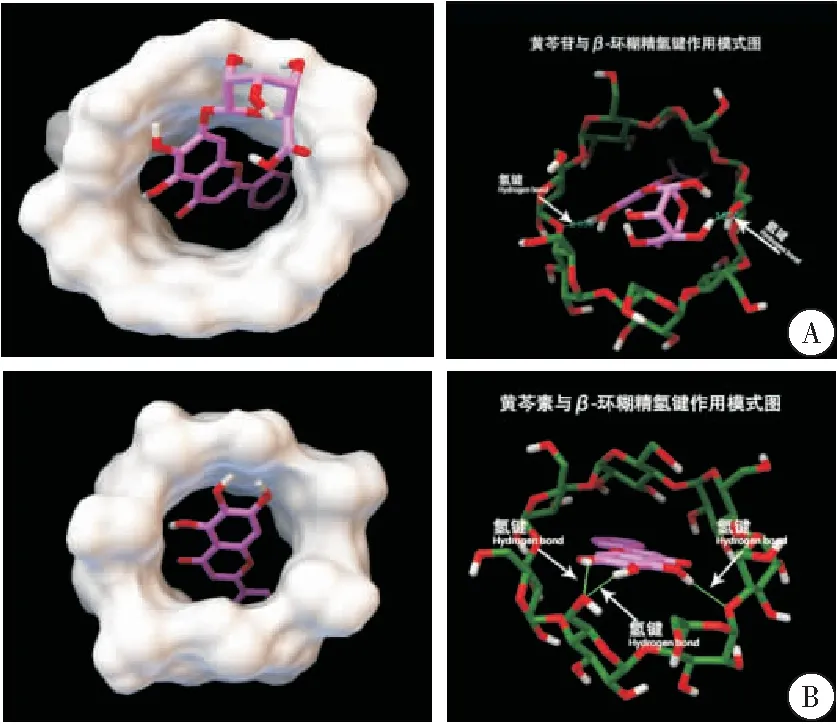
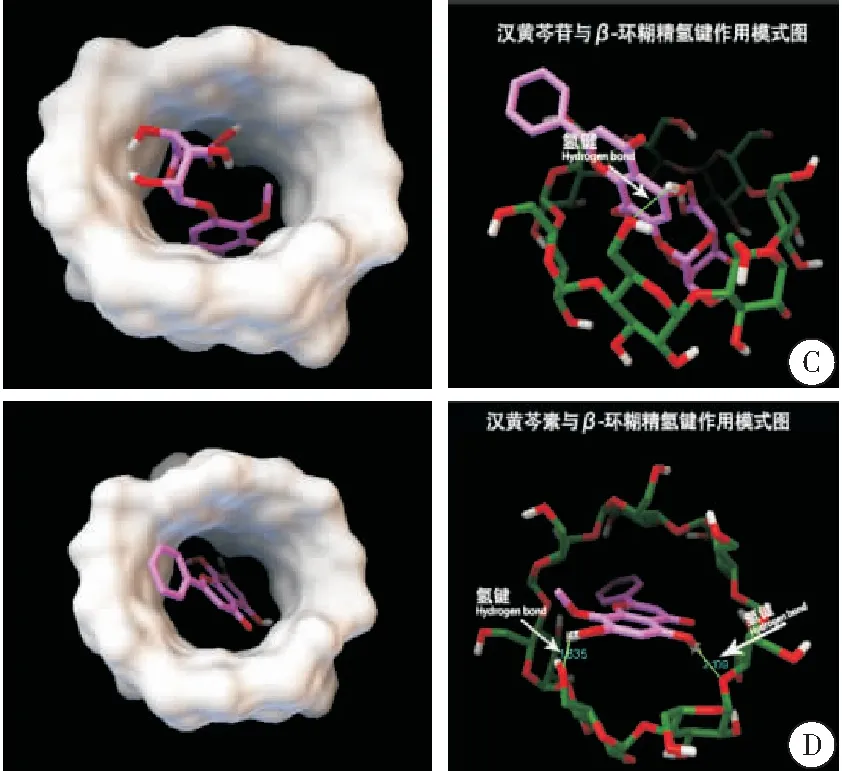
图2 β-CD与黄芩苷提取物的最低能量构象及相互作用图
注:A. β-CD与黄芩苷对接的最低能量构象及相互作用图;B.β-CD与黄芩素对接的最低能量构象及相互作用图;C.β-CD与汉黄芩苷对接的最低能量构象及相互作用图;D.β-CD与汉黄芩素对接的最低能量构象及相互作用图
表3环糊精及其衍生物与黄芩提取物主要成分分子对接平均结合能(kCal/mol)
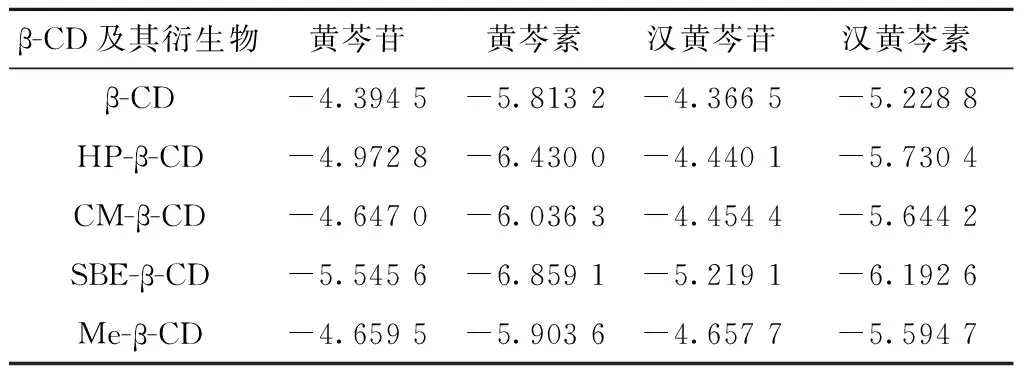
β-CD及其衍生物黄芩苷黄芩素汉黄芩苷汉黄芩素β-CD-4.3945-5.8132-4.3665-5.2288HP-β-CD-4.9728-6.4300-4.4401-5.7304CM-β-CD-4.6470-6.0363-4.4544-5.6442SBE-β-CD-5.5456-6.8591-5.2191-6.1926Me-β-CD-4.6595-5.9036-4.6577-5.5947
2.3 环糊精及其衍生物对黄芩提取物总体包合效果
黄芩提取物有两种,一种是利用各种方法对黄芩进行一次提取的粗提取物(粗提品);另一种是按中国药典所载的多次提取的精提取物(精提品)。由于粗提品与精提品各成分含量不同,有必要就黄芩提取物粗提品与精提品分别讨论。按式2计算出环糊精及其衍生物对黄芩提取物的总体包合效果,其值大小用X表示。
2)
黄芩提取物粗提品[19]和精提品[20]各主要成分的分量如下所示(表4)。
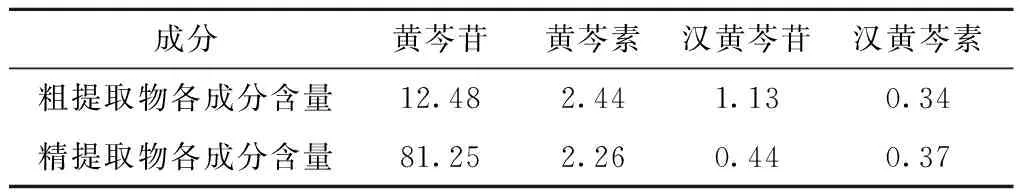
表4 黄芩提取物粗提物与精提取物中主要成分含量表(%)
分别按式2计算出β-CD及其衍生物对黄芩提取物粗提品的总体包合效果值为:Xβ-CD=0.757 4;XHP-β-CD=0.847 2;XCM-β-CD=0.796 7;XSBE-β-CD=0.939 5;XMe-β-CD=0.797 2。比较其大小:XSBE-β-CD>XHP-β-CD>XMe-β-CD> XCM-β-CD> Xβ-CD。因而,β-CD及其衍生物对黄芩提取物的总体包合效果为:
SBE-β-CD>HP-β-CD>Me-β-CD> CM-β-CD>β-CD
分别按式2计算出β-CD及其衍生物对黄芩提取物精提品的总体包合效果值为:
Xβ-CD=3.740 5;XHP-β-CD=4.226 5;XCM-β-CD=3.952 6;XSBE-β-CD=4.706 7;XMe-β-CD=3.960 0。比较其大小:XSBE-β-CD>XHP-β-CD>XMe-β-CD>XCM-β-CD>Xβ-CD。因而,β-CD及其衍生物对黄芩精提品的总体包合效果为:
SBE-β-CD>HP-β-CD>Me-β-CD>CM-β-CD>β-CD
通过以上研究发现,无论是在粗提物还是精提物中,不同环糊精对黄芩提取物的整体包合效果都是一致的,均为:SBE-β-CD>HP-β-CD>Me-β-CD>CM-β-CD>β-CD。SBE-β-CD的包合能力最高,β-CD最低,Me-β-CD与CM-β-CD包合效果差别不大。因此,优先考虑以SBE-β-CD为主体分子来包合黄芩提取物,其次也可选择HP-β-CD。
3 讨论
β-CD的衍生物整体包合效果都要比其自身更好,β-CD及其衍生物均能与黄芩提取物形成稳定包合物。在对接实验中,通过构象分析并观察包合物的构象可以看出,在配体分子(黄芩苷、黄芩素、汉黄芩苷、汉黄芩素)进入环糊精及其衍生物的疏水性空腔以后,配体分子与受体分子之间形成了氢键,这一方面增加了配体分子的刚性结构,减少了配体分子的自由度,避免了活性碰撞,从而增加了它们的水溶性[21]。另一方面,由于氢键的能量作用,使得形成的包合物稳定性更好。根据对接实验测出的平均结合能表明,β-CD及其衍生物对黄芩提取物粗提物的总体包合效果与精提物的包合效果是一致的,均为:SBE-β-CD>HP-β-CD>Me-β-CD>CM-β-CD>β-CD。
SBE-β-CD的包合效果最好,主要是因为HP-β-CD、Me-β-CD、CM-β-CD、β-CD为非电解质。在形成的包合物体系中,SBE-β-CD在与配体形成包合物时,除了有氢键与疏水作用之外,还有静电作用[21],而HP-β-CD、Me-β-CD、CM-β-CD、β-CD则主要是依靠氢键与疏水作用。因此,SBE-β-CD整体的包合效果最好。另外,β-CD及其衍生物对黄芩提取物中的主要成分(黄芩苷、黄芩素、汉黄芩苷、汉黄芩素)的包合效果顺序是一致的,均为:黄芩素>汉黄芩素>黄芩苷>汉黄芩苷,这是由于苷与苷元之间的分子大小以及黄芩苷与汉黄芩苷、黄芩素与汉黄芩素两两之间的羟基数目差异造成的。
通过本研究发现,SBE-β-CD对黄芩提取物的整体包合效果最好,其次是HP-β-CD,由于SBE-β-CD的价格较高,从经济的角度出发,也可以考虑HP-β-CD。
[1]柴兴云. 试论中药涌现性特征[J]. 中国中药杂志, 2015, 40(13): 2480-2485.
[2]洪川. 中药黄芩的化学成分及药理研究进展[J]. 化工管理,2017(2):204.
[3]刘晶晶, 张贵君, 彭慧, 等. 黄芩清热燥湿和泻火解毒药效组分分析[J]. 辽宁中医药大学学报, 2013, 15(11): 78-80.
[4]黄志军. 黄芩苷药理作用研究进展[J]. 天津药学, 2012, 24(3): 61-64.
[5]弓唯一. 黄芩黄酮类组分对尼古丁诱导的肺癌进展的影响及机制[D].上海:复旦大学,2013:5.
[6]施高翔, 邵菁, 汪天明, 等. 黄芩及其有效成分抗菌作用新进展[J]. 中国中药杂志, 2014, 39(19): 3713-3718.
[7]姜茗宸, 汪受传, 徐秋月. 黄芩素抗病毒作用研究[J]. 吉林中医药, 2016, 36(7): 753-756.
[8]董文茜, 程京艳, 文春先, 等. 黄芩商品药材中黄酮类药效组分变化规律研究[J]. 辽宁中医药大学学报, 2013, 15(9): 60-63.
[9]马宏跃, 张启春, 周婧, 等. 黄芩中四种主要黄酮成分与环氧酶-2的分子对接研究[J]. 中医药学报, 2009, 37(6): 71-74.
[10] 吴继洲. 天然药物化学[M]. 北京:高等教育出版社, 2010:223-339.
[11] 刘太明.黄芩苷和黄芩素的吸收机理研究[D].成都:四川大学,2006:4.
[12] 郭明, 王春歌, 殷欣欣, 等. 脱氧土大黄苷-β-环糊精超分子包合物的制备及包合物性能研究[J]. 中国中药杂志, 2013, 38(20): 3467-3472.
[13] 李卫华,宋兴龙. 相溶解度法研究不同环糊精对美沙拉嗪的增溶作用[J]. 中国药师,2016,19(1):65-67.
[14] 宋全道, 丁易, 米广太. 槲皮素-部分甲基化β-环糊精包合物的研究[J]. 山东大学学报(医学版), 2003, 41(2): 206-208.
[15] 于生兰, 孙玲, 张龙, 等. 黄芩苷-β-环糊精包合物的研究[J]. 中兽医医药杂志, 2003, 22(6): 9-12.
[16] 程建明, 刘汉清, 张兴德. 黄芩苷-羟丙基-β-环糊精包合物制备工艺研究[J]. 南京中医药大学学报(自然科学版), 2003, 19(6): 358-359.
[17] 胡硕. 药物-β-环糊精包合物的制备、结构分析及分子模拟[D]. 石家庄:河北科技大学, 2011:45.
[18] 朱庆英,黄益好. 香豆素-羟丙基-β-环糊精包合物的制备研究[J]. 化学研究与应用,2017,29(10):1564-1568.
[19] 丁芳林, 张雯杰, 陈波, 等. HPLC法测定黄芩提取物中4种主要活性成分的含量[J]. 湖南农业科学, 2008(3): 128-130.
[20] 宋丽洁. 黄芩提取物的质量评价方法研究[D]. 济南:山东中医药大学, 2015:54.
[21] 傅力明, 王亚坤, 张浩, 等. 荧光光谱法研究蛇床子素与β-环糊精及其衍生物的包合作用[J]. 山西医科大学学报, 2015, 46(5): 447-450.