GSTM1、GSTT1基因多态性与抗结核药物致肝损害的相关性研究*
武敬参,沈昊昊,吴寿全,王 羽,吉桂宜,贺建清
1.四川大学华西医院 呼吸与危重症医学科(成都 610041);2.河南大学淮河医院 呼吸与危重症医学科 (开封 475001); 3.河南大学淮河临床学院(开封 475001);4. 四川大学华西临床医学院(成都 610041)
结核病是一种病因明确、可防可治的疾病,抗结核药物治疗是控制结核分枝杆菌播散及结核病流行的最有效手段[1],常见的一线抗结核药物主要包括异烟肼(H)、利福平(R)、吡嗪酰胺(Z)、乙胺丁醇(E)等。随着WHO在全球推广直接督导短程化疗策略,抗结核治疗周期长及抗结核药物的联合应用,均可导致抗结核药物所导致的副作用概率增加,其中以肝功能损害最为常见[2]。当患者出现肝功能异常或者相应临床症状时,常常导致药物剂量减少或药物种类减少,甚至是疗程中断,从而影响治疗效果,以及抗结核药物耐药性的产生[3]。如何顺利地完成标准化抗结核治疗方案,同时减轻或者避免肝损害是抗结核治疗成败的关键。因此,了解和掌握抗结核药物致肝功能损害(anti-tuberculosis drug-induced hepatotoxicity, ATDH)的发病机制至关重要。近年来,越来越多的研究[4-6]表明,基因多态性与ATDH的易感性有关联,谷胱甘肽S-转移酶(Glutathione S-transferase, GST)存在多种组织特异性表达同工酶,其中,GSTM1和GSTT1基因位点具有多态性,与ATDH易感性有一定关联性,但这些研究重复性欠佳,且结果并不一致[7]。本实验为前瞻性研究,旨在进一步探讨在中国人群中GSTM1、GSTT1基因多态性与ATDH易感性的关系。
1 资料与方法
1.1 临床资料
纳入标准:1)年龄16~80岁;2)明确诊断为“结核病”患者,包括病理确诊、病原学确诊和临床诊断的患者;3)抗痨前肝功正常;4)自愿,并签署知情同意书。排除标准:1)抗痨前肝功异常;2)患有可引起肝功能异常的其他疾病者,包括酒精性肝炎、病毒性肝炎、肝硬化、免疫性溶血性疾病、充血性心力衰竭等;3)服用其他可引起肝功能异常的药物者,包括免疫抑制剂、抗肿瘤药物、对乙酰氨基酚、氯丙嗪等;4)因肝功能损害以外的其他原因未完成3个月抗结核治疗者。按照上述标准纳入2012年10月至2014年12月四川大学华西医院的结核病患者。
1.2 资料登记
登记患者的年龄、性别、身高、体质量、吸烟史、饮酒史、主要现病史(包括服用免疫抑制剂情况、病毒性肝炎情况、是否患有肿瘤以及是否有HIV感染等)、既往史、诊断依据、抗结核治疗方案、随访时情况(包括随访时间、随访时疗效评估及相应检查结果)。实施标准联合抗结核治疗方案至少3个月,治疗方案基本一致:2HREZ / 4~7HRE(即强化期为2个月,巩固期4~7个月),药物剂量一致,H:300 mg,qd;R:450 mg,qd;E:750 mg,qd;Z:750 mg,bid。在此3个月期间,分别于服用抗结核药物2、4周和2、3月时复查肝功能,并登记。
1.3 肝损害诊断标准
根据《临床结核病学》[8],本研究采取的诊断标准为:ALT ≥80 U/L(2倍参考范围上限)或者TBIL ≥38 mol/L(2倍参考范围上限)。对于ATDH的诊断,统一采用《RUCAM简化评分系统》对每1位纳入病例组的研究对象进行评分,根据评分要求,总评分≥3分可诊断为ATDH。采用《RUCAM简化评分系统》对24例肝功损害的结核病患者进行评分,最终评分结果总结:>8分的有18例,6~8分的5例,3~5分的仅有1例。从而得知,本研究所纳入的24例病例组研究对象均满足ATDH的诊断标准。按照本研究所采用的ATDH诊断标准,当患者发生肝功能损害时,即被纳入到病例组,相反,如果在此期间没有发生ATDH者,则被纳入对照组(图1)。
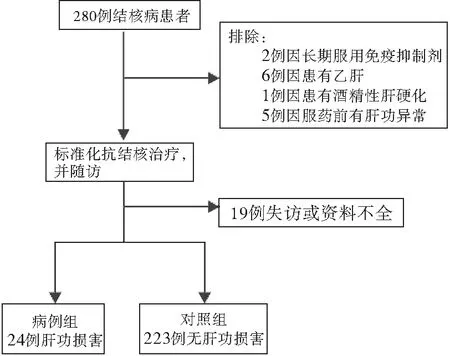
图1 研究对象纳入流程图
1.4 研究方法
1.4.1 外周血DNA提取 本研究对符合纳入标准的研究对象统一抽取外周静脉血3~5 mL,采用乙二胺四乙酸抗凝,并尽快进行离心(时间控制在2 h内,离心半径8 cm,离心速度3 000 r/min,离心时间10 min),分离血浆与血细胞。使用AxyPrep血基因组DNA小剂量试剂盒[康宁生命科学(吴江)有限公司],按照说明书提取DNA,然后-20 ℃低温保存以备用。
1.4.2GSTM1与GSTT1基因分型 根据先前的相关研究[9],本研究所采用引物如下。用多重PCR技术同时扩增GSTM1与GSTT1基因,并以β球蛋白基因作为内对照(表1)。
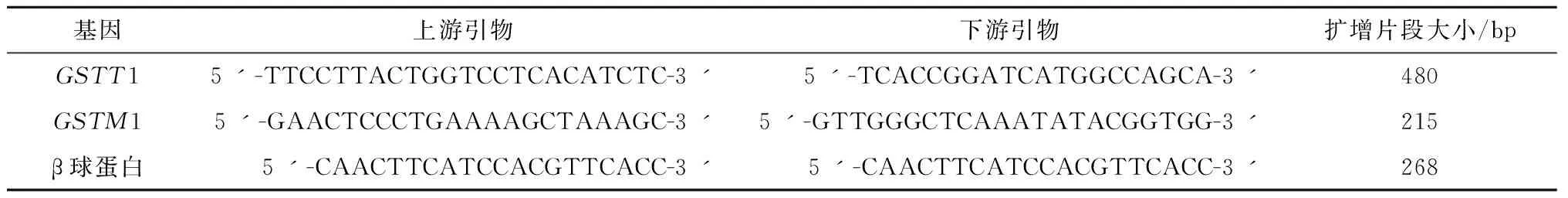
表1 PCR引物
PCR反应体系的建立,根据说明书计算PCR反应体系中所需加入的试剂量,其反应体系的组成如下(表2)。多重PCR扩增条件为:95 ℃预变性2 min,然后经98 ℃变性10 s,55 ℃退火55 s,72 ℃延伸30 s,进行39次循环后,72 ℃延伸5 min。PCR产物经2.0 %琼脂糖凝胶电泳分离后,在凝胶成像和分析系统上观察并记录结果。
1.4.3 基因型结果判定 电泳图自下而上分别为GSTM1(215 bp)、β-球蛋白(268 bp)、GSTT1(480 bp);Marker自下而上依次为100 、200、300、400、500、600 bp,其结果判定如下(图2)。

表2 多重PCR反应液组成(50 μL反应体系)
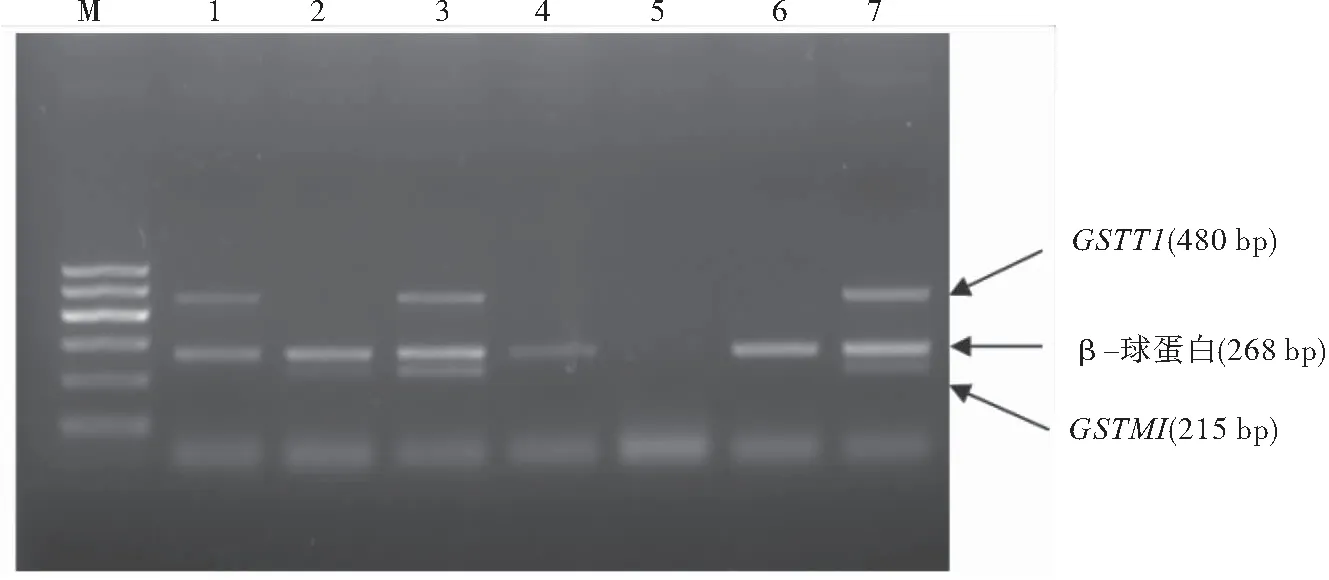
图2 多重PCR方法检测GSTM1及GSTT1 基因缺失情况
注:1:GSTM1(-) 合并GSTT1(+);2:GSTM1(+) 合并GSTT1(-);3:GSTM1(+) 合并GSTT1(+);4:GSTM1(-) 合并GSTT1(-); 5: 阴性对照; 6:GSTM1(-) 合并GSTT1(-);7:GSTM1(+) 合并GSTT1(+); M:Marker
1.5 统计学方法
2 结果
2.1 一般临床资料分析
两组患者在性别、年龄、BMI、吸烟、饮酒、结核病种类(肺内结核或肺外结核)以及治疗方案(含Z或不含Z)间比较,差异无统计学意义(P>0.05),用药前的谷丙转氨酶(ALT)、谷草转氨酶(AST)及总胆红素(TBIL)的值均在正常值范围内,且两组间差异无统计学意义(P>0.05);用药后两组患者血清ALT、AST间差异有统计学意义(P<0.05),但两组TBIL间差异无统计学意义(P>0.05)(表3)。
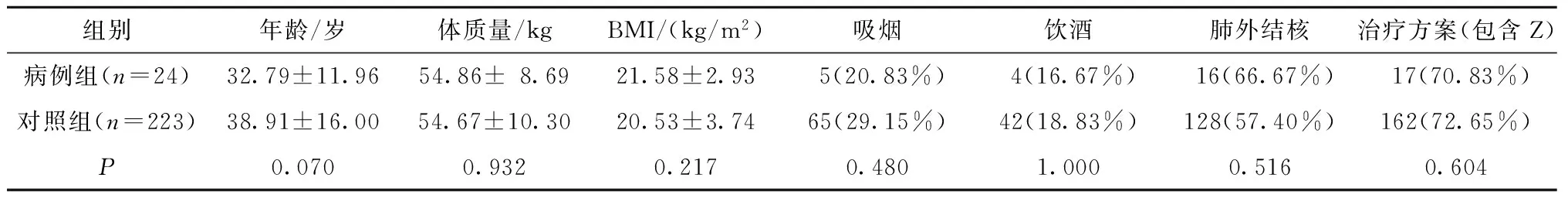
表3 两组患者一般临床资料分析
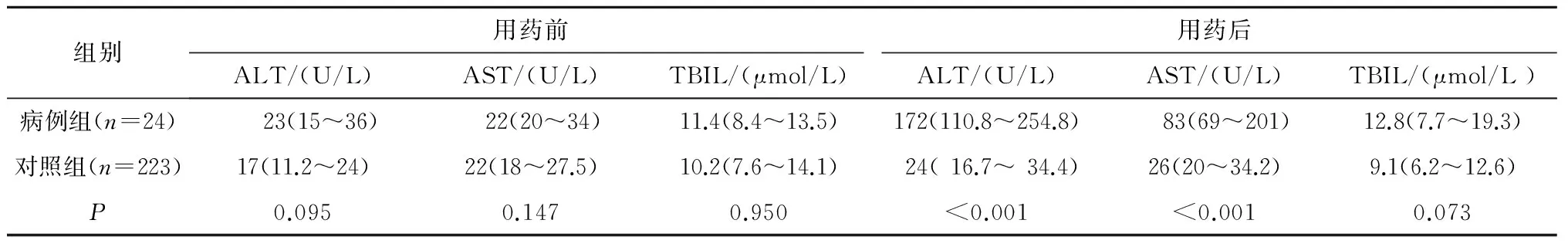
组别用药前用药后ALT/(U/L)AST/(U/L)TBIL/(μmol/L)ALT/(U/L)AST/(U/L)TBIL/(μmol/L)病例组(n=24) 23(15~36) 22(20~34)11.4(8.4~13.5)172(110.8~254.8) 83(69~201)12.8(7.7~19.3)对照组(n=223)17(11.2~24)22(18~27.5)10.2(7.6~14.1)24(16.7~34.4)26(20~34.2)9.1(6.2~12.6)P0.0950.1470.950<0.001<0.0010.073
2.2 GSTM1、GSTT1基因型与ATDH易感性的关系
在病例组及对照组中,GSTM1基因缺失的频率分别为58.33%和52.47%,两组间比较,差异无统计学意义(P=0.668);两组中GSTT1基因缺失的频率分别为45.83%和51.12%,两组间比较,差异无统计学意义(P=0.674)(表4)。
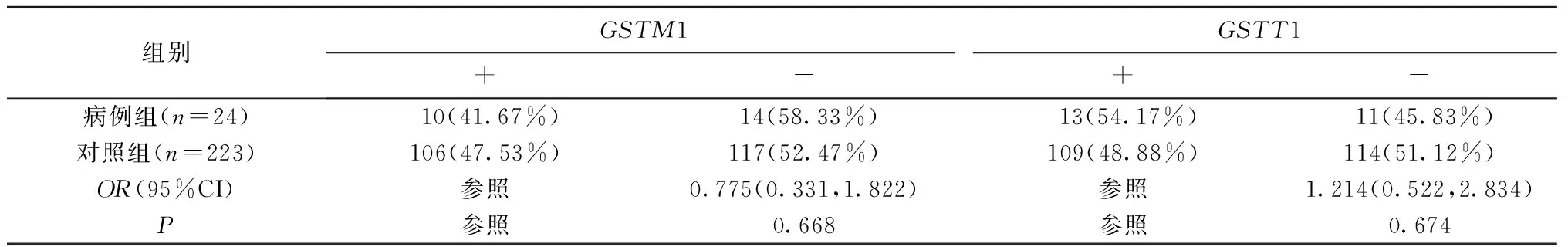
表4 GSTM1、GSTT1基因型与ATDH易感性的关系[n(%)]
2.3 GSTM1、GSTT1不同基因型组合与ATDH的关系
将GSTM1和GSTT1两个基因进行组合,并将GSTM1(+)合并GSTT1(+)组合作为参照。结果表明,GSTM1(-)合并GSTT1(-)组合、GSTM1(+)合并GSTT1(-)组合、GSTM1(-)合并GSTT1(+)组合在两组中出现的频率差异无统计学意义(P>0.05)(表5)。
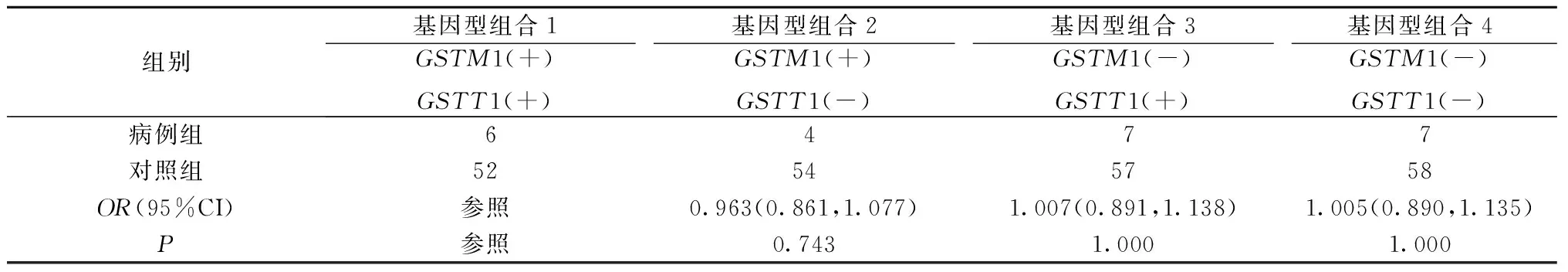
表5 GSTM1、GSTT1不同基因型组合与ATDH易感性的关系
3 讨论
GST是一种Ⅱ相解毒酶,在药物经肝脏代谢过程中起着重要的作用[10]。GST可以消除细胞内自由基,从而减轻药物的肝细胞毒性。该酶存在多种组织特异性表达同工酶,其中,GSTM1和GSTT1基因位点具有多态性,当发生基因突变纯合子缺失时,可使GST活性丧失,增加ATDH的发生概率[11]。
目前,国内外已有关于基因GSTM1、GSTT1多态性与ATDH易感性的相关性研究报道。1项关于中国汉族儿童结核病的研究[12]表明,GSTM1和GSTT1基因多态性与ATDH的易感性无关,该项研究试验组20例,对照组143例,是首次关于中国汉族儿童结核病患者的相关研究。另1项研究[13]表明,GSTM1和GSTT1基因多态性与新疆维吾尔族结核病患者ATDH之间也无明显相关性,该研究试验组89例,对照组1 858例。另外,多项研究[14-19]均支持GSTM1和GSTT1基因多态性不增加ATDH的风险,但是也有研究[20]表明,GSTM1缺失基因型与ATDH的风险增加有关,其风险系数为2.13,而GSTT1基因型与肝损害的发生差异无统计学意义(P>0.05),对ATDH的发生无预测作用。出现上述结论不完全一致的可能原因有:1)结核病患者的纳入标准不同;2)ATDH诊断标准不同;3)所研究的人群不同(不同国家、不同民族、不同年龄段等);4)抗结核药物的治疗方案及剂量有所不同等。
总之,国内外关于基因GSTM1和GSTT1多态性与ATDH易感性的大量研究均表明两者并无相关性。本研究采用严格的前瞻性研究策略,更加贴近临床事实,同样得出上述结论,且本研究人群中GSTM1和GSTT1基因缺失的发生频率均在文献报道的范围内。虽然国内外的大多数研究表明,GSTM1和GSTT1基因缺失与ATDH的易感性无关,但仍有研究结论与此结论不一致,并且理论上GSTM1、GSTT1无效基因型会影响酶的活性,从而增加肝功能损害风险。因此,两者有无关联性的结论目前还难以得出,仍需要进一步深入研究。
另外,本研究还存在一定的局限性:1)样本量不足,是造成本研究结论可能出现偏倚的最大原因;2)本研究所得出的结果是对吸烟、饮酒、BMI进行了多因素Logistic回归校正,但是没有对吸烟、饮酒的具体情况进行亚组分析;3)虽然对本研究的所有人员统一进行了培训,但随访偏倚仍然是不可避免的混杂因素。因此,下一步在肝损伤相关研究过程中,有望采用相同标准,对不同种族之间的结核病患者进行量化深入研究,并扩大样本量,使用更为科学的基因检测手段及统计学方法;另外,目前尚缺乏全基因组关联分析研究数据,它主要是用于筛选与疾病发生相关的单核苷酸多态性(SNP),能够有效的识别与ADTH有关的基因变异因素[21],如能用于临床,就能够鉴别关于某种药物的敏感群体。在上述研究基础上,应该加强前瞻性研究,获得更加有说服力的结论,以期用于指导临床医生用药,减少ATDH发生率,提高抗结核治疗的安全性及有效性。
综上所述,GSTM1、GSTT1基因多态性与ATDH易感性可能无关,即基因GSTM1与GSTT1的缺失情况可能不增加ATDH风险。
[1]Mitchison D, Davies G. The chemotherapy of tuberculosis: past, present and future[J]. Int J Tuberc Lung Dis, 2012, 16(6): 724-732.
[2]Wang L, Zhang H, Ruan Y,etal. Tuberculosis prevalence in China, 1990-2010; a longitudinal analysis of national survey data[J]. Lancet, 2014, 383(9934): 2057-2064.
[3]中华医学会结核病学分会. 抗结核药所致药物性肝损伤诊断与处理专家建议[J]. 中华结核和呼吸杂志, 2013, 36(10):732-736.
[4]Xiang Y, Ma L, Wu W,etal. The incidence of liver injury in Uyghur patients treated for TB in Xinjiang Uyghur autonomous region, China, and its association with hepatic enzyme polymorphisms nat2, cyp2e1, gstm1 and gstt1[J]. PLoS One, 2014, 9(1): e85905.
[5]朱冬林, 席云, 吴雪琼.GSTM1和GSTT1基因多态性与抗结核药物性肝损害的关系[J]. 中国抗生素杂志, 2011, 36(11): 864-868.
[6]Liu F, Jiao A X, Wu X R,etal. Impact of glutathione S-transferase M1 and T1 on anti-tuberculosis drug-induced hepatotoxicity in Chinese pediatric patients[J]. PLoS One, 2014, 9(12): e115410.
[7]Sun F, Chen Y, Xiang Y,etal. Drug-metabolising enzyme polymorphisms and predisposition to anti-tuberculosis drug-induced liver injury: a meta-analysis[J]. Int J Tuberc Lung Dis, 2008, 12(9): 994-100.
[8]唐神结. 临床结核病学[M].北京:人民卫生出版社, 2011: 547.
[9]Xiang Y, Ma L, Wu W,etal. The incidence of liver injury in Uyghur patients treated for TB in Xinjiang Uyghur autonomous region, China, and its association with hepatic enzyme polymorphisms nat2, cyp2e1, gstm1 and gstt1[J]. PLoS One, 2014, 9(1): e85905.
[10] Strange R C, Jones P W, Fryer A A. Glutathione S-transferase: genetics and role in toxicology[J]. Toxicol Lett, 2000, 112-113: 357-363.
[11] Tang N, Deng R, Wang Y,etal.GSTM1 andGSTT1 null polymorphisms and susceptibility to anti-tuberculosis drug-induced liver injury: a meta-analysis[J]. Int J Tuberc Lung Dis, 2013, 17(1): 17-25.
[12] Liu F, Jiao A X, Wu X R,etal. Impact of glutathione S-transferase M1 and T1 on anti-tuberculosis drug-induced hepatotoxicity in Chinese pediatric patients[J]. PLoS One, 2014, 9(12): e115410.
[13] Xiang Y, Ma L, Wu W,etal. The incidence of liver injury in Uyghur patients treated for TB in Xinjiang Uyghur autonomous region, China, and its association with hepatic enzyme polymorphisms nat2, cyp2e1, gstm1 and gstt1[J]. PLoS One,2014, 9(1): e85905.
[14] Wang T, Yu H T, Wang W,etal. Genetic polymorphisms of cytochrome P450 and glutathione S-transferase associated with antituberculosis drug-induced hepatotoxicity in Chinese tuberculosis patients[J]. J Int Med Res, 2010, 38(3): 977-986.
[15] Tang S W, Lv X Z, Zhang Y,etal. CYP2E1,GSTM1 andGSTT1 genetic polymorphisms and susceptibility to antituberculosis drug-induced hepatotoxicity: a nested case-control study[J]. J Clin Pharm Ther, 2012, 37(5): 588-593.
[16] Chatterjee S, Chakrabarti S, Sengupta B,etal. Prevalence of CYP1A1 and GST polymorphisms in the population of northeastern India and susceptibility of oral cancer[J]. Oncol Res, 2009, 17(9): 397-403.
[17] Teixeira R L, Morato R G, Cabello P H,etal. Genetic polymorphisms of NAT2, CYP2E1 and GST enzymes and the occurrence of antituberculosis drug-induced hepatitis in Brazilian TB patients[J]. Mem Inst Oswaldo Cruz, 2011, 106(6): 716-724.
[18] Monteiro T P, El-Jaick K B, Jeovanio-Silva A L,etal. The roles ofGSTM1andGSTT1null genotypes and other predictors in anti-tuberculosis drug-induced liver injury[J]. J Clini Pharm Ther, 2012, 37(6): 712-718.
[19] Kim S H, Kim S H, Yoon H J,etal.GSTT1 andGSTM1 null mutations and adverse reactions induced by antituberculosis drugs in Koreans[J]. Tuberculosis(Edinb), 2010, 90(1): 39-43.
[20] Roy B, Chowdhury A, Kundu S,etal. Increased risk of antituberculosis drug-induced hepatotoxicity in individuals with glutathione S-transferase M1'null'mutation[J]. J Gastroenterol Hepatol, 2001, 16(9): 1033-1037.
[21] 尚军亮. 全基因组单核苷酸多态性交互作用研究[D]. 西安:西安电子科技大学, 2013:148.