槲皮素对糖尿病大鼠的降糖作用及机制研究*
王建礼 杨作成 王 聪 孙 芳 徐兴华△
(1济宁医学院基础医学院,2济宁医学院,济宁 272067)
糖尿病是一组以高血糖为特征的代谢性疾病,高血糖则是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。氧化应激是指机体或细胞内的活性氧化物产生增多和抗氧化系统的清除能力降低,引起组织细胞损伤的一种病理状态,主要通过氧化修饰DNA 碱基、氨基酸及脂质过氧化反应等参与糖尿病的发生、发展[1]。研究表明,糖尿病患者体内可能存在不同程度的氧化应激紊乱[2],胰岛β细胞抗氧化酶的含量及活性相对较低,因而对活性氧产物介导的损害非常敏感,活性氧可直接损伤胰岛β细胞,还可通过影响胰岛素合成和分泌的信号转导通路间接损伤胰岛β细胞的功能。降低糖尿病患者体内的氧化应激水平,防止氧化应激对胰岛细胞的进一步损伤,或许对降低糖尿病的高血糖水平有一定作用。槲皮素是具有多种生物活性的黄酮类化合物,广泛存在于蔬菜、水果、酒和茶叶中。多项研究发现槲皮素对人体起着重要的保护作用,包括抗氧化及清除自由基作用、抗炎及心血管保护和血糖调节作用[3-6]。本文在高脂饲料喂养的基础上,以链脲佐菌素腹腔注射制备大鼠2型糖尿病模型,旨在观察槲皮素对2型糖尿病大鼠的血糖水平、体内氧化应激水平及对胰岛组织中凋亡相关蛋白的表达情况,以及对糖代谢限速酶丙酮酸激酶活性的影响,探索槲皮素对2型糖尿病的降糖作用及其机制。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠,50只,体重(220±20)g,由济宁医学院动物中心提供。实验前尾静脉采血测定大鼠空腹血糖,选取血糖在3.0~5.0mmol/L 者进入本研究。
1.2 试剂及仪器
槲皮素(Sigma公司);链脲佐菌素(Sigma公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(Superoxide Dismutase,SOD);丙酮酸激酶检测试剂盒(南京建成生物工程有限公司);Bax抗体(sc-6236,sant cruz biotechnology);Bcl-2抗体(sc-56015,sant cruz biotechnology);GAPDH抗体(sc-293335,sant cruz biotechnology);抗兔IgG-HRP(sc-2370,sant cruz biotechnology)。血糖仪及试纸(强生医疗器械有限公司);酶标仪(Promega);半干式碳板转印电泳仪;双垂直电泳槽(北京六一生物科技有限公司)。
1.3 方法
1.3.12型糖尿病大鼠模型制备 适应性喂养大鼠1周后,以高脂高糖饲料喂养4 周。以0.1M pH 4.0的柠檬酸/柠檬酸钠缓冲液配制链脲佐菌素溶液;取大鼠,称重,按45 mg/kg的剂量腹腔注射链脲佐菌素。72h后,取尾静脉血测随机血糖,血糖值>16.7mmol/L者,视为2型糖尿病大鼠模型复制成功。
1.3.2实验分组 将SD大鼠随机分为对照组、模型组和槲皮素组,每组10只。模型组给予1ml生理盐水灌胃,槲皮素组按5mg/kg 槲皮素配成1ml溶液灌胃,对照组以1ml生理盐水灌胃,时间为3周。
1.3.3血糖测定 实验分组后,每周一次取大鼠尾静脉血,以血糖仪及试纸测定血糖,共3次。
1.3.4血清MDA含量、SOD活性的测定 灌胃3周后,取大鼠心脏血液,1000rpm离心10min,取血清,按试剂盒说明书测定各组大鼠血清中MDA的含量和SOD的活性。
1.3.5肝脏丙酮酸激酶的测定 灌胃3周后,取大鼠肝脏,匀浆,3000rpm离心10min,取上清,按试剂盒说明书测定各组大鼠肝组织中丙酮酸激酶的活性。
1.3.6Western bloting法测定胰腺组织中凋亡相关蛋白Bax、Bcl-2的表达 灌胃3周后,取对照组、模型组和槲皮素组各6只大鼠胰腺组织30mg,置于液氮中冷冻,研磨,加入100ul组织细胞裂解液,吹打均匀;12000rpm,4℃离心10min,取上清。以BCA法进行蛋白定量。加入上样缓冲液,制备电泳蛋白样本;进行SDS-PAGE电泳,然后转膜,以脱脂奶粉封闭,分别以Bax抗体、Bcl-2抗体和GAPDH抗体(内参)孵育,4℃过夜,以TBST洗涤后,以辣根过氧化物酶标记的二抗(抗兔IGg HRP)室温孵育1h,以TBST洗涤;以化学发光法显影定影,拍照。
1.4 统计学方法
2 结果
2.1 槲皮素对2型糖尿病大鼠血糖的影响
模型复制成功后,模型组各周测定的血糖值都显著高于对照组,差异有统计学意义(P<0.05)。3周后,槲皮素组大鼠的血糖值显著低于模型组,差异有统计学意义(P<0.05)。见表1。
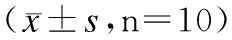
表1 3组SD大鼠血糖水平比较
注:与对照组相比,#P<0.05;与模型组相比,*P<0.05
2.2 槲皮素对2型糖尿病大鼠血清MDA含量和SOD活性以及肝脏丙酮酸激酶活性的影响
模型组大鼠血清中MDA含量显著高于对照组,差异有统计学意义(P<0.05),SOD活性显著低于对照组,差异有统计学意义(P<0.05),肝脏中丙酮酸激酶活性低于对照组,差异有统计学意义(P<0.05),槲皮素组大鼠血清中MDA含量低于模型组,差异有统计学意义(P<0.05),血清中SOD活性高于模型组,差异有统计学意义(P<0.05),肝脏中丙酮酸激酶活性都高于模型组,差异有统计学意义(P<0.05)。见表2。
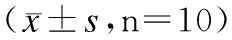
表2 3组SD大鼠血清MDA含量、SOD活性以及肝脏丙酮酸激酶活性水平比较
注:与对照组相比,#P<0.05;与模型组相比,*P<0.05
2.3 槲皮素对2型糖尿病大鼠胰腺组织中凋亡相关蛋白Bcl-2和Bax表达的影响
与对照组相比,模型组大鼠胰腺组织中抗凋亡蛋白Bcl-2表达量显著减少,差异有统计学意义(P<0.05);槲皮素组Bcl-2表达量高于模型组,差异有统计学意义(P<0.05)(图1);模型组大鼠胰腺组织中促凋亡蛋白Bax表达量显著高于对照组,差异有统计学意义(P<0.05);槲皮素组Bax表达量低于模型组,差异有统计学意义(P<0.05)。见图2。

注:各组间比较,F=78.82,P<0.05,
与对照组相比,*P<0.05;
与模型组相比,#P<0.05,n=6

图1 3组大鼠胰腺组织中Bcl-2的表达
注:各组间比较,F=140.22,P<0.05;
与对照组相比,*P<0.05;
与模型组相比,#P<0.05,n=6
图2 3组大鼠胰腺组织中Bax的表达
3 讨论
氧化应激在糖尿病及其并发症的发生、发展过程中起了重要作用,抗氧化治疗可以减轻氧化应激,从而阻止或延缓糖尿病及其慢性并发症的发生、发展。因此,深入研究氧化应激与糖尿病之间的相互关系,不仅有助于了解糖尿病及其并发症的发病机制,而且将为糖尿病及其并发症的治疗提供了一个新的策略。
本文采用高脂高糖饲料喂养4周后,以链脲佐菌素一次腹腔注射法制备大鼠2型糖尿病模型[7],所用剂量为45mg/kg体重,模型复制成功率达85%,且模型稳定性好,3周时动物的血糖仍处于较高水平,且死亡率低。本型糖尿病大鼠,由于长期血糖处于较高水平,体内氧化应激水平高[8]。MDA是膜脂过氧化最重要的产物之一,可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度。SOD生物体内重要的抗氧化酶,能清除氧自由基,降低机体氧化应激水平。本研究中所制备的2型糖尿病大鼠的血清中MDA含量高于对照组,SOD活性低于对照组,说明其氧化应激水平较高。已有研究证实槲皮素具有较好的抗氧化作用,对于调节体内氧化应激水平具有重要的意义,本研究中采用槲皮素治疗后,大鼠体内氧化应激水平有所下降,血清中MDA含量与模型组相比有所下降,SOD活性也比模型组有所升高。因氧化应激可降低外周组织对胰岛素的敏感性,故本研究中槲皮素减轻了糖尿病大鼠体内的氧化应激水平,使外周组织对胰岛素的敏感性有所增加,可能是其降低血糖的一个机制。丙酮酸激酶是调节糖酵解的关键酶之一。丙酮酸激酶被激活,加速葡萄糖的分解;反之,通过糖酵解的葡萄糖就减少。糖酵解作为葡萄糖分解代谢的初始阶段,其流量的变化对于组织对能量的需求有着重要影响。由此可以看出,丙酮酸激酶所调节的糖酵解是糖代谢的重要一环,酶活性的高低对于血糖水平起着重要作用[9]。本研究还发现糖尿病模型组大鼠肝脏中丙酮酸激酶活性低于对照组,而给予槲皮素治疗后能增加丙酮酸激酶活性,同时也使得血糖有所降低,故推测槲皮素升高糖尿病大鼠的丙酮酸激酶活性,也可能是其降低血糖的机制之一。另外,由于复制本糖尿病模型的原理为链脲佐菌素损伤胰岛细胞,从而导致胰岛素的分泌绝对不足,而随之而来的高血糖也会使机体氧化应激水平进一步升高,可使胰岛细胞凋亡增加;本研究中使用槲皮素治疗后之所以能表现出降糖作用,可能与其降低机体氧化应激水平,使抗凋亡蛋白Bcl-2表达增加,而促凋亡蛋白Bax表达减少,从而减轻氧化应激所致的胰岛细胞的凋亡,而在胰岛细胞再生的作用下,胰岛素的分泌有所增加,从而发挥出了降糖作用,但其是否确实能保护胰岛细胞,尚需进一步进行胰岛组织学的研究及体外培养胰岛细胞进行观察。
参考文献:
[1] Lappas M,Mitton A,Mittion A,et al.In response to oxidative stress,the expression of inflammatory cytokines and antioxidant enzymes are impaired in placenta,but not adipose tissue,of women with gestational diabetes[J].J Endocrinol,2010,204(1): 75-84.DOI:10.1677/JOE-09-0321.
[2] Huang X,Sun M,Li D,et al.Augmented NADPH oxidase activity and p22phox expression in monocytes underlie oxidative stress of patients with type 2 diabetes mellitus[J].Diabetes Res Clin Pract,2011,91(3): 371-380.DOI:10.1016/j.diabres.2010.12.026.
[3] D'Andrea G.Quercetin: A flavonol with multifaceted therapeutic applications[J].Fitoterapia,2015,106: 256-271.DOI:10.1016/j.fitote.2015.09.018.
[4] Roslan J,Giribabu N,Karim K,et al.Quercetin ameliorates oxidative stress,inflammation and apoptosis in the heart of streptozotocin-nicotinamide-induced adult male diabetic rats[J].Biomedecine & pharmacotherapie,2017,86: 570-582.DOI:10.1016/j.biopha.2016.12.044.
[5] Loke WM,Proudfoot JM,Hodgson JM,et al.Specific dietary polyphenols attenuate atherosclerosis in apolipoprotein E-knockout mice by alleviating inflammation and endothelial dysfunction[J].Arterioscler Thromb Vasc Biol,2010,30(4): 749-757.DOI:10.1161/ATVBAHA.109.199687.
[6] Jennings A,Welch AA,Spector T,et al.Intakes of anthocyanins and flavones are associated with biomarkers of insulin resistance and inflammation in women[J].J Nutr,2014,144(2): 202-208.DOI:10.3945/jn.113.184358.
[7] 邵俊伟,蔡逊,马丹丹,等.SD大鼠2型糖尿病模型的建立与评价[J].中国普外基础与临床杂志,2014,21(10): 1212-1215.
[8] 史亦男,张楠,崔圆,等.氧化应激与糖尿病及其血管并发症研究进展[J].中国老年学杂志,2016,36(18): 4664-4666.
[9] 王彦,高婷婷,廉如,等.脂联素球状结构域对2型糖尿病大鼠己糖激酶和丙酮酸激酶活力影响的研究[J].中国糖尿病杂志,2013,21(3):271-273.

