乳源免疫调节肽对小鼠急性酒精性肝损伤的保护作用
顾 芳, 席 浩, 阮 昕, 徐 恰, 汪慎燚, 秦宜德
(安徽医科大学生物化学与分子生物学教研室,安徽 合肥 230032)
急性肝损伤是一种极为常见的肝脏疾病,主要诱导因素有酒精、药物、病毒等。随着人民生活水平的提高和生活方式的改变,我国酒精性肝损伤的患病率逐年升高,严重危害了国民的身体健康[1-2],其发生机制与乙醇及其代谢产物的损伤、氧化应激、炎症介质等有关。目前,对于酒精性肝损伤,临床预防和治疗方法主要是口服抗氧化剂和药物营养支持[3]。
近年来,有报道表明生物活性肽,特别是小分子肽在治疗肝病方面显示了广阔的前景[4-5]。它们具有修复受损肝细胞,以及降低谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST),并促进胆酸代谢等功能。乳源免疫调节肽主要来源于α、β和κ-酪蛋白,大多为3~9个氨基酸残基的短肽,PGPIPN (Pro-Gly-Pro-Ile-Pro-Asn)位于β-酪蛋白的63~68残基上,是最为典型的免疫调节肽[6-7]。PGPIPN六肽含有3个Pro,在体内具有抗酶解的作用。本实验室前期研究证实[8-10],PGPIPN具有抗氧化、抗疲劳等功能,还能够诱导某些肿瘤细胞发生凋亡,抑制肿瘤的生长。鉴于PGPIPN良好的免疫调节及抗氧化作用,本研究通过高浓度酒精连续灌胃的方法,建立小鼠急性酒精性肝损伤模型,探讨PGPIPN对小鼠急性酒精性肝损伤的保护作用及其可能的机制,为PGPIPN作为抗酒精性肝损伤的药品开发提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 60只清洁级昆明种小鼠,♂,体质量20~22 g。购于安徽医科大学实验动物中心,饲养于安徽医科大学实验动物中心。
1.1.2试剂 红星二锅头酒56度,北京红星股份有限公司; PGPIPN由上海生物工程技术服务有限公司合成; 谷胱甘肽片(glutathione,GSH),商品名:阿拓莫兰,由重庆药友制药有限公司生产;肿瘤坏死因子α(tumor necrosis factor α,TNF-α)含量、丙二醛(malondialdehyde,MDA)含量、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和超氧化物歧化酶(superoxide dismutase,SOD)活性的检测试剂盒,均购自南京建成生物工程研究所;改良型BCA法蛋白质浓度测定试剂盒购于上海生物工程技术服务有限公司。
1.1.3仪器 L530R低速冷冻离心机(湖南湘仪离心机仪器有限公司);Multiskan Go全波长酶标仪(美国赛默飞世尔科技公司);SP-721E可见分光光度计(上海光谱仪器有限公司);FSH-2可调高速匀浆器(江苏金坛市国旺实验仪器厂);全自动生化分析仪(瑞士罗氏公司)。
1.2动物分组、给药及造模60只昆明种小鼠适应性喂养1周后,随机分为 6组(每组10只),即对照组、模型组、PGPIPN低、中、高剂量组和阳性对照组(GSH)。PGPIPN低、中、高剂量组分别以0.04、0.4、4 mg·kg-1PGPIPN灌胃;GSH组以GSH 200 mg·kg-1灌胃[11]。均连续灌胃2周,每天1次。正常对照组和模型组给予等量蒸馏水灌胃。从给药d 12开始,模型组和各给药组小鼠用56度白酒灌胃,16 mL·kg-1,连续3 d,每天1次。正常对照组以等量蒸馏水灌胃。各组小鼠均常规饲养,自由饮食水。末次灌胃结束12 h后,颈椎脱臼处死小鼠,取材检测相关指标。
1.3检测指标
1.3.1肝指数的测定 末次灌胃结束后禁食12 h,称取各组小鼠体质量,颈椎脱臼处死小鼠后,取出肝脏称重,计算肝指数:肝指数 (LI)=肝脏重/体质量×100%。
1.3.2血清ALT和AST水平的测定 小鼠眼球取血分离血清,运用全自动生化分析仪测定血清AST和ALT水平。
1.3.3检测肝匀浆中TNF-α含量、MDA含量、 GSH-Px活性和SOD活性 取肝左叶约1.0 g,制成10%肝匀浆, 4 ℃、4 000 r ·min-1离心10 min,取上清液用BCA法检测肝匀浆中蛋白质含量;按试剂盒说明操作,检测肝匀浆中TNF-α含量、MDA含量、 GSH-Px活性和SOD活性。
1.3.4肝脏的组织病理学检测 迅速取出肝左叶中部,切成约1 mm3制作组织切片,进行HE染色,光镜下观察肝脏组织病理状态。
2 结果
2.1PGPIPN对酒精性肝损伤小鼠肝指数的影响Tab 1结果显示,与对照组比较,模型组小鼠肝指数明显增大(P<0.05)。而与模型组相比,PGPIPN高剂量组和GSH组小鼠肝指数明显降低; PGPIPN中、低剂量组小鼠肝指数有降低的趋势,但差异无统计学意义。
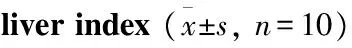
Tab 1 Changes of body weight, hepatic weight and
*P<0.05vscontrol;#P<0.05vsmodel
2.2PGPIPN对酒精性肝损伤小鼠血清ALT和AST水平的影响Tab 2结果显示,与正常对照组比较,模型组小鼠血清ALT、AST水平明显升高 (P<0.01)。与模型组相比,PGPIPN高剂量组和GSH组血清ALT及AST水平明显降低(P<0.01) ; 与GSH组相比,PGPIPN高剂量组血清ALT、AST的含量无明显差异。
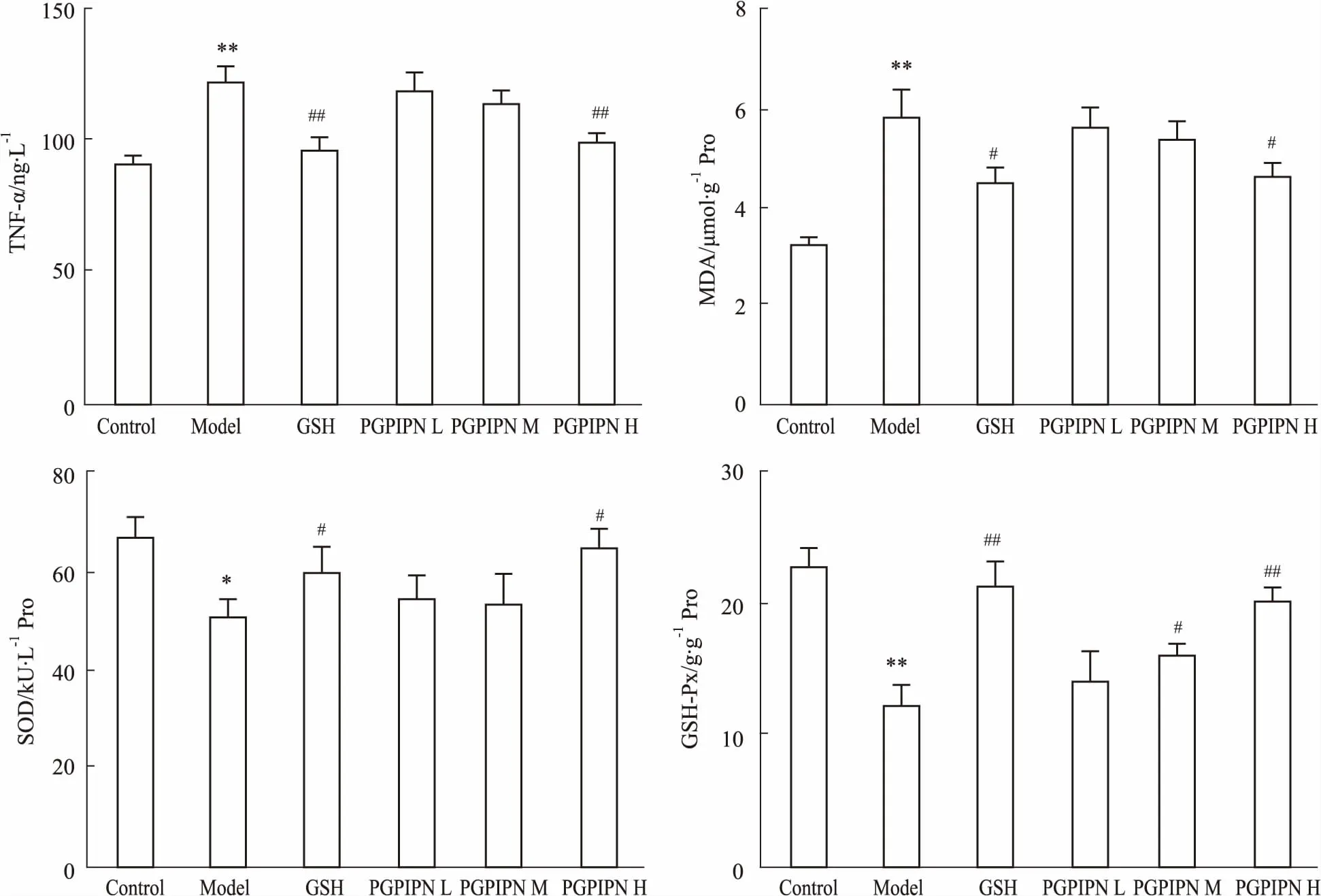
Fig 1 Effects of PGPIPN on TNF-α (A), MDA(B), SOD(C) and GSH-Px(D) in liver of mice
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group
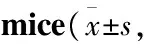
Tab 2 Effects of PGPIPN on activity of ALT and AST in serum of n=10)
**P<0.01vscontrol;##P<0.01vsmodel
2.3PGPIPN对酒精性肝损伤小鼠肝组织TNF-α含量、MDA含量、GSH-Px活性和SOD活性的影响如Fig 1所示,与正常对照组相比,模型组小鼠肝组织 TNF-α、MDA含量明显升高,GSH-Px和SOD活性明显降低,差异具有显著性 (P<0.01) 。与模型组相比,PGPIPN高剂量组和GSH组能够明显降低小鼠肝组织内TNF-α、MDA含量,提高GSH-Px和SOD活性; PGPIPN中剂量组能明显增加GSH-Px活性(P<0.05) ;而PGPIPN低剂量组对上述4个指标均无明显影响。
2.4PGPIPN对酒精性肝损伤小鼠肝脏组织病理学的影响如Fig 2所示,光镜下可见,正常对照组小鼠肝组织细胞呈放射条索状排列,肝小叶结构完整,肝细胞胞核结构清楚、细胞边界清晰,未见坏死。模型组肝索排列紊乱,肝细胞间隙有炎性细胞浸润。肝细胞肿胀,胞质出现空泡化,部分肝细胞核萎缩,甚至消失,可见片状坏死。PGPIPN低、中剂量组肝细胞肿胀有所减轻,炎性细胞浸润有所减少,仍可见肝细胞核萎缩、消失及空泡。PGPIPN高剂量组组织结构接近GSH组,肝索排列及肝细胞结构趋于正常,未见明显炎性细胞浸润及胞质空泡化。
3 讨论
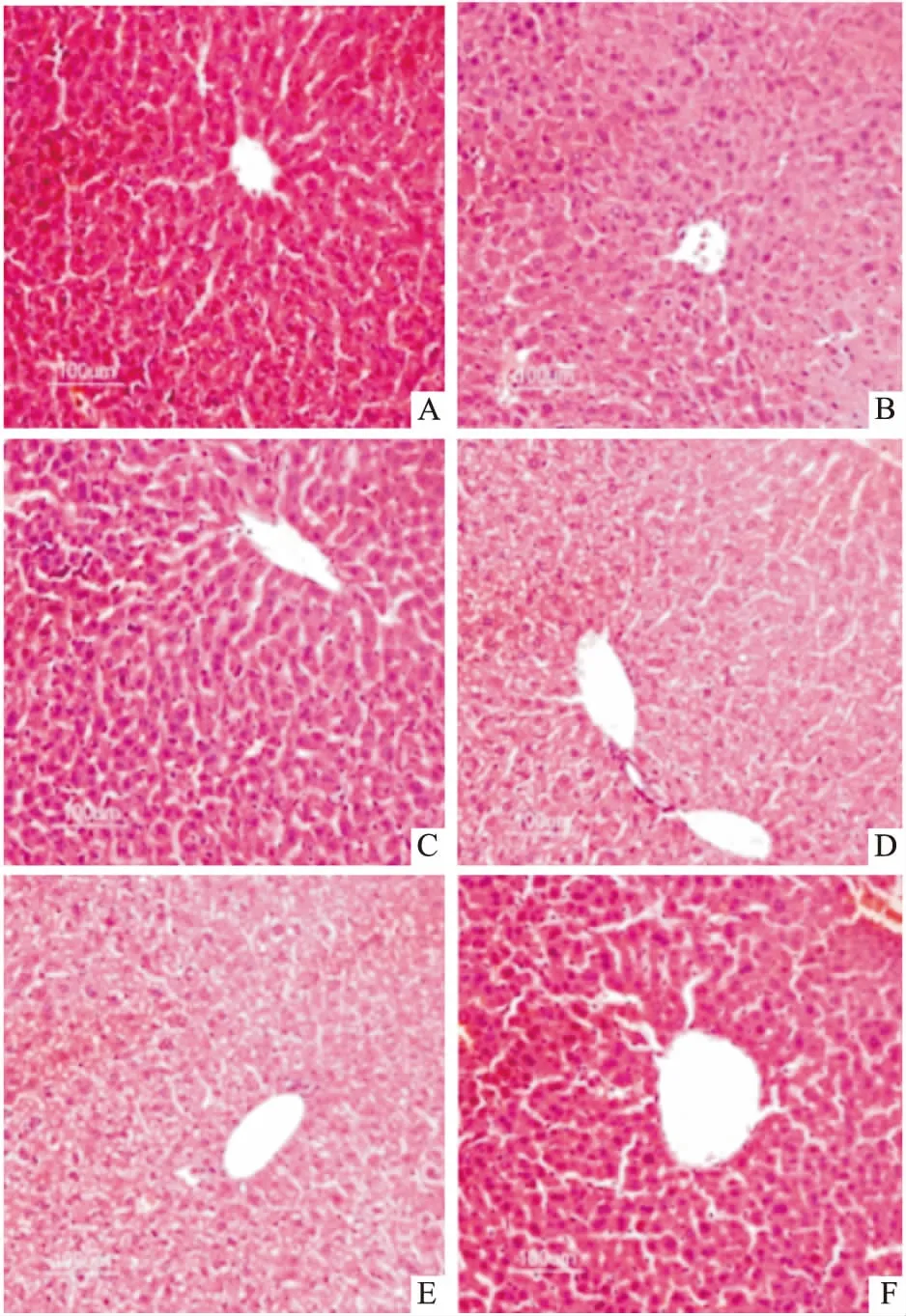
Fig 2 Pathological observation of liver tissues in mice by HE staining (×200)
A: Control; B: Model; C: GSH; D:PGPIPN 0.04 mg·kg-1; E:PGPIPN 0.4 mg·kg-1; F:PGPIPN 4 mg·kg-1
酒精在肝脏内代谢产生的自由基及其代谢终产物MDA使NF-κB活化,刺激机体内TNF-α等炎性因子的异常分泌,介导炎症反应、组织损伤等病理反应,进一步加重酒精性肝损伤[13]。肝脏是TNF-α的重要靶器官,研究表明[14],酒精性肝病患者体内TNF-α水平的增加与疾病的严重程度正相关。本研究显示,酒精性肝损伤时模型组TNF-α分泌增加,而PGPIPN高剂量组可降低TNF-α的分泌。说明PGPIPN可抑制TNF-α的分泌,改善酒精性肝损伤所致的炎性反应。机体组织中的SOD是清除ROS的主要的抗氧化酶,它能有效清除自由基来保护肝细胞。因此,检测肝组织中SOD活性可以衡量肝脏清除自由基能力及机体抗氧化能力[15]。GSH是细胞内游离的水溶性抗氧化剂,GSH-Px是体内广泛存在的抗脂质过氧化反应酶,它可以特异催化GSH与ROS反应,阻断脂质过氧化连锁反应,保护细胞膜的完整性,从而维持细胞的正常结构和功能。因此,检测肝组织中GSH-Px活性也是衡量酒精性肝损伤时肝脏氧化应激及脂质过氧化程度的重要指标。脂质过氧化的代谢终产物MDA可引起蛋白质、核酸等大分子的交联聚合,具有细胞毒性,其含量高低可以反映细胞脂质过氧化损伤的程度,是衡量机体氧化应激损伤的敏感指标[11]。
本研究结果表明,短期大量酒精灌胃诱导小鼠血清中ALT、AST 水平升高,肝组织出现病理性损害,小鼠急性酒精性肝损伤模型构建成功。PGPIPN含有3 个Pro,具有抗酶解的作用,经灌胃给药在消化道内不被降解。PGPIPN可抑制 TNF-α的分泌,改善酒精性肝损伤所致的炎性反应及组织病理损伤。PGPIPN能增强GSH-Px、SOD等抗氧化酶的抗氧化能力, 能清除自由基,抑制酒精诱导的肝脏氧化应激损伤。高剂量PGPIPN(4 mg·kg-1)与临床上常用的抗氧化剂GSH (200 mg·kg-1)对本研究的动物模型具有同等的治疗效果。因此,PGPIPN对急性酒精性肝损伤有良好的保护作用,其具有广阔的临床应用前景。
参考文献:
[1] Gao B, Bataller R.Alcoholic liver disease: pathogenesis and new therapeutic targets [J].Gastroenterology, 2011,141(5): 1572-85.
[2] Wang H, Ma L, Yin Q, et al.Prevalence of alcoholic liver disease and its association with socioeconomic status in north-eastern China [J].AlcoholClinExpRes, 2014,38(4):1035-41.
[3] 刘国涛,朱玉翠,张 涛, 等.酒精性肝病研究进展[J].世界华人消化杂志, 2017,25(15):1382-8.
[3] Liu G T, Zhu Y C, Zhang T, et al.Advances in research of alcoholic liver disease [J].WorldChinJDigestol, 2017,25(15):1382-8.
[4] 赵 丽.肝水解肽治疗肝炎肝硬化疗效观察[J].中国当代医药, 2011,18(26): 62-3.
[4] Zhao L.Efficacy observation of liver hydrolysates in treatment of liver cirrhosis [J].ChinaModMed, 2011,18(26): 62-3.
[5] 刘 睿,任金威,陈启贺,等.人参低聚肽对急性酒精性肝损伤大鼠的保护作用[J].现代预防医学, 2016,43(15):2820-4.
[5] Liu R, Ren J W, Chen Q H, et al.Protective effects of panax ginseng oligopeptide on acute alcohol-induced liver injury and underlying mechanism [J].ModPrevMed, 2016,43(15):2820-4.
[6] 秦宜德,邹思湘.乳中生物活性物质的研究进展[J].食品科学, 2004,25(3): 188-92.
[6] Qin Y D, Zou S X.Research progress on biological active substances in milk [J].FoodSci, 2004,25(3): 188-92.
[7] Politis I.Milk peptides and immune response in the neonate [J].AlcoholClinExpRes, 2008,606:253-69.
[8] 顾 芳,秦宜德,董华胜,等.乳源免疫调节肽对小鼠抗氧化和抗疲劳作用研究[J].营养学报, 2006,28(4): 326-8.
[8] Gu F, Qin Y D, Dong H S, et al.Effects of immunomodulating peptide from β-casein on antioxidation and anti-fatigue in mice [J].ActaNutrimSin, 2006,28(4):326-8.
[9] 董华胜, 秦宜德, 李素萍,等.乳源免疫调节肽具有促进体内外淋巴细胞转化的作用[J].中国药理学通报,2007,23(1):73-6.
[9] Dong H S, Qin Y D, Li S P, et al.Effects of immunomodulating peptide from β-casein on lymphocyte transformation bothinvivoandinvitro[J].ChinPharmacolBull, 2007,23(1):73-6.
[10] Wang W, Gu F, Wei C, et al.PGPIPN, a therapeutic hexapeptide, suppressed human ovarian cancer growth by targeting Bcl-2[J].PLoSOne, 2013,8(4):e60701.
[11] 石小枫, 刘 杞, 郭树华.还原型谷胱甘肽对小鼠急性肝损伤的保护作用[J].现代医药卫生, 2002,18(10): 849-50.
[11] Shi X F, Liu Q, Guo S H.Effect of glutathione on acute liver injury in mice [J].ModMedHealth, 2002,18(10): 849-50.
[12] 夏 婷,张 瑾,姚佳慧, 等.氧化应激在酒精性肝病中作用机制的研究进展[J].中国药理学通报, 2017,33(10):1353-6.
[12] Xia T, Zhang J, Yao J H, et al.Research progress in mechanism of oxidative stress in alcoholic liver disease [J].ChinPharmacolBull, 2017,33(10):1353-6.
[13] Zhou J Y, Jiang Z A, Zhao C Y, et al.Long-term binge and escalating ethanol exposure causes necroinflammation and fibrosis in rat liver [J].AlcoholClinExpRes, 2013,37(2):213-22.
[14] 高潇雪,刘立新.酒精性肝病流行病学及发病机制研究进展[J].中华消化病与影像杂志(电子版), 2016,6(4): 62-5.
[14] Gao X X, Liu L X.Progress in the epidemiology and pathogenesis of alcoholic liver diseases [J].ChinJDigestMedImageol(ElectronEd), 2016,6(4): 62-5.
[15] Masalkar P D.Oxidative stress and antioxidant status in patients with alcoholic liver disease[J].ClinChimActa, 2005,355(1-2):61-5.