miR-204-5p对结直肠癌细胞增殖、侵袭、迁移及上皮间质转化的影响
薛无涯,王舰梅,夏 天,叶入裴,肖秀丽,龙汉安
(西南医科大学附属医院病理科,四川泸州 646000)
在美国,结直肠癌的发病率及致死率均位居恶性肿瘤第3位,随着民众健康意识的增强、诊疗技术及筛查手段的进步,其发病率与死亡率均有所下降[1]。但在我国,结直肠癌的发病率及致死率均位居恶性肿瘤前5位,且发病年龄日趋年轻化,发病率逐年上升[2-3]。尽管目前有多种方法诊治结直肠癌,但其早期症状不明显,患者就诊时间较晚,预后也较差[4]。因此对结直肠癌发病相关分子的识别及其功能特点的研究不仅能为早期诊断结直肠癌提供依据,也能为其治疗提供新的靶点与思路。Masuda等[5]的报道指出microRNA(miRNA)在结直肠癌中异常表达,并与肿瘤分化程度、临床分期、治疗反应及预后有关,提示miRNA与结直肠癌的发生发展紧密相关,可作为早期诊断结直肠癌及反映病人预后的指标。miR-204-5p在多种恶性肿瘤组织中低表达,并能够抑制肿瘤细胞的增殖、侵袭、迁移及EMT[6-9],但其在结直肠癌的相关报道较少。本研究通过观察miR-204-5p在结直肠癌与正常肠黏膜组织中的表达差异及其对细胞增殖、侵袭、迁移及上皮间质转化(epithelia-mesenchymal transition,EMT)的影响,探讨其发挥作用的可能机制,旨在为早期诊治结直肠癌提供新的依据及靶点。
1 材料与方法
1.1 材料
1.1.1 组织标本与临床资料的收集
选取2016年12月至2017年6月于本院确诊并手术治疗的23名结直肠癌患者的新鲜癌组织及配对的正常肠黏膜组织(距癌组织边缘>5 cm)。标本切除后立即置于RNAwai(t非冻型组织RNA保存液)中,4℃过夜,-20℃长期保存。所有标本来源均为初诊病人,并已签署知情同意书。
1.1.2 细胞株和主要试剂
人结直肠癌HT29、LoVo细胞由西南医科大学病理实验室保存;RNAwait购自北京Solarbio公司;过表达人miR-204-5p慢病毒上清购自美国GeneCopoeia公司;miR-204-5p特异引物序列由广州锐博公司合成;逆转录试剂盒及SYBR Premix Ex Taq购自日本Takara公司;培养液(RPMI-1640、DMEM/F12)购自美国HyClone公司;Transwell小室购自美国Corning公司;E-cadherin及Vimentin抗体购自美国CST公司;MAPRE2抗体购自美国Sigma-Aldrich公司。
1.2 方法
1.2.1 细胞培养及转染
HT29、LoVo细胞在37 ℃、5%CO2的条件下培养于含10%FBS的RPMI-1640培养液中。设置过表达人miR-204-5p的HT29-204-5p组、LoVo-204-5p组及转染空载病毒的HT29-NC组、LoVo-NC组。将细胞均匀接种于6孔板,24 h后细胞融合约60%时进行慢病毒转染。8~12 h后换液,常规培养至72 h,观察并检测转染效率。稳定转染成功后传代培养。
1.2.2 总RNA的提取及荧光定量PCR检测miR-204-5p的表达
细胞融合至90%时终止培养,4℃的PBS冲洗3次,加入RNA裂解液。取组织标本50~100 mg置于匀浆器中,加入1 mL RNA裂解液,于冰上充分匀浆裂解。紫外分光光度计下检测RNA的浓度及纯度。PCR扩增仪将提取的RNA逆转录为cDNA。荧光定量PCR仪检测miR-204-5p的表达情况。使用U6作为内参,以2-△△Ct法计算miR-204-5p的相对表达量,配对正常肠黏膜组织作为对照组。
1.2.3 平板克隆形成实验
取4组细胞各200~300个,于6孔板中培养2~3周。当肉眼可见的克隆斑形成时,吸去培养液,常规浸洗、固定、染色,流水缓慢冲洗,室温下自然干燥,计数肉眼可见的克隆斑数目。
1.2.4 划痕修复实验
在六孔板背侧标记3~5条间距0.5 cm以上的平行线。取4组细胞均匀铺于6孔板,24 h后细胞融合达80%以上时用10 μL枪头沿标记横线划痕,PBS冲洗2~3次以去除悬浮细胞。加入2 mL无血清DMEM/F12培养液,于划痕后0、12和24 h拍照,观察并计算划痕愈合程度。
1.2.5 Transwell小室侵袭实验
将Transwell小室用预冷的RPMI-1640培养液润湿,在其上室面铺Matrigel胶,37℃聚合2 h,取4组细胞各2×104个,用100 μL含1%血清的RP⁃MI-1640培养液重悬后接种于上室,下室加500 μL RPMI-1640完全培养基以趋化细胞。24~48 h后擦掉上室侧的细胞及Matrigel胶,常规固定、染色、浸洗,室温干燥。于光学显微镜下拍照、计数小室膜下室侧的细胞数。
1.2.6 Western blot
提取各组细胞总蛋白。常规电泳、转膜、封闭,一抗4℃孵育12~18 h,二抗37℃孵育1 h,ECL化学法显影。Fusion软件分析蛋白灰度值,并统计分析各组蛋白相对表达量。
1.2.7 统计学处理
应用SPSS 17.0软件统计分析实验结果数据。计量资料以x±s表示,其统计分析采用t检验,计数资料采用Pearson卡方检验统计分析。P<0.05时差异有统计学意义。
2 结果
2.1 miR-204-5p的表达水平和临床病理参数的相关性
PCR结果显示miR-204-5p在结直肠癌组织中低表达(图1)。根据miR-204-5p的表达水平,将23例结直肠癌分为miR-204-5p高表达组和miR-204-5p低表达组,并分析其与临床病理参数之间的关系(临床资料见表1)。结果显示,其表达水平与肿瘤大小、TNM分期及淋巴结转移相关(P<0.05),而与患者年龄、性别、肿瘤分化程度、肿瘤部位及血清CEA水平无明显相关性(P>0.05),见表2。
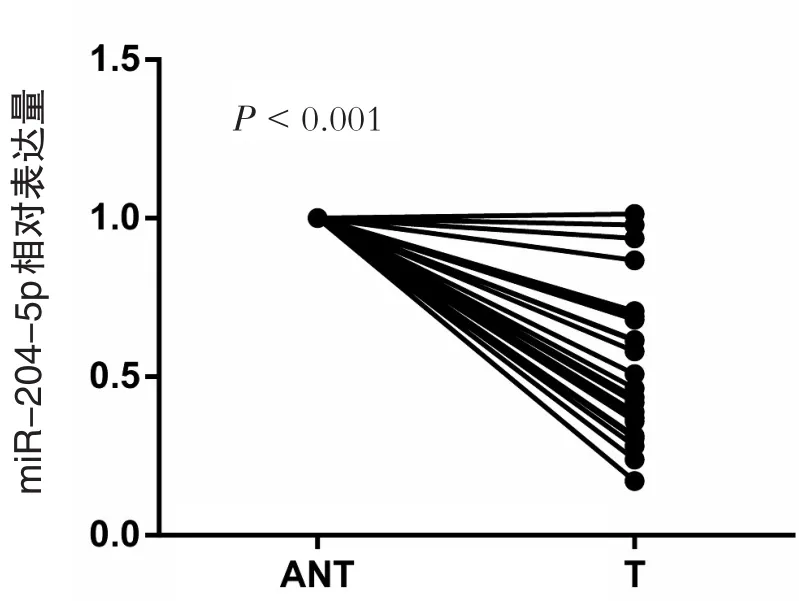
图1 miR-204-5p在结直肠癌组织中的表达情况
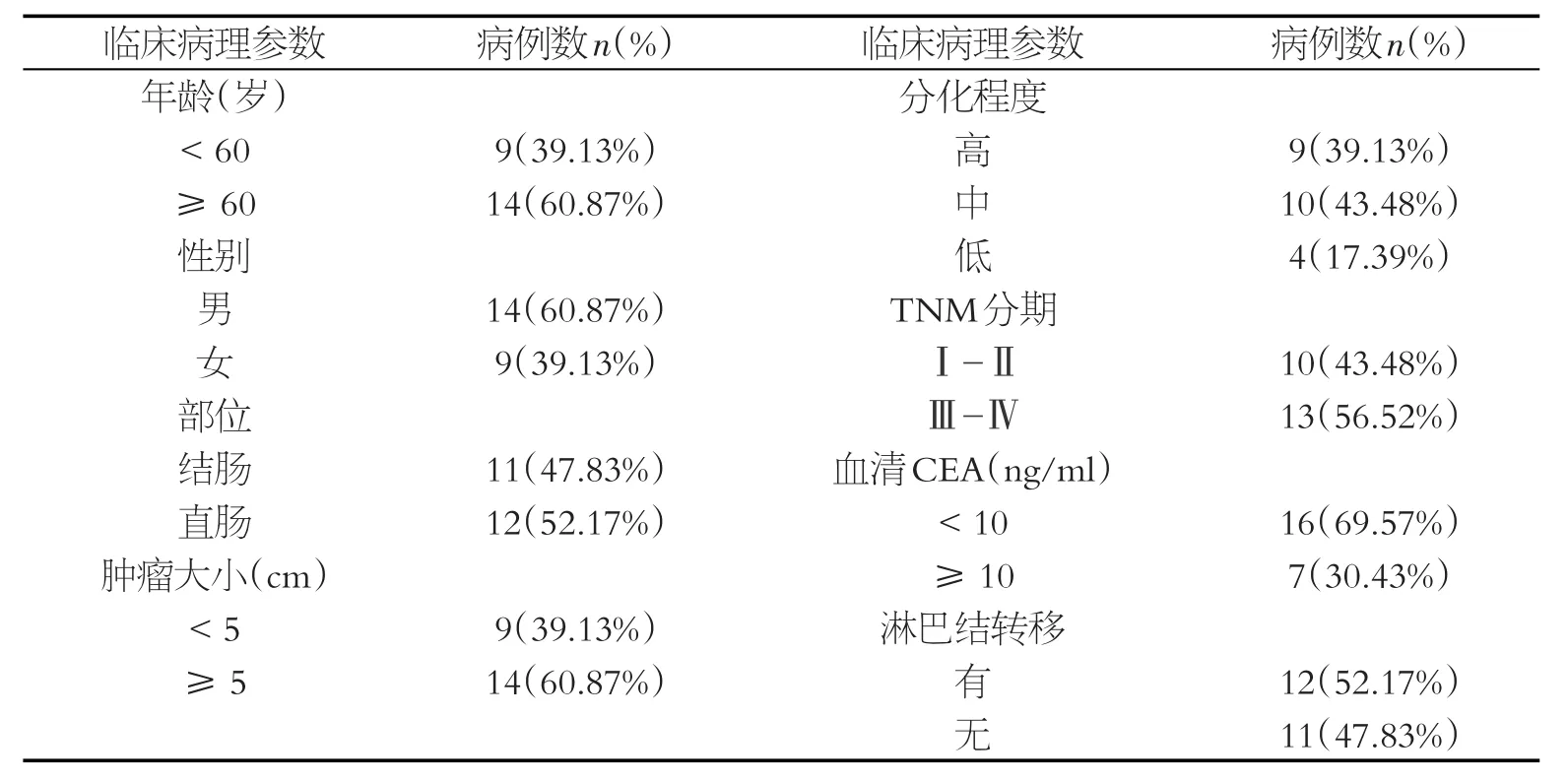
表1 结直肠癌患者临床病理资料
2.2 慢病毒转染效率的检测
过表达miR-204-5p的慢病毒载体及空载病毒分别转染HT29、LoVo细胞,72 h后置于荧光显微镜下观察,HT29-204-5p组、LoVo-204-5p组、HT29-NC组及LoVo-NC组均见绿色荧光(图2A)。RT-PCR结果显示HT29-204-5p组、LoVo-204-5p组中miR-204-5p的表达显著高于HT29-NC组、Lo⁃Vo-NC组(图2B),提示成功上调HT29及LoVo细胞中miR-204-5p的表达水平。
2.3 miR-204-5p抑制HT29、LoVo细胞的克隆形成
克隆形成实验结果显示,HT29-204-5p组、Lo⁃Vo-204-5p组、HT29-NC组、LoVo-NC组克隆形成率分别为(11±2.25)%、(14.67±3.33)%、(18.33±2.75)%及(27.67±2.93)%,HT29-204-5p 组 、Lo⁃Vo-204-5p组克隆形成率显著低于HT29-NC组、Lo⁃Vo-NC组,且HT29-204-5p组、LoVo-204-5p组克隆斑的体积也明显小于HT29-NC组、LoVo-NC组克隆斑的体积(图3)。
2.4 miR-204-5p抑制HT29、LoVo细胞的迁移
划痕实验结果显示,划痕24 h后HT29-204-5p组、LoVo-204-5p组、HT29-NC组和LoVo-NC组划痕愈合率分别为(16.03±2.35)%、(15.30±0.99)%、(25.41± 4.36)%及(37.79± 4.70)%,HT29-204-5p组、LoVo-204-5p组划痕愈合率显著低于HT29-NC组和LoVo-NC组划痕愈合率(图4)。
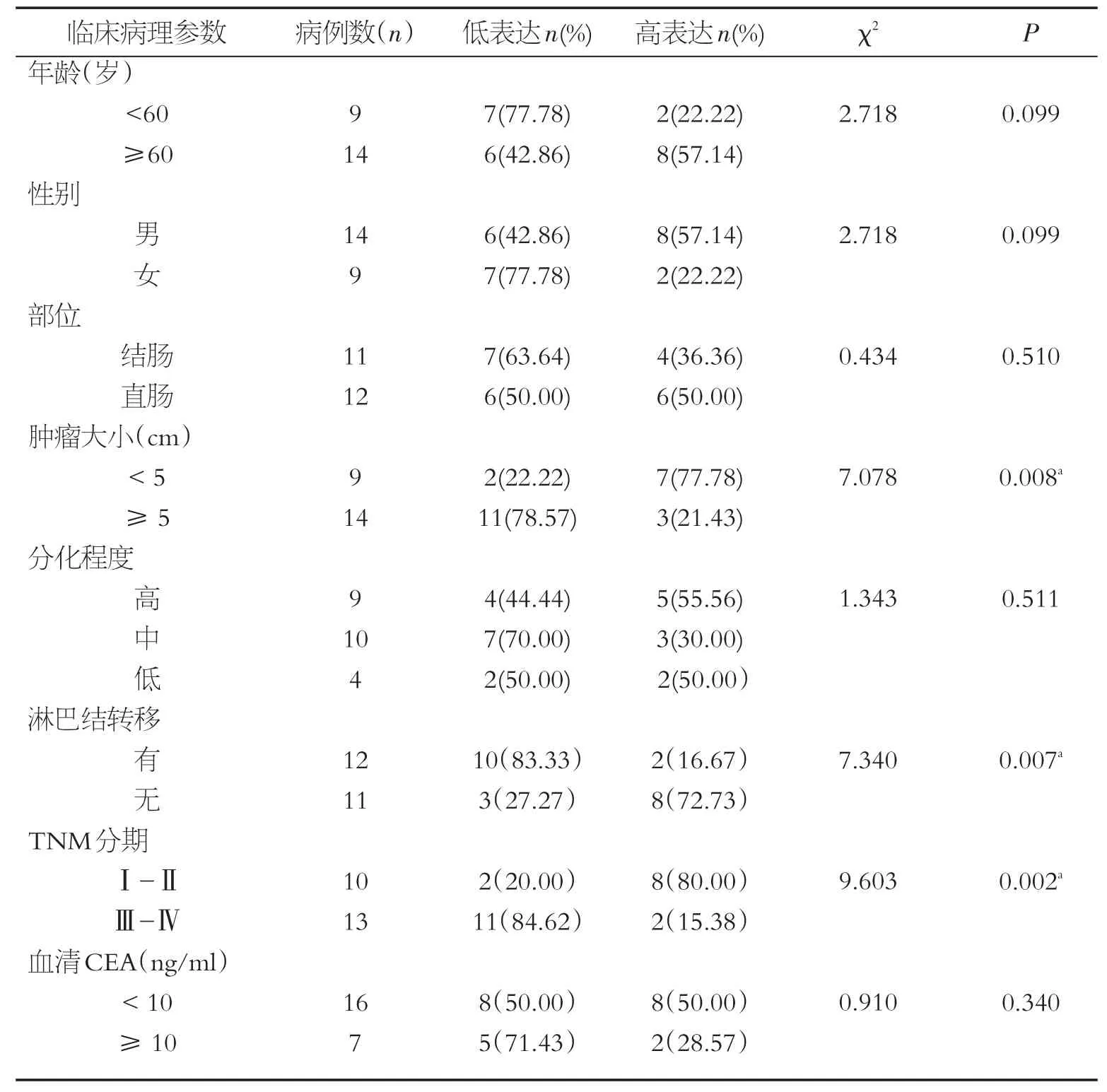
表2 结直肠癌中miR-204-5p表达水平与临床病理参数的关系
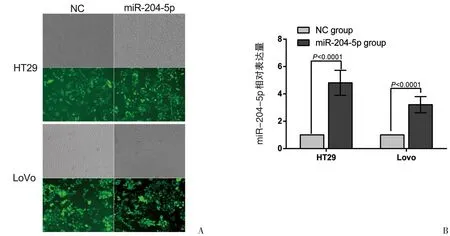
图2 慢病毒转染HT29、LoVo细胞情况
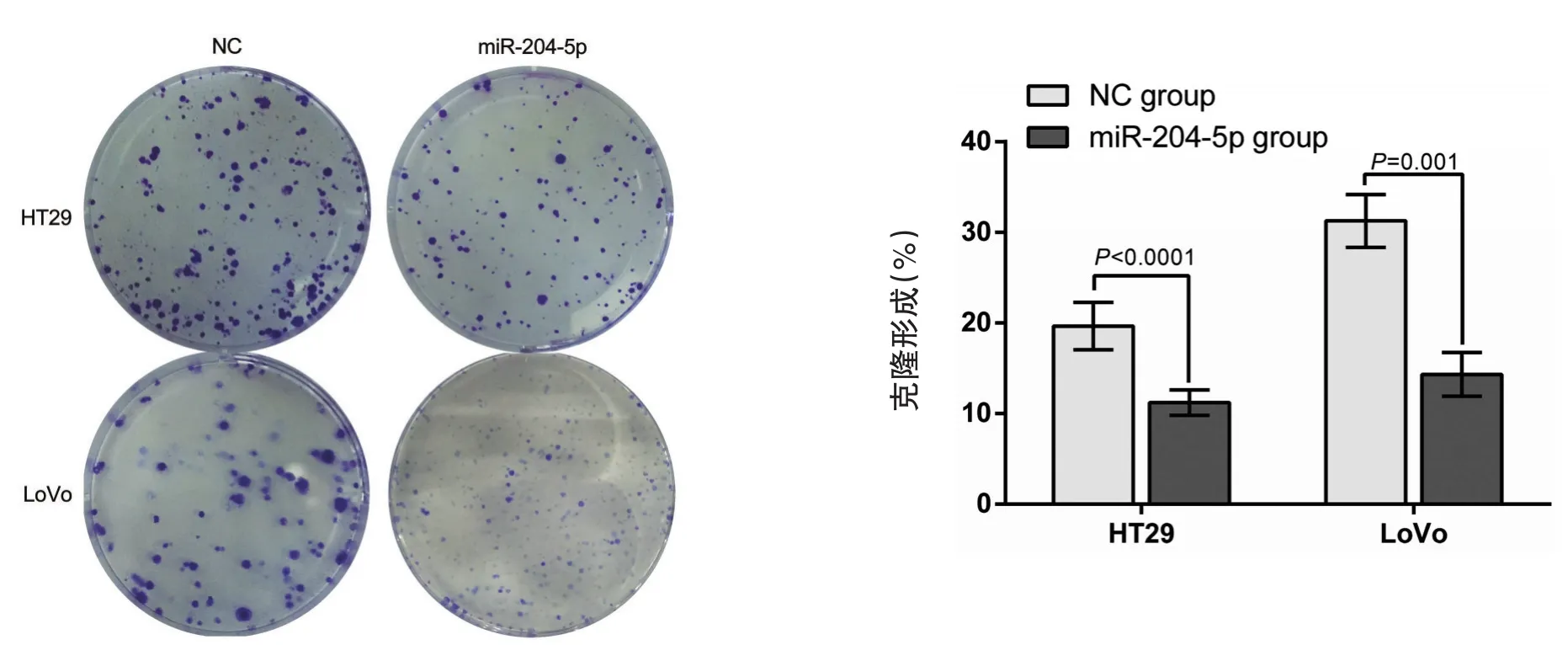
图3 过表达miR-204-5p后HT29、LoVo细胞平板克隆实验
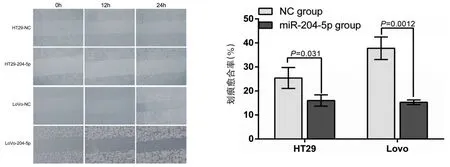
图4 过表达miR-204-5p后HT29、LoVo细胞划痕实验
2.5 miR-204-5p抑制HT-29细胞及LoVo细胞的侵袭
Transwell侵袭实验结果显示,HT29-204-5p组、LoVo-204-5p组、HT29-NC组和LoVo-NC组细胞透过数分别为(15.07±3.23)个、(51.47±4.35)个、(28.93±4.02)个及(112.9±7.73)个,HT29-204-5p组、LoVo-204-5p组细胞透过数显著少于HT29-NC组、LoVo-NC组细胞透过数(图5)。
2.6 miR-204-5p抑制HT29、LoVo细胞EMT
Western blot结果显示,与HT29-NC组、LoVo-NC组相比,HT29-204-5p组、LoVo-204-5p组E-cad⁃herin表达明显上调,Vimentin表达明显下调(图6)。
2.7 MAPRE2为miR-204-5p的潜在靶基因
生物信息软件TargetScan、microRNA.org及miR⁃TarBase预测发现MAPRE2可能为miR-204-5p的靶基因(图7 A)。Western blot结果显示,过表达miR-204-5p能下调MAPRE2表达水平(图7B)。
3 讨论
研究发现几乎所有恶性肿瘤中都存在miRNA的表达异常,miRNA靶向作用于癌基因或抑癌基因而参与肿瘤发生与发展,影响患者的预后[10]。研究发现miR-204-5p在宫颈癌、胃癌、乳腺癌、肾癌及甲状腺癌等多种恶性肿瘤中低表达[6,11-16]。研究还发现,miR-204-5p靶向作用于IGFBP5、BCL2、SIRT1、FOXC1、USP47及RAB22等多种基因而影响肿瘤的增殖、侵袭及转移[6-9],但关于miR-204-5p在结直肠癌中的研究较少。因此,探讨miR-204-5p在结直肠癌增殖、侵袭及迁移中的作用具有重要的意义。
本研究发现miR-204-5p在结直肠癌组织中低表达,这与其在胃癌、乳腺癌、肾癌、黑色素瘤等恶性肿瘤中的研究结果较一致[6,11-16]。临床病理资料显示miR-204-5p的表达水平与肿瘤大小、TNM分期及淋巴结转移相关,本研究还发现过表达miR-204-5p能显著削弱结直肠癌HT29、LoVo细胞增殖、侵袭及迁移的能力,这与其在甲状腺癌、口腔癌、喉癌及肝癌中的研究结果较一致[6-9],这些结果说明miR-204-5p能广泛参与各类肿瘤的发生和发展等过程,并能在一定程度上作为临床判断预后的指标及治疗的靶点。侵袭及转移是影响肿瘤患者预后的重要因素[17-18],而EMT是肿瘤细胞侵袭、转移的重要机制[19]。发生EMT后,上皮细胞的形态和表型向间充质细胞转变,并获得较强的迁移能力,其上皮标记物E-cadherin、Cytokeratin表达下调,而Vimentin、Fibronectin等间叶标记物上调。为了进一步研究miR-204-5p对结直肠癌侵袭、转移的机制,本实验检测了过表达miR-204-5p的HT29、LoVo细胞中E-cadherin及Vi⁃mentin的表达情况。结果显示miR-204-5p显著上调E-cadherin的表达,下调Vimentin的表达,提示miR-204-5p能抑制结直肠癌细胞EMT,这与Zeng J等[15]在乳腺癌中的研究结果较一致,部分解释了miR-204-5p抑制结直肠癌细胞侵袭、转移的机制。生物信息学软件TargetScan、microRNA.org及miR⁃
TarBase预测结果显示MAPRE2为miR-204-5p的潜在靶基因。MAPRE2蛋白是一种与细胞分裂、运动密切相关的微管相关蛋白,它可以通过下调细胞粘附分子N-cadherin的表达削弱细胞间的粘附能力[20],而其磷酸化调节在细胞有丝分裂的正确进行及维持基因组的稳定中发挥着关键性的作用[21]。Abiatari等[22]研究发现MAPRE2可通过调节微管的动态参与胰腺癌细胞的嗜神经侵袭,其表达水平与患者的预后负相关。本研究发现miR-204-5p抑制HT29、Lo⁃Vo细胞中MAPRE2的表达,提示miR-204-5p可能靶向作用于MAPRE2进而影响结直肠癌的恶性生物学行为,但这还需行进一步的相关试验来验证。
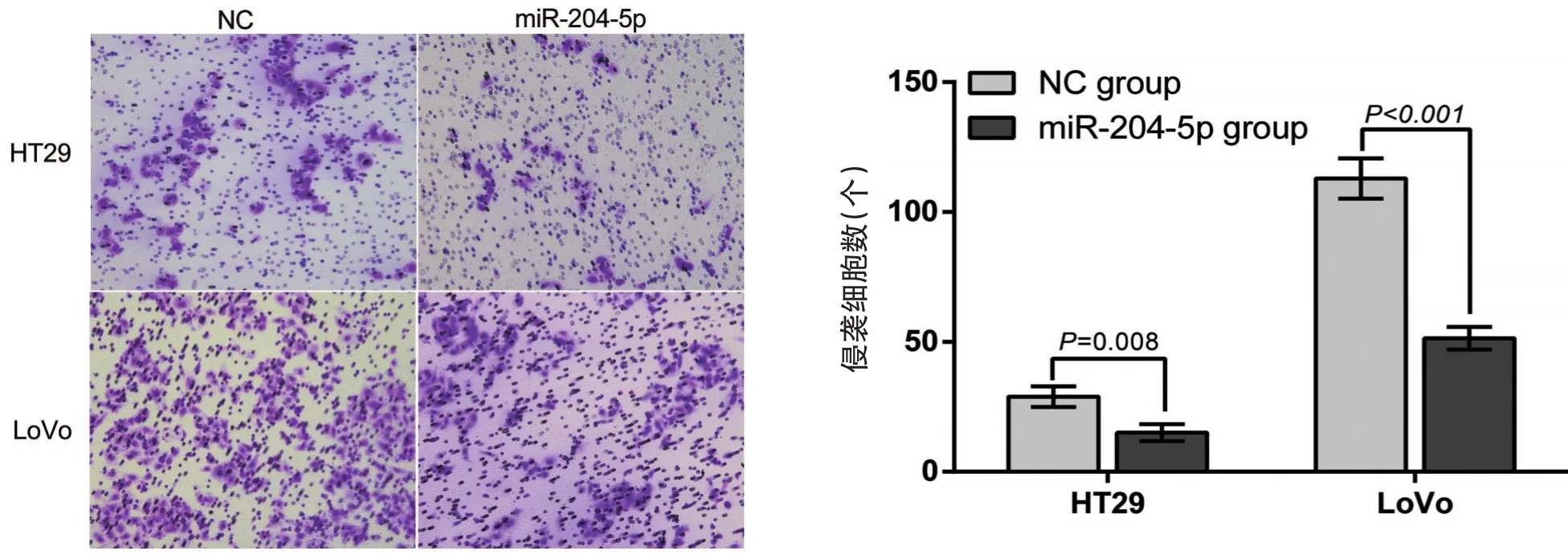
图5 过表达miR-204-5p后HT29、LoVo细胞Transwell小室侵袭实验
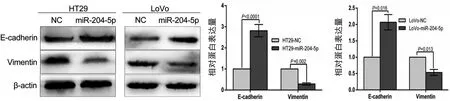
图6 过表达miR-204-5p后HT29、LoVo细胞EMT相关蛋白表达情况
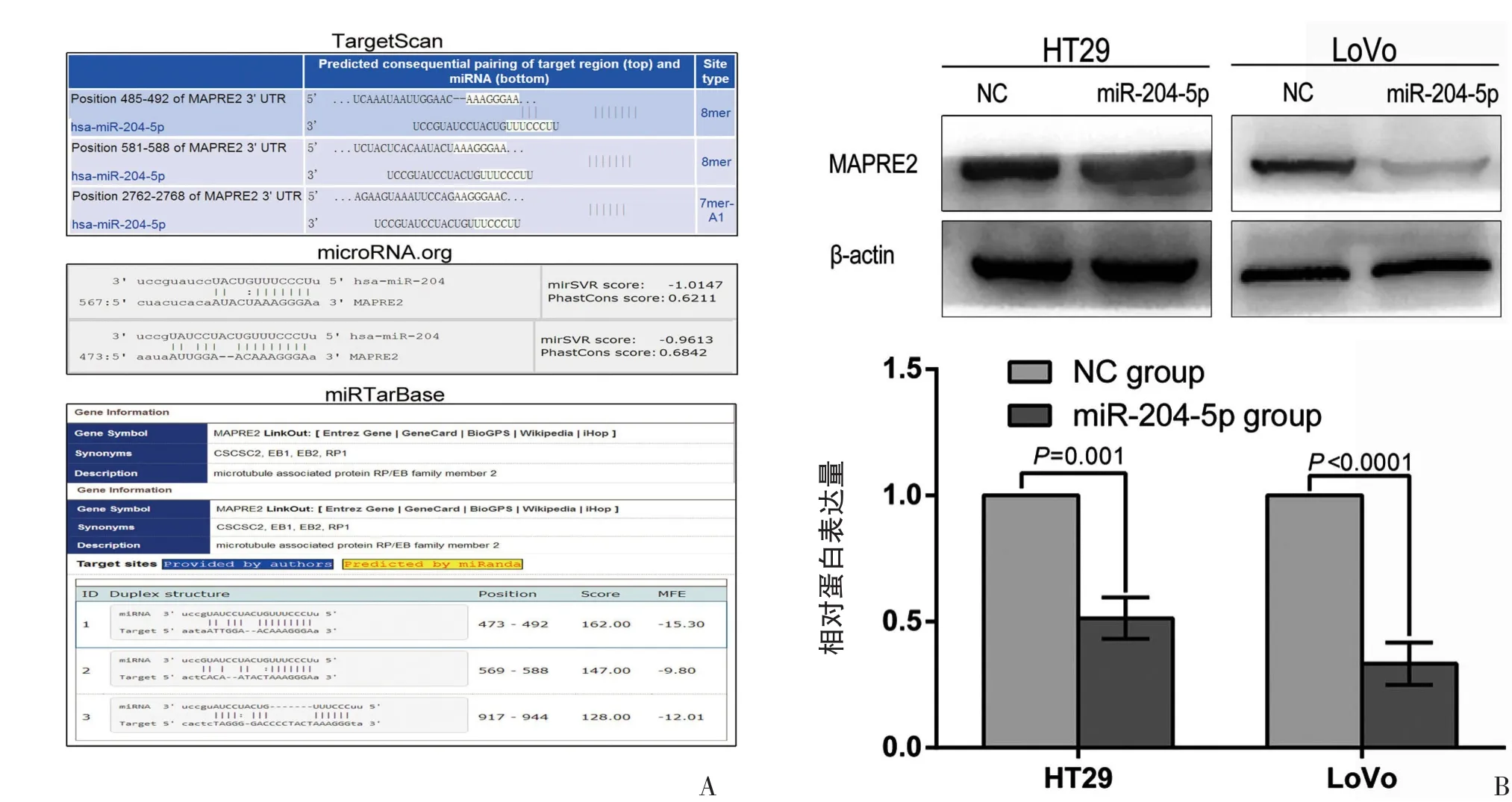
图7 miR-204-5p的靶基因预测情况
4 结 论
miR-204-5p在结直肠癌中低表达,其可能通过调控MAPRE2基因和EMT而抑制结直肠癌的增殖、侵袭及迁移,这为miR-204-5p可能作为诊治结直肠癌的新指标和新靶点提供了重要的理论依据。但目前尚未明确miR-204-5p是否通过直接作用于MA⁃PRE2而抑制结直肠癌的恶性生物学行为,仍需进一步研究。
1. Siegel RL,Miller KD,Fedewa SA,et al.Colorectal can⁃cer statistics,2017[J].CA Cancer J Clin,2017,67(3):177-193.
2. Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
3. Chen W,Zheng R,Zhang S,et al.Cancer incidence and mortality in China in 2013:an analysis based on urbaniza⁃tion level[J].Chin J Cancer Res,2017,29(1):1-10.
4. Brenner H,Kloor M,Pox CP.Colorectal cancer[J].Lan⁃cet,2014,383(9927):1 490-1 502.
5. Masuda T,Hayashi N,Kuroda Y,et al.MicroRNAs as biomarkers in colorectal cancer[J].Cancers(Basel),2017,9(9):124.
6. Liu L,Wang J,Li X,et al.MiR-204-5p suppresses cell proliferation by inhibiting IGFBP5 in papillary thyroid carcinoma[J].Biochem Biophys Res Commun,2015,457(4):621-626.
7. Wang X,Li F,Zhou X.miR-204-5p regulates cell pro⁃liferation and metastasis through inhibiting CXCR4 ex⁃pression in OSCC[J].Biomed Pharmacother,2016,82:202-207.
8. Gao W,Wu Y,He X,et al.MicroRNA-204-5p inhib⁃its invasion and metastasis of laryngeal squamous cell carci⁃noma by suppressing forkhead box C1[J].J Cancer,2017,8(12):2 356-2 368.
9. Jiang G,Wen L,Zheng H,et al.miR-204-5p targeting SIRT1 regulates hepatocellular carcinoma progression[J].Cell Biochem Funct,2016,34(7):505-510.
10. Mraz M,Pospisilova S.MicroRNAs in chronic lympho⁃cytic leukemia:from causality to associations and back[J].Expert Rev Hematol,2012,5(6):579-581.
11.Lee H,Kim KR,Cho NH,et al.MicroRNA expression profiling and Notch1 and Notch2 expression in minimal deviation adenocarcinoma of uterine cervix[J].World J Surg Oncol,2014,12:334.
12. Gowrishankar B,Ibragimova I,Zhou Y,et al.MicroR⁃NA expression signatures of stage,grade,and progression in clear cell RCC[J].Cancer Biol Ther,2014,15(3):329-341.
13.Chang H,Kim N,Park JH,et al.Different microRNA expression levels in gastric cancer depending on Helico⁃bacter pylori infection[J].Gut Liver,2015,9(2):188-196.
14. Kozubek J,Ma Z,Fleming E,et al.In-depth character⁃ization of microRNA transcriptome in melanoma[J].PLoS One,2013,8(9):e72 699.
15.Zeng J,Wei M,Shi R,et al.MiR-204-5p/Six1 feed⁃back loop promotes epithelial-mesenchymal transition in breast cancer[J].Tumour Biol,2016,37(2):2 729-2 735.
16. Luo YH,Tang W,Zhang X,et al.Promising significance of the association of miR-204-5p expression with clini⁃copathologicalfeaturesofhepatocellularcarcinoma[J].Medicine(Baltimore),2017,96(30):e7 545.
17. Friedl P,Locker J,Sahai E,et al.Classifying collective cancer cell invasion[J].Nat Cell Biol,2012,14(8):777-783.
18. Mareel M,Leroy A.Clinical,cellular,and molecular as⁃pects of cancer invasion[J].Physiol Rev,2003,83(2):337-376.
19. Iwatsuki M,Mimori K,Yokobori T,et al.Epitheli⁃al-mesenchymal transition in cancer development and its clinical significance[J].Cancer Sci,2010,101(2):293-299.
20. Stenner F,Liewen H,Göttig S,et al.RP1 Is a Phosphory⁃lation target of CK2 and is involved in cell adhesion[J].Plos One,2013,8(7):67 595.
21. Iimori M,Watanabe S,Kiyonari S,et al.Phosphorylation of EB2 by Aurora B and CDK1 ensures mitotic progres⁃sion and genome stability[J].Nature Communications,2016,7:11 117.
22. Abiatari I,Gillen S,DeOliveira T,et al.The microtu⁃bule-associated protein MAPRE2 is involved in perineu⁃ral invasion of pancreatic cancer cells[J].Int J Oncol,2009,35(5):1 111-1 116.

