鼻咽癌放射治疗后颞叶脑白质的DTI研究
王 莉,韩福刚,舒 健,赵冬梅
(西南医科大学附属医院放射科,四川泸州 646000)
鼻咽癌(nasopharyngeal carcinoma,NPC)是危及人类健康的常见恶性肿瘤。放射治疗是临床治疗鼻咽癌最主要的方法,5年总生存率达55%[1]。但是在放疗过程中,由于不可避免的将毗邻的颞叶、脑干等正常组织也暴露于较高辐射剂量,会造成程度不等的放射性损伤反应,其生化环境和细胞代谢必然会发生一定变化。磁共振扩散张量成像(diffusion ten⁃sor imaging,DTI)能够在分子水平检测出脑白质纤维的细微改变,反映组织及病变的生理改变。本文对鼻咽癌放疗后常规MRI表现正常的双侧颞叶脑白质进行DTI成像,通过测量FA值、ADC值,观察放疗后颞叶脑白质发生的损伤改变,为临床能更好的预防和治疗放射性脑病提供一定的影像学依据。
1 资料与方法
1.1 研究对象
放疗组:选取2015年3~12月期间在本院放射科接受MRI检查并符合本研究纳入标准的鼻咽癌放疗后患者52例。男28例,女24例,年龄38~67岁。其中6例患者临床有头痛,8例有听力下降,2例有耳鸣的症状。纳入标准:①经病理检查证实为鼻咽癌且首次接受放射治疗者;②患者放、化疗方案接近,放疗照射部位为颈部及鼻咽部,放疗总剂量为70~72 GY,分割剂量1.8~2.0 GY,分割次数均为33次;③无鼻咽癌颅内侵犯,无颅内脑实质肿瘤、无颅脑手术、血管性病变及脑组织炎症等病史;④常规MRI检查颅内无异常信号改变。将放疗组分4组:放疗后≤3个月为第1组(17例)、放疗后3~6个月为第2组(18例)、放疗后6~12个月为第3组(10例)及放疗后>12个月为第4组(7例)。
对照组:为同时期在本院做健康体检者24例,男15例,女9例,年龄40~67岁。临床均无不适症状,无颅内肿瘤、血管性及炎症性疾病等病史,无脑部放射线照射史,常规MRI检查颅内无异常信号改变。
1.2 仪器设备
采用PHILIPS公司3.0T Achieva双梯度超导型高场磁共振成像仪及头颈联合16通道相控阵线圈。
1.3 方法
放疗组及对照组研究对象共计76例,常规MRI(T1WI、T2WI、FLAIR)检查结束后进行DTI检查,使用单次激发的SE-EPI序列,施加扩散敏感梯度方向为15个。TR 6 600 ms,TE 78 ms,b值为0和1 000 s/mm2,FOV 224 mm × 224 mm,层厚2 mm,层间距为2 mm,NSA=2,矩阵128× 128,扫描时间为4分10秒。增强扫描为在T1加权成像基础上注射造影剂获得(注:增强扫描须在DTI检查结束后进行)。扫描结束后利用Functool软件生成FA图以及ADC图(见图1)。选择一层(大脑脚层面)双侧颞叶脑白质显示较好的FA图、ADC图,分别在双侧颞叶脑白质内(双侧脑室下角旁)选择3个大小为30 mm2的圆形感兴趣区(ROI),见图2。计算出相应的FA值及ADC值,最终值为一侧颞叶脑白质3次所测值的平均值。
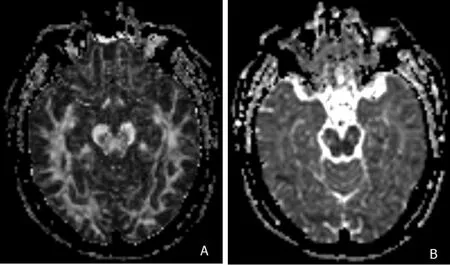
图1 FA图及ADC图
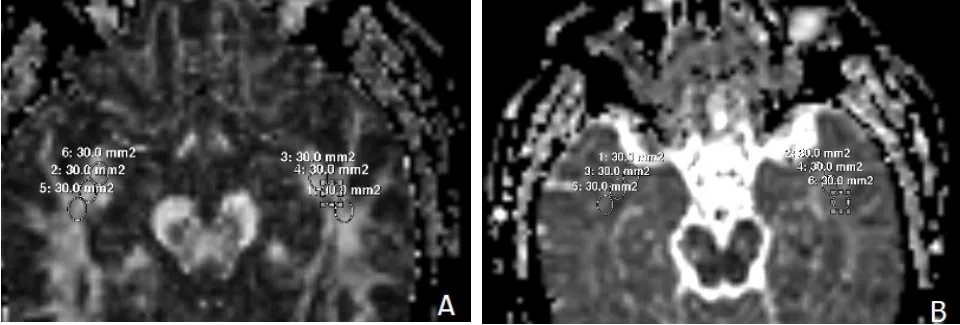
图2 FA图及ADC图的ROI定位图
1.4 统计分析
利用SPSS 17.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,对照组与放疗组间性别及年龄的对比分别采用卡方检验及两独立样本t检验。双侧颞叶所得各组均数值采用两独立样本t检验进行比较。将放疗组按前述分期分为4组,先行方差齐性检验,采用单因素方差分析(one-way ANO⁃VA)比较对照组与放疗后4组间差异是否具有统计学意义,方差齐时两两比较采用LSD检验;方差不齐时采用Welch检验,两两比较采用Dunnett’T3方法。以α=0.05为检验水准,P<0.05为差异具有统计学意义。
2 结 果
2.1 一般资料
放疗组与对照组间年龄(t=0.501,P=0.479)及性别(t=0.190,P=0.850)对比,差异均无统计学意义。
2.2 DTI结果
2.2.1 测定的FA值
对照组和放疗后4组FA值的方差齐性检验结果为方差齐性(P=0.142),单因素方差分析组间差异有统计学意义(P<0.05)。与对照组相比,放疗后4组的FA值均较对照组下降,其中第1~3组与对照组间差异具有统计学意义,其余两两对比差异无统计学意义(见表1)。鼻咽癌放疗后,双侧颞叶脑白质的FA值在前6个月内下降,6个月后逐渐升高。第4组的FA值虽然有所降低,但与对照组间差异无统计学意义(P>0.05),见图3~4。
表1 对照与放疗组间FA值的比较(±s)
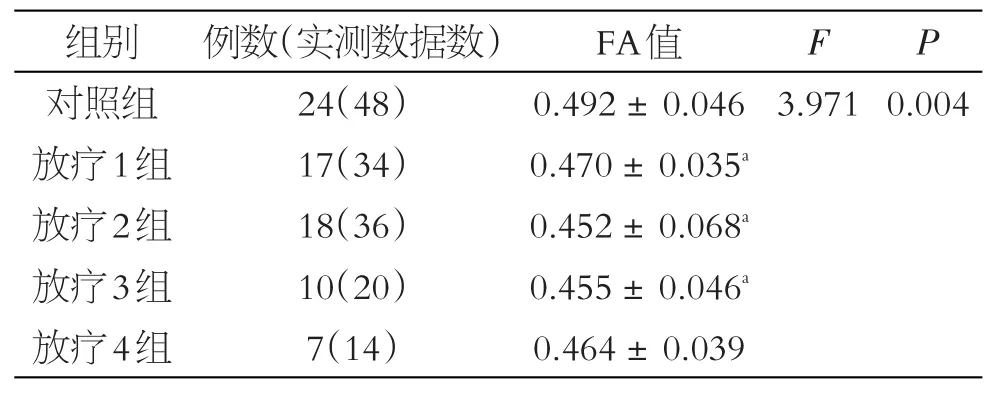
表1 对照与放疗组间FA值的比较(±s)
注:a与对照组比较,P<0.05
组别对照组放疗1组放疗2组放疗3组放疗4组例数(实测数据数)24(48)17(34)18(36)10(20)7(14)FA值0.492±0.046 0.470±0.035a 0.452±0.068a 0.455±0.046a 0.464±0.039 F P 3.9710.004
2.2.2 测定的ADC值
对照组与放疗后4组间的方差齐性检验为方差不齐(P=0.000),采用Welch检验,放疗后4组与对照组间差异具有统计学意义(P<0.05)。鼻咽癌患者放疗结束后放疗2组ADC值与对照组之间差异具有统计学意义(P<0.05),其余两两对比差异均无统计学意义(见表2、图5)
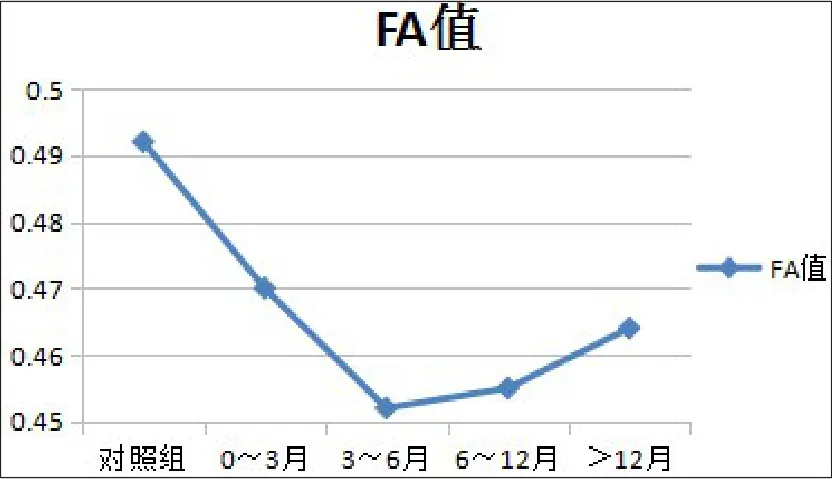
图3 对照组与放疗后4组平均FA值随时间变化曲线图
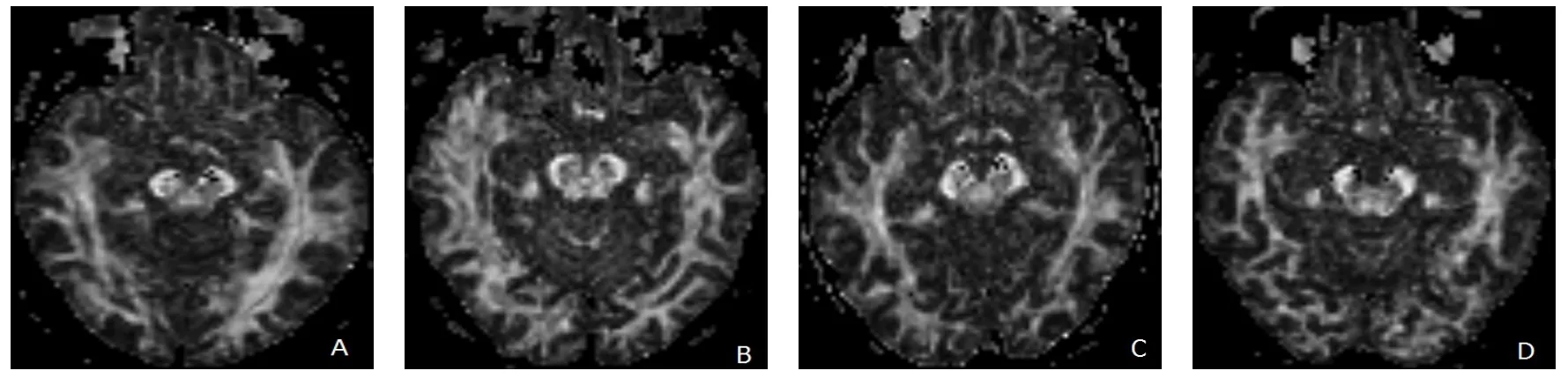
图4 放疗组的FA图
表2 对照组与放疗组间ADC值的比较(±s)
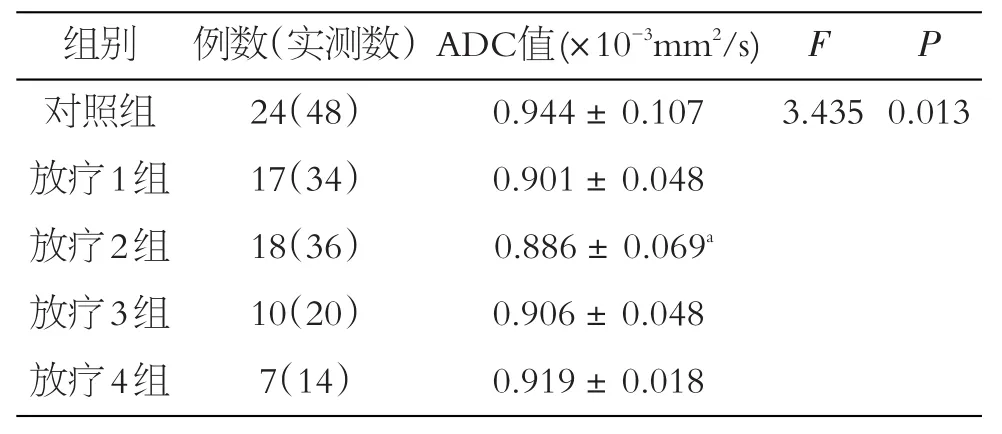
表2 对照组与放疗组间ADC值的比较(±s)
注:a与对照组比较,P<0.05
组别对照组放疗1组放疗2组放疗3组放疗4组例数(实测数)24(48)17(34)18(36)10(20)7(14)ADC值(×10-3mm2/s)0.944±0.107 0.901±0.048 0.886±0.069a 0.906±0.048 0.919±0.018 F P 3.4350.013
3 讨论
DTI是在磁共振扩散加权成像基础上发展而来的功能成像技术,通过量化水分子扩散的各向异性改变,来间接反映活体组织脑白质纤维束的完整性及功能的改变[2]。ADC值用于定量不同方向水分子扩散的速度和范围,反映众多对水分子弥散作用有影响的各个因素的综合结果。ADC值越大,扩散越不受限。FA值反映的是在整个扩散张量中水分子的各向异性成分所占的比例,与组织结构髓鞘的完整性,神经纤维的直径、密度以及胶质细胞的密度等因素有关。有学者通过对小鼠模拟这种颅脑放射治疗实验显示,虽然尚未进展为放射性脑病,但是小鼠颅脑在照射后原本正常的脑组织已出现了神经组织及血管的损伤[3-4]。进而可引起细胞毒性水肿、血管源性水肿等一系列改变,因此水分子弥散会随之发生改变。DTI成像不仅是鉴别肿瘤复发与放射性脑病的敏感方法[5],还能够用于监测放射治疗后脑白质存在的微观病理改变[6]。
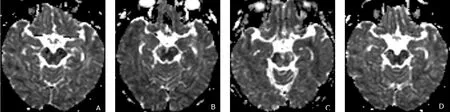
图5 放疗组的ADC图
本研究中,放疗后各组颞叶脑白质的FA值均较对照组有不同程度的下降。双侧颞叶的FA值在放疗后0~3个月、3~6个月及6~12个月降低,其中在3~6个月这个时间段下降至最低,推测在放疗后6个月内血管内皮损伤,炎症细胞浸润,部分微小血管血栓形成继发脑组织的缺血及神经元细胞的脱髓鞘引起水分子在沿髓鞘方向的扩散速度减慢,FA值降低;随后逐渐回升在放疗后12个月基本恢复但略低于正常,说明放射性脑损伤在放疗停止后随着时间的延长会有所恢复,大部分的损伤都是可逆的,最后仍低于正常对照组而不能完全恢复至正常水平,推测可能是由于早期脑白质的放射性脑损伤中神经纤维部分发生了选择性的结构破坏,亦或是晚期存在炎症细胞的浸润和免疫机制的继续损伤。与Xiong等[7]研究的9个月以后开始恢复稍有差别。
本组研究ADC结果显示:鼻咽癌放射治疗结束后3~6个月双侧颞叶的ADC值较正常对照降低,6个月后恢复至正常水平,与梁杰等[8]的研究结果中3个月后开始升高有些差异。鼻咽癌患者放疗结束后,血管内皮损伤继发脑组织的缺血缺氧,细胞膜钠钾泵功能失调,大量水分子进入细胞内使细胞肿胀,水分子在细胞内弥散受到限制,细胞肿胀又使细胞外的间隙变小,因此,水分子在细胞内外间隙的弥散均受限。本组结果显示,放疗后双侧颞叶ADC值在6个月内下降,说明双侧颞叶虽然常规影像学并未发现异常,但是在分子水平已经发生了细胞毒性水肿,致使水分子的弥散能力在放疗结束后降低;而6个月后逐渐恢复,可能是双侧颞叶脑白质因放疗产生的毛细血管渗透性改变在放疗结束后有一定程度的恢复,加上髓鞘的再生引起屏障作用的减弱,使水分子的扩散速率又再次上升,导致ADC值升高。陈学文等[9]研究显示双侧颞叶白质的ADC值在放疗后3个月内较放疗前降低,若在放疗结束后6个月后逐渐升高并恢复至放疗前水平则不会进展为放射性脑病;而进展为放射性脑病者,ADC值在6个月后与放疗前比较会有明显的变化。刚宪祯等[10]研究指出,放射性脑损伤若进一步发展会进入血管源性水肿阶段,此时血脑屏障破坏,大量水分子进入到细胞外,在细胞外间隙弥散加快,ADC值升高。
4 结 论
综上所述,DTI对鼻咽癌放疗后双侧颞叶脑组织放射性脑损伤的检测具有较高的敏感性,可以在常规MRI发现异常之前及早的发现早期放射性脑损伤。这种常规MRI显示正常的颞叶脑白质的放射性脑损伤是可逆的。因此,通过动态的监测双侧颞叶水分子扩散的改变,DTI成像可以动态观察放射性脑损伤的发生发展过程,是检测放射性脑损伤的有效方法。
1. Gokce T,Unlu I,Akcay C.Evaluation of overall survival of nasopharyngeal carcinoma patients treated in ten years at a single institution[J].J BUON,2010,15(1):36-42.
2. Melhem ER,Mori S,Mukundan G,et al.Diffusion ten⁃sor MR imaging of the brain and white matter tractogra⁃phy[J].AJR Am J Roentgenol,2002,178(1):3-16.
3. Yuan H,Gaber MW,Boyd K,et al.Effects of fractionat⁃ed radiation on the brain vasculature in a murine model:blood-brain barrier permeability,astrocyte proliferation,and ultrastructural changes[J].Int J Radiat Oncol Biol Phys,2006,66(3):860-866.
4. Wu KL,Tu B,Li YQ,et al.Role of intercellular adhe⁃sion molecule-1 in radiation-induced brain injury[J].Int J Radiat Oncol Biol Phys,2010,76(1):220-228.
5. Matsusue E,Fink JR,Rockhill JK,et al.Distinction be⁃tween glioma progression and post-radiation change by combined physiologic MR imaging[J].Neuroradiology,2010,52(4):297-306.
6. Chawla S,Wang S,Kim S,et al.Radiation injury to the normal brain measured by 3D-echo-planar spectroscopic imaging and diffusion tensor imaging:initial experience[J].J Neuroimaging,2015,25,(1):97-104.
7. Xiong WF,Qiu SJ,Wang HZ,et al.1H-MR spectrosco⁃py and diffusion tensor imaging of normal-appearing tem⁃poral white matter in patients with nasopharyngeal carci⁃noma after irradiation:initial experience[J].J Magn Re⁃son Imaging,2013,37(1):101-108.
8. 梁杰,覃飞,陈伟华,等.DWI技术在鼻咽癌早期放射性脑损伤中的应用价值[J].临床影像技术,2016,31(1):59-61.
9. 陈学文,卜雨华,付飞先,等.鼻咽癌放疗后早期放射性脑损伤的磁共振扩散加权成像研究[J].实用医学影像杂志,2014,15(5):305-307.
10. 刚宪祯,汪延明.鼻咽癌放疗后放射性脑损伤的MRI扩散加权成像研究[J].中国临床医师杂志(电子版),2008,2(2):160-166.

