微小核糖核酸miR-449a对前列腺癌细胞凋亡的影响
李森茂,李 昂,胡 嘏,余 虓,王少刚,叶章群
(华中科技大学同济医学院附属同济医院泌尿外科,湖北武汉 430030)
微小RNA(miRNA)是一种进化上保守的内源性的小非编码RNA,主要通过靶向结合3'-UTR,调节mRNA的稳定性和蛋白的翻译来发挥作用[1]。在过去的十几年里,很多体内和体外的实验研究已经证明,miRNA在肿瘤的发生发展中起关键作用[2],有些miRNA已被提出作为癌症治疗的新型潜在靶标[3]。目前为止,有研究表明miR-449a在多种肿瘤中呈现较低表达,包括肝癌、胃癌等,能够抑制肿瘤细胞增殖、侵袭和转移[4-5]。本实验旨在探究miR-449a在前列腺癌组织和细胞中的表达,观察在前列腺癌细胞株中过表达miR-449a对前列腺癌细胞凋亡的影响,并研究此过程细胞中一些凋亡相关蛋白的表达情况。
1 材料与方法
1.1材料miR-449a mimics和随机对照序列(dsControl)(广州市锐博生物科技有限公司);人前列腺永生化上皮细胞RWPE-1以及人前列腺癌细胞系PC3、 DU145和LnCap(中国武汉典型培养物保藏中心);胎牛血清、Opti-MEM®无血清培养基、RPMI1640培养基、K-SFM无血清培养基(美国GIBCO公司); Lipofectamine®RNAiMAX转染试剂、溴化丙啶(PI)(美国Invitrogen公司);PCR引物合成、All-in-oneTMmiRNAqPCR Kit (广州复能基因公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司);一抗鼠抗B淋巴细胞瘤/白血病-2基因(Bcl-2)、一抗兔抗Bcl-2相关蛋白X(Bax)、天冬氨酸特异酶切的半胱氨酸蛋白酶-3(Caspase-3)(美国Affinity公司)、激活型天冬氨酸特异酶切的半胱氨酸蛋白酶-3(Cleaved caspase-3)(美国Cell Signaling Technology公司);一抗鼠抗β-肌动蛋白(β-actin)、辣根过氧化物酶标记的二抗羊抗小鼠IgG、辣根过氧化物酶标记的二抗羊抗兔IgG(武汉博士德公司);超敏ECL发光试剂盒(美国Millipore公司);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜;RNA酶A(美国Sigma公司);凯基细胞凋亡检测试剂盒(江苏凯基生物股份有限公司),Caspase3/7活细胞荧光实时法检测试剂盒(江苏凯基生物股份有限公司)。
1.2组织样本及细胞培养前列腺癌组织标本及相应癌旁组织标本均取于本院泌尿外科进行前列腺癌根治切除术患者的术后组织,切取标本均获得医院伦理委员会同意并且提前向患者本人签署知情同意。组织手术切除后,经具较高资格医师指导下,分辨出癌组织和癌旁组织,并分别切取较小直径组织块,数秒内装入预先做好标记的冻存管,随即放入液氮速冻,置于-80 ℃超低温冰箱存留备用。人前列腺永生化上皮细胞RWPE-1于含0.05 mg/mL牛垂体提取物(bovine pituitary extract,BPE)及5 ng/mL人重组表皮生长因子(epidermal growth factor,EGF)的K-SFM无血清培养基中培养,人前列腺癌细胞系PC3、DU145、LnCap细胞,用含10%胎牛血清的RPMI 1640培养基在37 ℃、5% CO2孵育箱中培养。
1.3dsRNA、miRNA序列的选择和细胞转染dsControl是一组已知的缺少人类基因重要同源性的dsRNA,正义链:5′ACUACUGAGUGACAGUAGA[dT][dT]3′;反义链:5′UCUACUGUCACUCAGUAGU[dT][dT] 3′;miR-449a的序列为:3′UGGUCGAUUGUUAUGUGACGGU5′。取对数生长期的细胞接种于6孔细胞培养板,转染时细胞融合度约为60%。根据对前列腺癌细胞的不同处理分为2组:阴性对照组(转染dsControl)、实验组(转染miR-449a mimics)。接种板12 h后,采用转染试剂Lipofectamine®RNAiMAX进行转染实验,保证dsRNA或miRNA的终浓度为75 nmol/L。24 h后观察细胞状态并及时更换含血清培养基。
1.4总RNA的提取和qPCR分析将转染72 h后收集的细胞以及在液氮中研磨成粉末的组织置于1.5 mL的离心管中,利用Trizol法提取细胞和组织中总RNA,然后分析细胞和组织中miR-449a的表达水平。miR cDNA合成参照广州复能基因All-in-oneTMmiRNAqPCR Kit试剂盒说明操作,反应条件为:①预变性:95 ℃、10 min、1个循环;②PCR扩增:共40个循环,每个循环包括变性(95 ℃、10 s)、退火(60 ℃、20 s)、延伸(72 ℃、20 s)。利用MX3000P荧光实时定量PCR仪进行上述实时定量PCR反应及检测,U6 snRNA作为内参。结果数据采用2-ΔΔCt方法分析。
1.5流式细胞术检测细胞凋亡转染72 h后,离心收集细胞,弃培养基;用冷PBS洗涤细胞两次(2 000 r/min,离心时间5 min收集细胞);用200 μL 缓冲液悬浮细胞,然后分别加入5 μL Annexin V-FITC和5 μL PI,轻轻混匀后于2~8 ℃避光条件下孵育10 min,在1 h内用流式细胞仪检测各组细胞凋亡情况。
1.6总蛋白的提取和Westernblot实验转染后72 h收集细胞用于蛋白表达的分析。用磷酸盐缓冲液(phosphate buffer saline,PBS)洗2遍,弃上清,加入含有蛋白酶抑制剂(phenylmethanesulfonyl fluoride,PMSF)的RIPA裂解液,置于冰上(4 ℃)裂解30 min,12 000 g离心15 min收集上清。用BCA蛋白浓度测定试剂盒测定蛋白浓度。每个样本加25 μg蛋白至SDS-PAGE胶进行电泳,使用PVDF膜转膜后用含5%牛血清白蛋白的TBST溶液室温封闭1 h后,分别与一抗鼠抗Bcl-2(1∶1 000)、兔抗Bax(1∶1 000)、兔抗Caspase-3(1∶1 000)、兔抗Cleaved caspase-3(1∶1 000)、鼠抗β-Actin(1∶500) 4 ℃孵育过夜。第2天采用羊抗鼠的二抗(1∶5 000)、羊抗兔的二抗(1∶5 000)孵育1 h,使用ECL曝光显影。
1.7Caspase3/7活细胞荧光时实法检测细胞凋亡情况转染细胞72 h后,用新鲜的培养基轻轻洗涤细胞3次,最后加入2 mL新鲜培养基,加入2 μL Caspase3/7检测液,37 ℃避光孵育30 min,然后荧光显微镜下观察并拍照计数、分析结果。

2 结 果
2.1miR-449a在前列腺癌组织及细胞系中的表达RT-qPCR结果显示,miR-449a在9对前列腺癌组织和癌旁组织中,其信使RNA的相对表达量平均值分别为(0.481±0.055)、(0.951±0.039);miR-449a在前列腺癌组织中的表达明显降低,与癌旁组织中表达相比较,差异有统计学意义(P<0.05)。检测前列腺上皮细胞株RWPE-1和PC3、DU145、LnCap前列腺癌细胞系中miR-449a信使RNA的相对表达量分别为(0.967±0.062)、(0.24±0.07)、(0.493±0.089)、(0.431±0.088);与正常前列腺上皮细胞RWPE-1中miR-449a信使RNA的表达相比较,前列腺癌细胞系中miR-449a信使RNA的表达量明显降低,差异有统计学意义(P<0.05)。结果表明,在前列腺癌组织和细胞系中,miR-449a均呈较低表达,我们选择PC3、DU145细胞继续后面实验研究(图1)。

图1前列腺癌组织及细胞系中miR-449amRNA相对表达情况
与正常组织相比较,*P<0.05,**P<0.01;A:RT-qPCR检测前列腺组织中miR-449a的相对表达量,横坐标字母A~I分别表示一对正常组织和癌组织;B:RT-qPCR检测前列腺组织中miR-449a相对内参U6的表达量均值;与RWPE-1细胞相比较,**P<0.01,***P<0.001;C:RT-qPCR检测各细胞中miR-449a的相对表达量。
2.2流式细胞术检测各组细胞凋亡结果显示,转染miR-449a mimics 72 h后,对照组和实验组中PC3细胞的凋亡率分别为(4.827±0.756)%、(21.691±1.813)%,两组比较差异有统计学意义(F=43.32,P<0.05);DU145细胞的凋亡率分别为(3.79±0.72)%、(13.88±0.712)%,两组比较差异有统计学意义(F=483.22,P<0.05)。两组结果说明了miR-449a具有促进前列腺癌细胞凋亡的作用(图2)。

图2miR-449a对PC3和DU145细胞凋亡的影响
与对照组比较,*P<0.05,**P<0.01;A:流式细胞术检测PC3细胞凋亡;B:PC3细胞凋亡率;C:流式细胞术检测DU145细胞凋亡;D:DU145细胞凋亡率。
2.3Caspase3/7活细胞荧光时实法检测细胞凋亡情况结果显示,在转染miR-449a mimics 72 h后,与对照组相比较,实验组中PC3 和DU145细胞在荧光显微镜下,绿色荧光强度明显较强,说明实验组中细胞凋亡的程度较严重,即说明了miR-449a具有促进前列腺癌细胞的凋亡的作用(图3)。

图3采用Caspase3/7活细胞荧光时实法检测PC3和DU145不同处理组细胞的凋亡情况
(绿色荧光的强弱表示凋亡的程度,×100)
2.4Westernblot检测各组细胞中凋亡相关蛋白的表达与对照组相比较,实验组在转染miR-449a mimics 72 h后,前列腺癌细胞株PC3和DU145细胞中,Bcl-2蛋白表达下降,而Bax、Caspase-3、Cleaved caspase-3表达上调。实验组和对照组比较,差异具有统计学意义(P<0.05)(图4)。
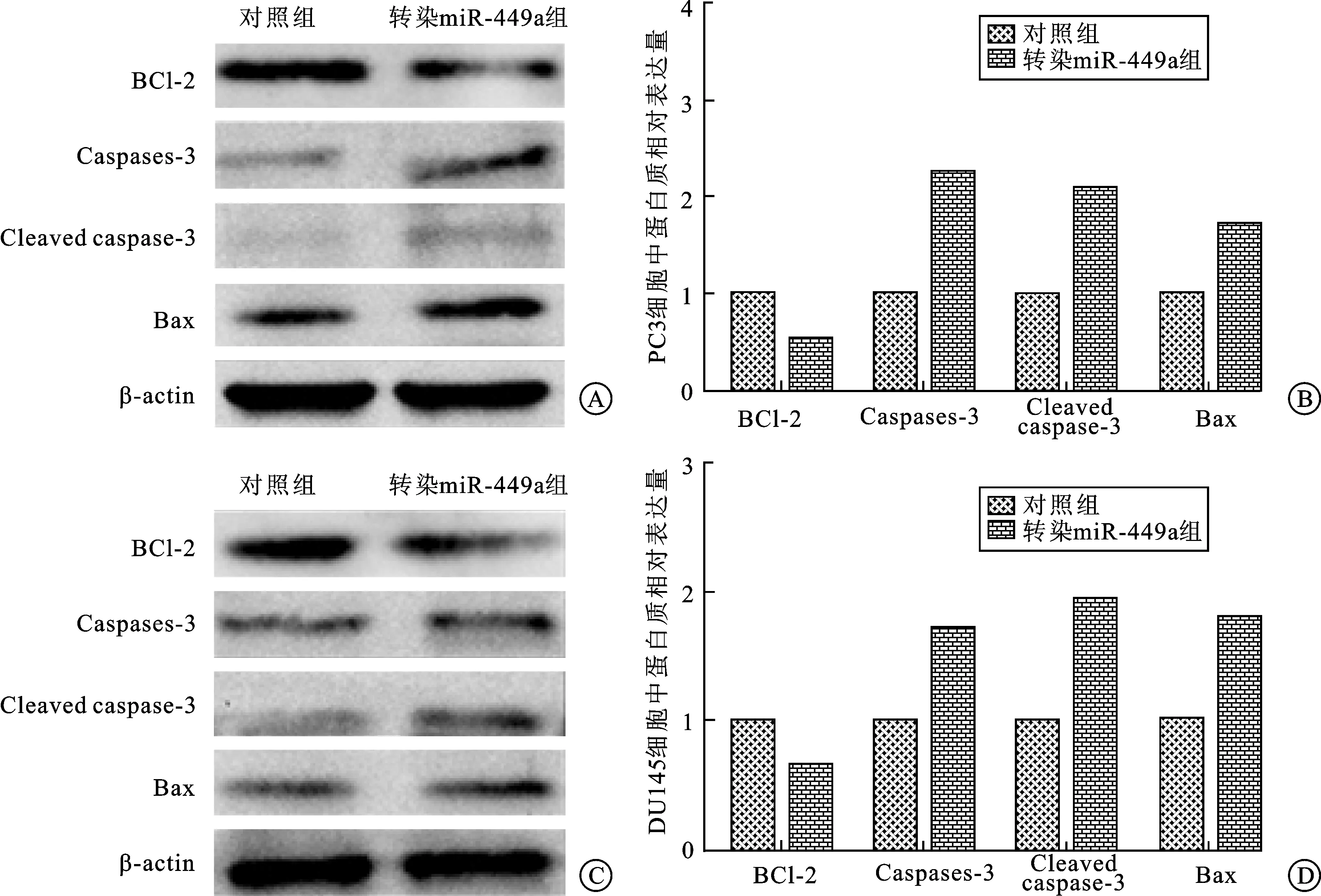
图4miR-449a对凋亡相关蛋白的影响
与对照组比较,*P<0.05,**P<0.01;A:Western blot法检测PC3细胞中蛋白表达;B:PC3细胞中Bcl-2、Caspase-3、Cleaved caspase-3和Bax蛋白相对表达柱状图;C:Western blot法检测DU145细胞中蛋白表达;D:DU145细胞中Bcl-2、Caspase-3、Cleaved caspase-3和Bax蛋白相对表达柱状图。
3 讨 论
近年来,随着经济的发展和医疗技术水平的提高,前列腺癌的发生率在我国呈现逐渐增长趋势,愈发引起关注[6]。研究表明,多种miRNA在前列腺癌中有比较重要的作用,但是大部分与前列腺癌密切相关的miRNA还不是很明确。本研究首先通过分析检测9对前列腺癌组织及癌旁组织中miRNA表达差异,发现miR-449a在癌组织中明显降低,与文献报道的结果较一致。我们进一步检测了几种常见前列腺癌细胞株和人正常前列腺上皮细胞中miR-449a的表达,结果证明了在前列腺癌细胞系中miR-449a也呈较低表达。
大量研究证实,miRNA参与肿瘤细胞的增殖、分化、凋亡等重要生物学过程,有些miRNA的表达在前列腺癌中降低,却对靶基因的转录后水平有较强的调节能力,参与肿瘤的发生发展过程[7]。NOONAN等[8]早年已经报道了miR-449a能够通过靶向HDAC1抑制前列腺癌细胞生长。近年又有研究表明,miR-449a也能够增强前列腺癌对放疗的敏感性,提高放疗治疗效果[9]。最近,有研究证实了miR-449a能够调节前列腺癌的转移,对早期诊断有一定的价值[10]。但是,miR-449a对前列腺癌凋亡的机制研究目前还没有报道,本研究通过转染技术而过表达前列腺癌细胞株PC3和DU145中miR-449a,研究其对肿瘤细胞凋亡的影响。结果表明,miR-449a明显促进细胞凋亡,同时检测各组细胞中凋亡相关蛋白的表达发现,Bcl-2蛋白表达下降较显著,而Bax、Caspase-3蛋白的表达却上调了。
Bcl-2是线粒体凋亡途径的关键调节因子,能够通过抑制细胞色素C从线粒体膜间隔释放到细胞质中而发挥其抗凋亡功能[11]。有软件预测Bcl-2很有可能是miR-449a的一个靶向结合基因[12],而miRNA能够与靶基因mRNA 3'-UTR结合,在转录后水平调节基因表达。研究证实,miR-449a通过靶向作用Bcl-2基因,能够促进骨肉瘤细胞的凋亡[13],同时也能够调节胃癌细胞的增殖和对化疗药物的敏感性[14]。有资料显示,在多种肿瘤细胞的凋亡过程中,发现有Caspase的活化[15-16],Caspase是一个半胱氨酸蛋白酶家族,在细胞凋亡的过程中起着关键性的作用,位于级联反应下游如Caspase-3、Caspase-7等,能被上游的始动子激活作用于特异性底物,使细胞发生生化及形态学改变导致细胞凋亡。目前也已经发现一系列与Caspase有关而诱导凋亡的方法来治疗肿瘤,可望在恶性肿瘤的治疗方面取得新的突破[17]。因此,我们推测miR-449a的异常表达可能与前列腺癌具有相关性,可能是通过下调靶基因Bcl-2的表达而引起Bax蛋白的改变,同时激活了Caspase-3蛋白的表达,最终引起了前列腺癌细胞的凋亡。当然,miR-449a可能也有很多其他的靶基因,通过改变这些个基因的表达引起细胞凋亡,这也是今后继续研究的方向和切入点。
参考文献:
[1] BARTEL DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[2] OHTSUKA M,LING H,DOKI Y,et al.MicroRNA Processing and Human Cancer[J].J Clin Med,2015,4(8):1651-1667.
[3] ZHAO L,BODE AM,CAO Y,et al.Regulatory mechanisms and clinical perspectives of miRNA in tumor radiosensitivity[J].Carcinogenesis,2012,33(11):2220-2227.
[4] LI X,LI H,ZHANG R,et al.MicroRNA-449a inhibits proliferation and induces apoptosis by directly repressing E2F3 in gastric cancer[J].Cell Physiol Biochem,2015,35(5):2033-2042.
[5] CHEN SP,LIU BX,XU J,et al.MiR-449a suppresses the epithelial-mesenchymal transition and metastasis of hepatocellular carcinoma by multiple targets[J].BMC Cancer,2015,15(1):706.
[6] MILLER KD,SIEGEL RL,LIN CC,et al.Cancer treatment and survivorship statistics,2016[J].CA Cancer J Clin,2016,66(4):271-289.
[7] OZEN M,CREIGHTON CJ,OZDEMIR M,et al.Widespread deregulation of microRNA expression in human prostate cancer[J].Oncogene,2008,27(12):1788-1793.
[8] NOONAN EJ,PLACE RF,POOKOT D,et al.miR-449a targets HDAC-1 and induces growth arrest in prostate cancer[J].Oncogene,2009,28(14):1714-1724.
[9] MAO A,ZHAO Q,ZHOU X,et al.MicroRNA-449a enhances radiosensitivity by downregulation of c-Myc in prostate cancer cells[J].Sci Rep,2016,6:27346.
[10] CHEN W,LIU Y,CHEN H,et al.Loss of miR-449a-caused PrLZ overexpression promotes prostate cancer metastasis[J].Int J Oncol,2017,51(2):435-444.
[11] YANG J,LIU X,BHALLA K,et al.Prevention of apoptosis by Bcl-2:release of cytochrome c from mitochondria blocked[J].Science,1997,275(5303):1129-1132.
[12] JOHN B,ENRIGHT AJ,ARAVIN A,et al.Human MicroRNA targets[J].PLoS Biol,2004,2(11):e363.
[13] CHEN J,ZHOU J,CHEN X,et al.miRNA-449a is downregulated in osteosarcoma and promotes cell apoptosis by targeting BCL2[J].Tumour Biol,2015,36(10):8221-8229.
[14] HU J,FANG Y,CAO Y,ET AL.miR-449a Regulates proliferation and chemosensitivity to cisplatin by targeting cyclin D1 and BCL2 in SGC7901 cells[J].Dig Dis Sci,2014,59(2):336-345.
[15] ZHANG L,FENG G,ZHANG X,et al.microRNA630 promotes cell proliferation and inhibits apoptosis in the HCT116 human colorectal cancer cell line[J].Mol Med Rep,2017,16(4):4843-4848.
[16] NASSER MW,DATTA J,NUOVO G,et al.Down-regulation of Micro-RNA-1 (miR-1) in lung cancer:suppression of tumorigenic property of lung cancer cells and their sensitization to doxorubicin-induced apoptosis by miR-1[J].J Biol Chem,2008,283(48):33394-33405.
[17] SHINOURA N,MURAMATSU Y,YOSHIDA Y,et al.Adenovirus-mediated transfer of caspase-3 with Fas ligand induces drastic apoptosis in U-373MG glioma cells[J].Exp Cell Res,2000,256(2):423-433.

