阿帕替尼治疗6例晚期难治性卵巢癌的临床观察*
卵巢癌是妇科肿瘤中病死率最高的肿瘤,由于起病隐匿,70%患者发现时已为晚期[1]。目前主要的治疗手段为肿瘤细胞减灭术和术后辅助紫杉醇联合铂类化疗6~8个疗程。尽管手术技能提高,肿瘤细胞减瘤术比例增加,但均未走出卵巢癌治疗的瓶颈。特别是复发卵巢癌,此类患者临床表现复杂多样且不标准,预后极差,5年生存率仅为32%~46%[2-3]。因此,有必要探究卵巢癌患者的分化机制,进而寻找有效的治疗靶点,提高患者的生存质量。众所周知,针对于血管内皮细胞研究已成为抑制肿瘤生长的主要方式[4-6]。血管生长因子(vascular endothelial growth factors,VEGFs)及其受体在肿瘤血管生成和淋巴管生成中扮演着重要角色,尤其是在上皮细胞中[7]。甲磺酸阿帕替尼是新一代小分子血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)酪氨酸激酶抑制剂,其主要作用机制是竞争性结合该受体胞内酪氨酸ATP结合位点,高度选择性地抑制VEGFR-2酪氨酸激酶活性,阻断血管内皮生长因子(vascular endothelial growth factor,VEGF)结合后的信号转导,从而有效抑制肿瘤血管生成[8]。研究证实该药对多种恶性肿瘤均有显著疗效[9],而在卵巢癌治疗领域中的研究甚少。本研究总结分析6例常规治疗失败的晚期卵巢癌患者口服甲磺酸阿帕替尼后的近期临床疗效及不良反应,评估该药的疗效及安全性。
1 材料与方法
1.1 病例资料
收集天津医科大学第二医院自2015年6月至2016年10月收治的6例常规治疗失败的晚期卵巢癌患者,年龄为48~71岁,平均年龄55岁。经手术、化疗等常规治疗后行影像学检查评估为疾病进展(progressive disease,PD),患者的基本情况见表1。行甲磺酸阿帕替尼治疗前,血常规显示WBC≥4×109/L,HB≥90 g/L,PLT≥80×109/L;肾功能CREA<57 mmol/L;心电图与超声心动图除外急性心肌梗死或其他急性心源性疾病,影像学检查(CT或PET-CT)进行实体瘤测定评估。6例患者均经病理组织学证实为卵巢癌,临床诊断为Ⅳ期,常规治疗无效,无特殊有效的治疗手段,ECOG评分为1~2分,无重要脏器功能障碍。
1.2 方法
1.2.1 治疗方法 6例患者均口服甲磺酸阿帕替尼药物,且治疗期间未使用其他抗肿瘤治疗方案。6例患者起始剂量均为500 mg/次,1次/d,2例患者应用2周后无严重不良反应(Ⅲ/Ⅳ度),调整至维持剂量为750 mg/次,1次/d;2例患者血压较前升高,并出现Ⅱ~Ⅲ度手足综合征,维持500 mg/次,1次/d;2例患者体质较弱,给予250 mg/次,1次/d;维持治疗。查阅病例了解患者服药期间的血压、血常规、尿常规、心电图、肝肾功能情况,进而了解患者出现的药物不良反应。比较患者靶向治疗前后的影像学检查(如腹部CT/MRI)及肿瘤标记物化验,并根据实体瘤疗效评估标准RECIST 1.1版的标准来评价疗效,PD为无效;疾病稳定(stable disease,SD)、部分缓解(partial response,PR)、完全缓解(complete response,CR)为有效。
1.2.2 疗效判定指标 采用RECIST 1.1标准评价疗效,分为CR、PR、SD、PD,其中以CR+PR评价客观有效率(objective response rate,ORR),以CR+PR+SD评价疾病控制率(disease control rate,DCR)。辅助评价指标为血肿瘤标志物,主要包括糖类抗原125(carbohydrate antigen 125,CA125)、癌胚抗原(carcino-embryonic antigen,CEA)及神经元特异性烯醇化酶(neuron-specific enolase,NSE)。不良反应根据美国国家癌症研究所(NCI)通用不良反应标准NCI-CTC 3.0进行评价。
2 结果
2.1 临床疗效
6例晚期卵巢癌患者口服甲磺酸阿帕替尼治疗后,CR为0例,PR为2例,SD为1例,PD为3例。ORR为33%(2/6),DCR为50%(3/6)。其中仅1例患者在口服药物半个月后,肝脏病变较前缩小20%,口服靶向药物1个月后,肝脏病变较治疗前缩小40%,疗效评价为PR(图1)。
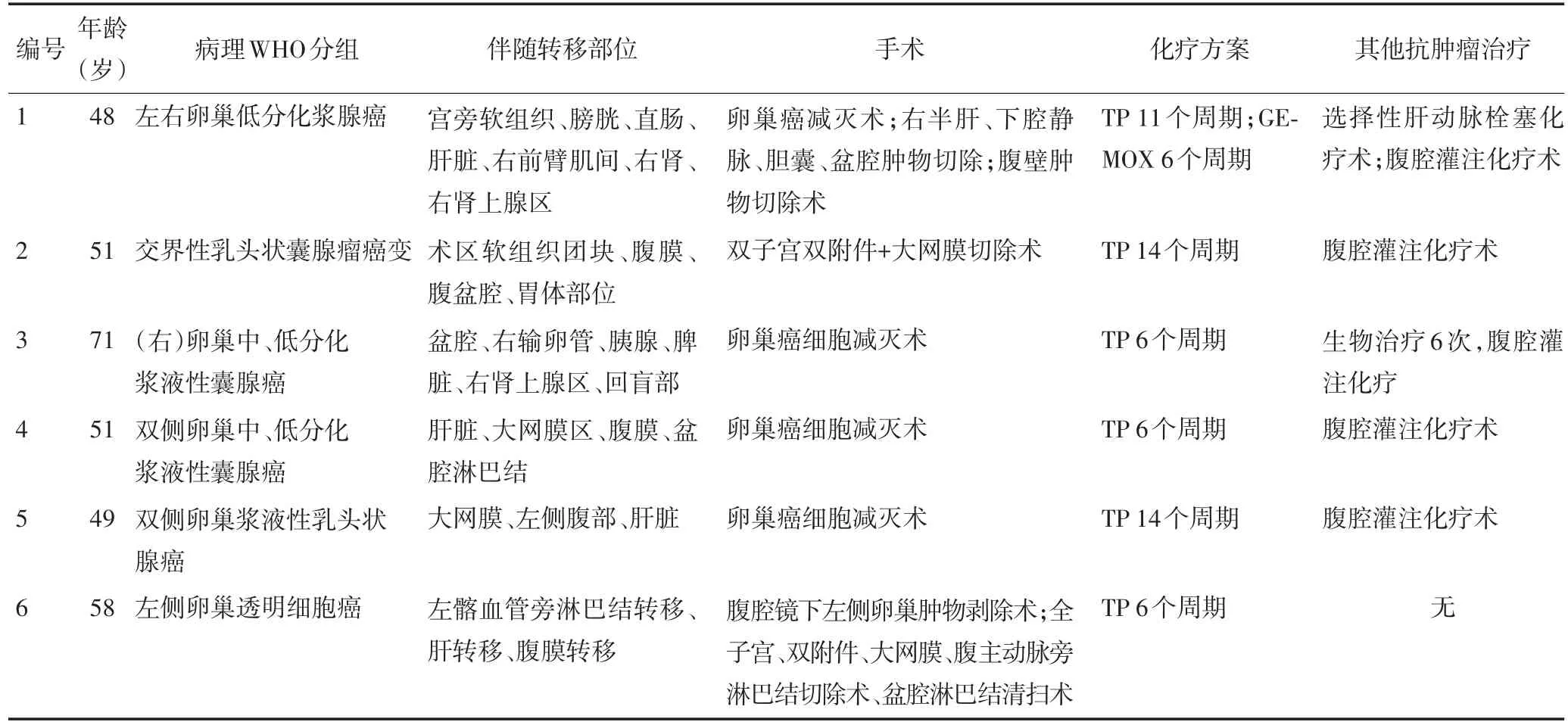
表1 6例晚期卵巢癌的基本情况及临床特征
2.2 血清肿瘤标志物变化情况

图1 1例晚期卵巢癌患者口服甲磺酸阿帕替尼治疗后评效为PR
6例晚期难治性卵巢癌患者中,影像学评效为PR的2例患者,其肿瘤标记物水平较治疗前明显下降;影像学评效为SD的1例患者肿瘤标记物水平较治疗前先下降后升高;其余3例患者的标记物水平均较治疗前升高(表2)。
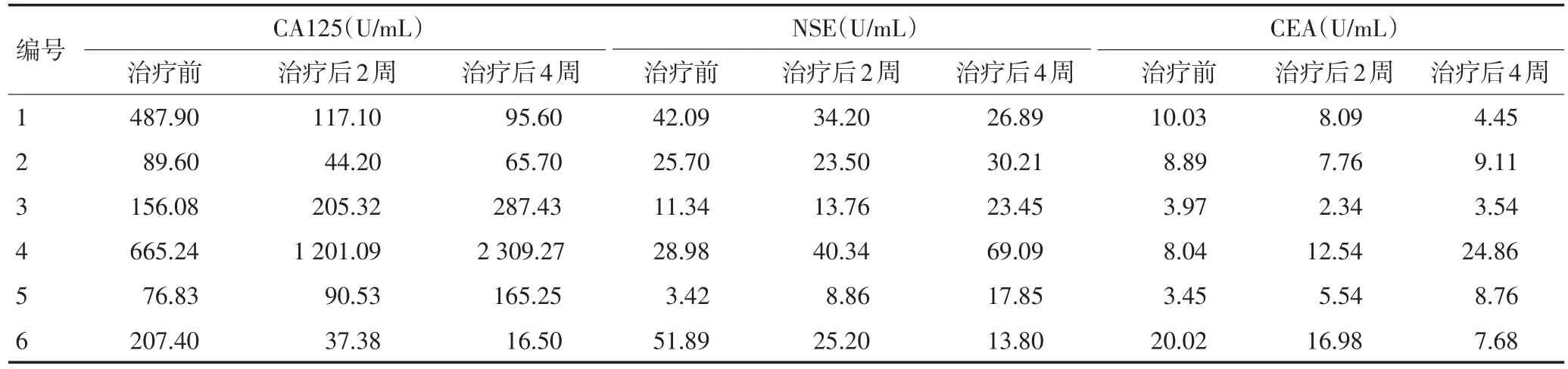
表2 6例晚期卵巢癌患者治疗前后的血清肿瘤标记物水平变化情况
2.3 不良反应
6例患者在治疗过程中出现Ⅰ~Ⅱ度不良反应,高血压4例;手足综合征5例;蛋白尿3例;尿潜血阳性2例;肾功能异常肌酐升高1例。上述患者的不良反应,经药物治疗后可控制或无需特殊处理,均可耐受治疗。可见,上述患者耐受性良好,其中主要不良反应以高血压及蛋白尿为主,发生率分别为66%(4/6)、83%(5/6)。
3 讨论
卵巢癌是一种复杂的异质性疾病,而VEGF在卵巢癌中能诱导血管内皮细胞增生、蛋白酶表达、抗内皮细胞凋亡和细胞重组,形成新生毛细血管的同时增强血管通透性[10]。在多数实体恶性肿瘤组织中,VEGF较正常组织高表达[11]。此外,有研究表明VEGF与VEGFR-2结合后发生一系列的生物调控机制,增强血管通透性、诱导内皮细胞增殖并促进其迁移,与肿瘤的恶性程度及预后关系密切[12]。
有研究[13]采用ELISA法测量卵巢肿瘤中VEGF表达水平,结果显示卵巢恶性肿瘤的VEGF水平明显高于其他类型卵巢肿瘤;在随访恶性和交界性肿瘤患者时,发现VEGF水平与肿瘤复发存在相关性(P=0.03)。基于分析9项相关研究的回顾性文献提示血清VEGF在大多数卵巢癌中过表达,且与患者预后密切相关,高水平表达意味着高复发率和死亡率。此外,VEGF还是一个独立的预后因素,可能成为比较好的预后标记物,预测患者的生存和死亡风险[14]。Zhao等[15]分析40例正常卵巢、45例良性、30例交界性、65例卵巢上皮癌的病例,并通过免疫组织化学法检测其中VEGF的表达,结果显示卵巢上皮癌中的VEGF蛋白表达率最高,达73.85%(48/65),差异具有统计学意义(P<0.05)。该研究还发现卵巢上皮癌组织中VEGF表达与患者临床分期有关,但与病理类型和组织分化程度差异无统计学意义。总之,VEGF与卵巢恶性肿瘤的血管生成、肿瘤进展密切相关,且在卵巢恶性肿瘤的发生、发展中起重要作用,靶向抗血管生成成为治疗肿瘤的策略之一。
近年来多项研究致力于通过抑制VEGF与VEGFR结合阻断下游通路的激活,进而抑制新生血管的形成,抑制肿瘤生长。甲磺酸阿帕替尼是拥有中国自主知识产权的口服抗血管生成靶向药物,通过阻断VEGFR-2降低丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)的活化,抑制血管内皮细胞的增殖,在多种实体恶性肿瘤包括肺癌、肝癌、肾癌、胃癌和乳腺癌中都发挥了抗肿瘤的作用[9]。
本研究结果证明,甲磺酸阿帕替尼在晚期卵巢癌治疗中近期疗效显著,ORR可达33.3%,DCR可达50%。此外,这些患者均为手术、化疗等常规治疗失败后的晚期难治性肿瘤患者,既往接受治疗的水平对于该药的治疗效果影响不显著,使该药适用范围更为广泛。但由于纳入治疗患者例数及观察时间有限,存在数据不确切可能,因此该结果还有待长期观察后进一步论证。
此外,本研究中患者均常规治疗失败,疾病进展较快,针对阿帕替尼治疗的不良反应,主要为剂量限制性毒性[8],起始剂量及维持剂量未按750 mg治疗。提示阿帕替尼的不良反应是可控且能够耐受的[16-18]。本研究中阿帕替尼的不良反应主要为高血压、蛋白尿及手足综合征,大部分为Ⅰ~Ⅱ度不良反应,经药物及对症治疗后可控制,与既往研究结果相近。
本研究结果显示,甲磺酸阿帕替尼有望成为晚期卵巢癌患者可选择的靶向药物。但目前仍处于临床探索阶段,对于卵巢癌治疗的起始剂量、维持剂量等问题国内外研究尚未有明确推荐或指南,同时其长期疗效及不良反应亟需进一步的研究。另外有研究证实[19],抗血管生成药物在可控不良反应的情况下可延长化疗获益患者的肿瘤进展时间。而阿帕替尼是否可与标准化疗联合应用,达到更好的治疗预期,仍需要进一步研究。
[1] Werness BA,Eltabbkh GH.Familial ovarian cancer and early ovarian cancer:biologic pathologic,and clinical features[J].Int J Gynecol Pathol,2001,20(1):48-63.
[2] Slomski A.Screening women for ovarian cancer still does more harm than good[J].JAMA,2012,307(23):2474-2475.
[3] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[4] Li J,Li S,Chen R,et al.The prognostic significance of anti-angio-genesis therapy in ovarian cancer:a meta-analysis[J].J Ovarian Res,2015,(8):54.
[5] Slaughter KN,Thai T,Penaroza S,et al.Measurements of adiposity as clinical biomarkers for first-line bevacizumab-based chemotherapy in epithelial ovarian cancer[J].Gynecol Oncol,2014,133(1):11-15.
[6] Monk BJ,Poveda A,Vergote I,et al.Anti-angiopoietin therapy withtrebananib for recurrent varian cancer(TRINOVA-1):a randomized,multicenter,double-blind,placebo-controlled phase 3 trial[J].Lancet Oncol,2014,(15):799-808.
[7] Gavalas NG,Liontos M,Trachana SP,et al.Angiogenesis-related pathways in the pathogenesis of ovarian cancer[J].Int J Mol Sci,2013,14(8):15885-15909.
[8] 秦叔逵,李进.阿帕替尼治疗胃癌的临床应用专家共识[J].临床肿瘤学杂志,2015,(9):841-847.
[9] Li J,Zhao X,Chen L,et al.Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J].BMC cancer,2010,(10):529.
[10]Fontanella C,Onqaro E,Bolzonello S,et al.Clinical advances in the development of novel VEGFR2 inhibitors[J].Ann Transl Med,2014,2(12):123.
[11]Youssoufian H,Hicklin DJ,Rowinsky EK.Review:monocolonal antibodies to the vascular endothelial growth factor receptor-2 in cancer therapy[J].Clin Cancer Res,2007,13(18):5544s-5548s.
[12]Takahashi T,Yamaguchi S,Chida K,et al.A single autophosphory-lation site on KDR/Flk-1 is essential for VEGF-A-dependent activation of PLC-gamma and DNA synthesis in vascular endothelial cells[J].EMBO J,2001,20(11):2768-2778.
[13]Hazelton D,Nicosia RF,Nicosia SV.Vascular endothelial growth factor levels in ovarian cyst fluid correlate with malignancy[J].Clin Cancer Res,1999,5(4):823-829.
[14]Bandiera E,Franceschini R,Specchia C.Prognostic significance of vascular endothelial growth factor serum determination in women with ovarian cancer[J].ISRN Obstet Gynecol,2012,(2012):245756.
[15]Zhao J,Chen WZ,Ma W,et al.Expression and clinical significance of VEGF,P53 and C-erbB2 protein in epithelial ovarian tumors[J].Hebei Med J,2015,37(6):10-13.
[16]Fontanella C,Ongaro E,Bolzonello S,et al.Clinical advanced in the development of novel VEGFR2 inhibitors[J].Ann Transl Med,2014,2(12):123.
[17]De Vita F,Di Martino N,Fabozzi A,et al.Clinical management of advanced gastric cancer:the role of new molecular drugs[J].World J Gastroenterol,2014,20(40):14537-14558.
[18]Li J,Qin S,Xu J,et al.Apatinib for chemotherapy-refractory advanced metastatic gastric cancer:results from a randomized,place-bo-controlled,parallel-arm,phaseⅡtrial[J].J Clin Oncol,2013,31(26):3219-3225.
[19]邓小玲,黄山鉴,杨凡,等.多西他赛联合重组人血管内皮抑素对初治后进展非细胞肺癌患者的临床评价[J].中国综合临床,2015,31(12):1117-1120.

