PI3K/Akt/Nrf2信号通路在电针刺减轻兔内毒素休克诱发急性肺损伤中的作用
韩 悦,史 佳,吴丽丽,张 圆,宫丽荣,余剑波
内毒素休克诱发急性肺损伤是临床危重症患者死亡的主要原因,死亡率可高达35.1%~46.1%,其发病机制的复杂化决定了目前临床治疗措施的局限性[1-2]。电针刺激治疗以传统针灸为基础,通过改变电刺激强度、频率、波形脉冲间隔等参数而进行行针治疗[3]。前期研究已证实,电针刺激足三里和肺腧穴可通过上调血红素氧合酶-1的表达而减轻内毒素休克诱发急性肺损伤,其机制涉及的信号通路尚不明确[4]。磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)具有促进细胞增殖,抑制细胞凋亡,参与细胞骨架重组等重要功能[5]。研究表明,PI3K/Akt通过调整激动蛋白微丝的排列及解聚,导致NF-E2相关因子2(Nrf2)/Kelch样环氧氯丙烷相关蛋白-1(keap1)复合体解体,参与Nrf2的活化,易位至细胞核识别并结合抗氧化反应序列元件(ARE),从而激活下游抗氧化蛋白如HO-1等表达,维持机体氧化还原稳态[6]。本研究拟评价PI3K/ Akt/Nrf2信号通路在电针刺减轻兔内毒素休克诱发急性肺损伤中的作用。
1 材料与方法
1.1 实验动物及分组 按照完全随机设计,有多组样本均数比较的样本含量公式估算出每组大概需要10只实验动物,本实验按需分成8组,选择健康清洁级雄性新西兰大白兔80只,2月龄,体质量1.5~2.0 kg,由天津市中国医学科学院生物工程研究所提供(许可证号:SCXK(京)2011-0008)。于室温18~22 ℃安静环境中常规饲养,昼夜交替,适应环境1周后进行实验。采取随机数字表法分为8组(n=10):对照组(C组)、内毒素休克诱发急性肺损伤模型组(L组)、PI3K/Akt抑制剂-渥曼青霉素+内毒素休克诱发急性肺损伤组(WL组)、渥曼青霉素组(W组)、二甲基亚砜组(D组)、模型+电针刺组(EL)、模型+电针刺激非穴位组(SEL)、模型+电针刺+渥曼青霉素组(ELW)。
1.2 动物模型制备 实验前24 h禁食,自由饮水。参照文献[7]制备内毒素休克诱发急性肺损伤模型。耳缘静脉注射20%乌拉坦5 mL/kg麻醉后,仰卧位固定于自制兔台上,经耳缘静脉置管建立静脉输液通路。颈部备皮消毒,1%利多卡因局麻下剪开颈部正中皮肤,分离气管和右侧颈内动脉分别行气管插管和颈内动脉置管,维持自主呼吸,持续监测动脉压,兔静待30 min后,WL组、ELW组经耳缘静脉注射渥曼青霉素0.6 mg/kg(溶剂为0.08 mL/kg DMSO),D组给予等容量二甲基亚砜,其余组给予等容量生理盐水。30 min后,L、WL、EL、SEL组及ELW组静脉注射LPS 5 mg/kg(溶于2 mL 0.9%生理盐水),C、W及D组给予等容量生理盐水。给予LPS后2 h内MAP未降至基础值75%或给予LPS后6 h内动物死亡的排除本研究。
参照中国针灸学会实验针灸研究会制定的《动物针灸穴位图谱》,选取兔双侧足三里穴(膝关节外下方腓骨小头下约5 mm处)和肺俞穴(第3胸椎棘突下旁开约1.5 cm处),将兔置于特制兔笼中,暴露针刺部位,常规备皮消毒,使用直径0.3 mm的一次性无菌针灸针,直刺进针5~7 mm。采用HANS2100A型疼痛治疗仪进行电针刺激,刺激时间9:30-10:30,30 min/次,1次/d,模型制备前1~4 d及模型制备过程中行电针处理。针刺参数为:疏密波,频率2/15 Hz,波宽0.2~0.6 ms,刺激电流1~2 mA,刺激强度以兔肢体出现轻微颤动为宜。SEL组以相同的参数电针刺激足三里和肺俞穴旁开0.5 cm非经非穴处。
1.3 标本采集与保存 静脉注射LPS或生理盐水后6 h,经颈内动脉取血置于促凝管中,4 ℃离心取上清液置于EP管中于-80 ℃冻存。放血处死兔,留取双肺组织,用4 ℃磷酸盐缓冲盐水洗去表面血渍,将右肺中叶组织浸入10%福尔马林溶液中固定,右肺下叶组织置于液氮罐中速冻后于-80℃低温冰箱保存。
取10%福尔马林溶液固定的肺组织,经梯度乙醇脱水置换,二甲苯透明后,常规石蜡包埋,切片(4 μm),HE染色,每张切片随机选取10个视野于光学显微镜下观察(×100),见图1。参照文献[8-9]进行肺损伤评分,取其平均值作为总体的肺组织损伤评分。评分标准如下:(1)肺泡充血和间质水肿:无异常为0分,轻度异常为1分,中度异常为2分,重度异常为3分;(2)肺内出血:无红细胞为0分,极少数为1分,较多数为2分,充满肺泡腔为3分;(3)肺泡腔或血管壁中性粒细胞浸润或聚集:无白细胞为0分,极少数为1分,较多数为2分,充满肺泡腔为3分;(4)肺泡壁增厚和透明膜形成:无透明膜形成为0分,<20%肺泡出现透明膜为1分,20%~50%肺泡出现透明膜为2分,>50%肺泡出现透明膜为3分。
1.4 检测指标及及检测方法 取-80 ℃保存的肺组织200 mg,制备10%组织匀浆,采用黄嘌呤氧化酶法测定SOD活性,采用硫代巴比妥酸法测定MDA含量,严格按照试剂盒操作步骤进行测定。SOD活性及MDA含量测定试剂盒均购自南京建成生物工程研究所。
采用双抗体夹心ELISA法测定血清TNF-α和IL-10浓度,取-80 ℃保存的血清,按兔TNF-α和IL-10 ELISA试剂盒(R&D公司,美国)操作步骤加样,用KHB ST-360酶标仪检测血清中TNF-α和IL-10浓度。
采 用 Western blotting法 测 定 p-Akt、HO-1、Nrf2核蛋白及总蛋白的表达,取右肺下叶组织,按照Thermo蛋白提取试剂盒说明分别提取核蛋白和总蛋白,离心取上清液后进行蛋白定量。取80 μg蛋白进行凝胶电泳、转膜、封闭后,加入兔p-Akt多克隆抗体(稀释度1∶300)、兔Nrf2多克隆抗体(稀释度1∶1000)和兔HO-1多克隆抗体(稀释度1∶1000),4 ℃孵育过夜,TBST漂洗后加入辣根过氧化物酶标记的山羊抗兔IgG抗体(稀释度1∶3000),室温下避光摇床孵育1 h后漂洗。于暗室中加入增强化学发光液进行曝光与显色,使用Quantity One凝胶成像分析系统扫描,以目的蛋白与内参β-actin条带积分光密度值的比值反映目的蛋白的表达水平,见图2。
统计学处理 采用SPSS18.0统计学软件进行分析,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肺损伤评分、血清TNF-α浓度及肺组织MDA含量和IL-10浓度及SOD活性比较 与C组比较,L组、WL组、EL组、SEL组和ELW组肺损伤评分、血清TNF-α浓度及组织MDA含量升高,而IL-10浓度及SOD活性降低(P<0.05),W组、D组上述各指标差异无统计学意义(P>0.05);与L组比较,EL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量降低,而IL-10浓度及SOD活性升高,WL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量升高,而IL-10浓度及SOD活性降低(P<0.05),而SEL组上述各指标差异无统计学意(P>0.05);与EL组比较,ELW组组肺损伤评分、血清TNF-α浓度及肺组织MDA含量升高,而IL-10浓度及SOD活性降低(P<0.05);与ELW组比较,WL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量升高,而IL-10浓度及SOD活性降低(P<0.05),见表1。
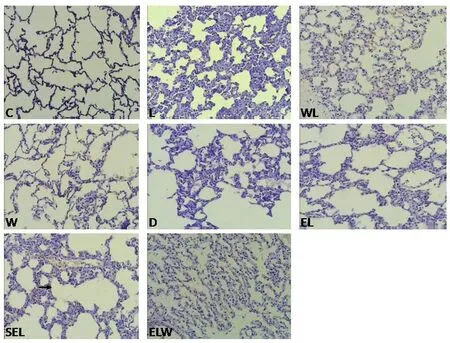
图1 各组肺组织病理学结果(HE染色×100)
2.2 p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平比较 与C组比较,L组、WL组、EL组、SEL组和ELW组肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平上调(P<0.05),W组、D组上述各指标差异无统计学意义(P>0.05);与L组比较,EL组肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平上调,WL组肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平下调(P<0.05),而SEL组上述各指标差异无统计学意(P>0.05);与EL组比较,ELW组肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平下调(P<0.05);与ELW组比较,WL组肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平下调(P<0.05),见表2。

图1 各组肺组织病理学结果(HE染色×100)

图2 各组p-Akt、HO-1、Nrf2核蛋白及总蛋白表达结果
表1 八组兔肺损伤评分、肺组织SOD活性、MDA含量、血清TNF-α及IL-10浓度比较(n=10,(±s)
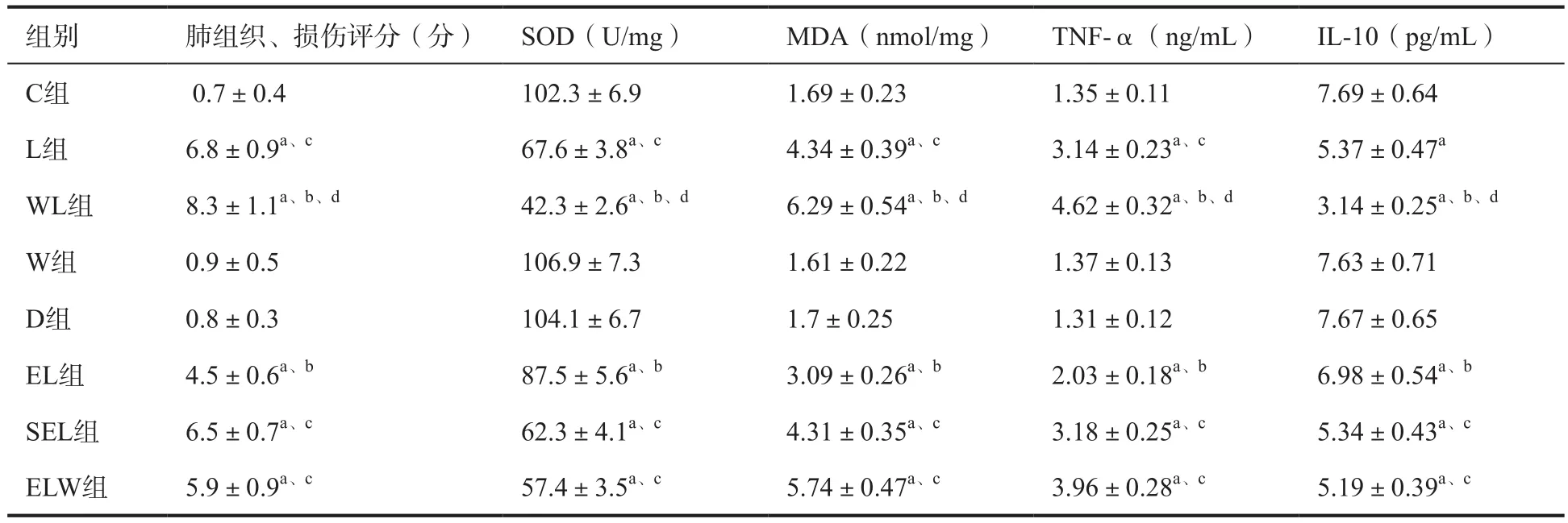
表1 八组兔肺损伤评分、肺组织SOD活性、MDA含量、血清TNF-α及IL-10浓度比较(n=10,(±s)
注:与C组比较,aP<0.05;与L组比较,bP<0.05;与EL组比较,cP<0.05;与ELW组比较,dP<0.05
组别 肺组织、损伤评分(分) SOD(U/mg) MDA(nmol/mg) TNF-α(ng/mL) IL-10(pg/mL)C组 0.7±0.4 102.3±6.9 1.69±0.23 1.35±0.11 7.69±0.64 L组 6.8±0.9a、c 67.6±3.8a、c 4.34±0.39a、c 3.14±0.23a、c 5.37±0.47a WL组 8.3±1.1a、b、d 42.3±2.6a、b、d 6.29±0.54a、b、d 4.62±0.32a、b、d 3.14±0.25a、b、d W组 0.9±0.5 106.9±7.3 1.61±0.22 1.37±0.13 7.63±0.71 D组 0.8±0.3 104.1±6.7 1.7±0.25 1.31±0.12 7.67±0.65 EL组 4.5±0.6a、b 87.5±5.6a、b 3.09±0.26a、b 2.03±0.18a、b 6.98±0.54a、b SEL组 6.5±0.7a、c 62.3±4.1a、c 4.31±0.35a、c 3.18±0.25a、c 5.34±0.43a、c ELW组 5.9±0.9a、c 57.4±3.5a、c 5.74±0.47a、c 3.96±0.28a、c 5.19±0.39a、c
表2 八组兔肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平比较(n=10,(±s)
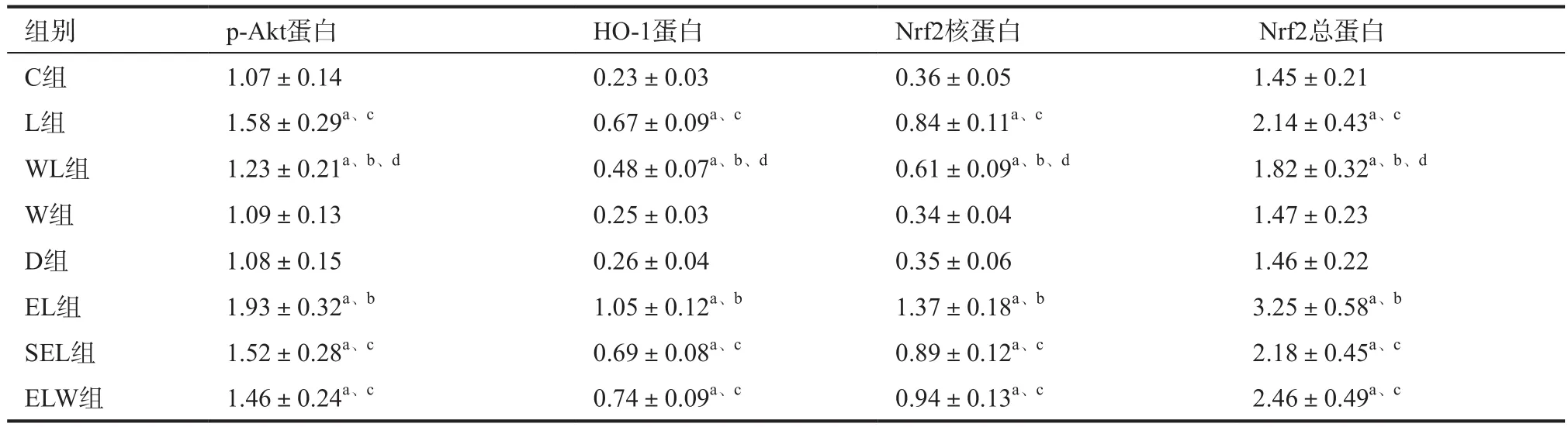
表2 八组兔肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平比较(n=10,(±s)
注:与C组比较,aP<0.05;与L组比较,bP<0.05;与EL组比较,cP<0.05;与ELW组比较,dP<0.05
组别 p-Akt蛋白 HO-1蛋白 Nrf2核蛋白 Nrf2总蛋白C组 1.07±0.14 0.23±0.03 0.36±0.05 1.45±0.21 L组 1.58±0.29a、c 0.67±0.09a、c 0.84±0.11a、c 2.14±0.43a、c WL组 1.23±0.21a、b、d 0.48±0.07a、b、d 0.61±0.09a、b、d 1.82±0.32a、b、d W组 1.09±0.13 0.25±0.03 0.34±0.04 1.47±0.23 D组 1.08±0.15 0.26±0.04 0.35±0.06 1.46±0.22 EL组 1.93±0.32a、b 1.05±0.12a、b 1.37±0.18a、b 3.25±0.58a、b SEL组 1.52±0.28a、c 0.69±0.08a、c 0.89±0.12a、c 2.18±0.45a、c ELW组 1.46±0.24a、c 0.74±0.09a、c 0.94±0.13a、c 2.46±0.49a、c
3 讨论
静脉注射LPS是目前制备内毒素休克诱发急性肺损伤模型应用最为广泛的方法,LPS入血可引起机体中性粒细胞、单核巨噬细胞等发生复杂的免疫反应,释放大量的炎性介质及细胞因子造成微循环障碍,诱发急性肺脏损伤[10]。本实验以文献[2]以及文献[7]的前期研究为基础,采用经耳缘静脉缓慢注射LPS 5 mg/kg制备兔内毒素休克诱发急性肺损伤模型,并以LPS给予2 h内MAP下降至基础值的75%及以下为模型制备成功的标准。结果表明,给予LPS后肺组织形态学改变明显,肺W/D比值、肺损伤评分升高,血清TNF-α浓度及肺组织MDA含量升高,而IL-10浓度及SOD活性降低,提示内毒素休克诱发急性肺损伤模型制备成功。
电针穴位及针刺参数的选择是影响电针刺激效果的重要因素[11]。足三里穴属于足阳明胃经穴,肺腧穴属于足太阳膀胱经穴,前期研究已证实,电针刺激该穴位可产生肺保护作用,但具体作用机制尚不明确[12]。本研究参照文献[4]以及文献[10]设置电针参数,选取疏密波,频率为2/15 Hz。结果表明,电针刺激兔双侧足三里及肺俞穴后,肺组织W/D比值降低,肺损伤评分降低,血清TNF-α浓度及肺组织MDA含量降低,而IL-10浓度及SOD活性升高,表明电针刺减轻了内毒素休克诱发的急性肺损伤。
PI3K是存在于体内多种细胞的脂激酶,能磷酸化细胞膜上的磷脂酰肌醇家族成员,募集和激活下游靶物质而启动一系列信号级联反应。Akt又称蛋白激酶B(protein kinase B,PKB),是一种丝氨酸/苏氨酸蛋白激酶,Akt/PKB是PI3K信号传导途径中重要的下游靶激酶[13]。研究表明[14-15],渥曼青霉素是非ATP竞争型P13K抑制剂,0.6 mg/kg渥曼青霉素可成功阻断P13K/Akt信号通路,且无死亡及急性毒性反应,因此本实验选择静脉注射0.6 mg/kg渥曼青霉素作为阻断剂行预处理。在本实验中,与L组比较,EL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量降低,而IL-10浓度及SOD活性升高,肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平上调,而WL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量升高,而IL-10浓度及SOD活性降低,肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平均下调,提示电针刺激减轻内毒素休克诱发的急性肺损伤,注射渥曼青霉素后可影响P13K/Akt信号通路,从而加重急性肺损伤。与ELW组比较,EL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量降低,而IL-10浓度及SOD活性升高,肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平上调,而WL组肺损伤评分、血清TNF-α浓度及肺组织MDA含量升高,而IL-10浓度及SOD活性降低,肺组织p-Akt蛋白、HO-1蛋白、Nrf2核蛋白及总蛋白表达水平均下调,提示电针刺激减轻内毒素休克诱发急性肺损伤被渥曼青霉素阻断,表明PI3K/Akt信号通路介导了电针刺减轻内毒素休克诱发急性肺损伤,其机制与激活Nrf2磷酸化,上调HO-1表达有关,HO-1不仅能够抑制内毒素休克急性肺损伤时TNF-α等炎性因子的释放,还能抑制中性粒细胞的作用,减少中性粒细胞的聚集,来减轻炎症反应对肺组织的损伤[14]。电针刺激双侧足三里和肺腧穴,机械刺激和电信号被细胞表面受体接受后转化为生物信号激活PI3K/Akt通路,促使Nrf2活化并与Keap1解离,转位入核,与伴侣蛋白小Maf形成异源二聚体,调控ARE依赖的靶基因HO-1的转录与表达,调动机体抗炎抗氧化应激能力,从而减轻内毒素诱发急性肺损伤[16]。
综上所述,PI3K/Akt/Nrf2信号通路介导电针刺激减轻兔内毒素休克诱发急性肺损伤的作用,其机制可能与上调HO-1表达从而抑制炎症反应相关,为内毒素休克诱发急性肺损伤的防治提供了新思路及理论依据。
参考文献:
[1] Rubenfeld GD, Galdwell E, Peabody E, et al. Incidence and outcome of acute lung injury [J]. N Eng J Med, 2005, 353(16):1685-1693.
[2] Yu JB, Shi J, Wang D, et al. Heme oxygenase-1/carbon monoxideregulated mitochondrial dynamic equilibrium contributes to the attenuation of endotoxin-induced acute lung injury in rats and in lipopolysaccharide-activated macrophages [J]. Anesthesiology,2016, 125(6): 1190-1201.
[3] Chernyak GV, Sessler DI. Perioperative acupuncture and related techniques [J]. Anesthesiology, 2005, 102(5): 1031-1049.
[4] Yu JB, Shi J, Gong LR, et al. Role of Nrf2/ARE pathway in protective effect of electroacupuncture against endotoxic shockinduced acute lung injury in rabbits [J]. PloS One, 2014, 9(8):e104924.
[5] Zhang W, Zhang JQ, Meng FM, et al. Dexmedetomidine protects against lung ischemia-reperfusion injury by the PI3K/Akt/HIF-1α signaling pathway [J]. J Anesth, 2016, 30(5): 826-833.
[6] Joo Choi R, Cheng MS, Shik Kim Y. Desoxyrhapontigenin up-regulates Nrf2-mediated heme oxygenase-1 expression in macrophages and in fl ammatory lung injury [J]. Redox Biol, 2014,2: 504-512.
[7] Yu JB, Wang Y, Li Z, et al.Effect of heme oxygenase-1 on mitofusin-1 protein in LPS-induced ALI/ARDS in rats [J]. Sci Rep, 2016, 6: 36530.
[8] Lin YC, Lai YS, Chou TC. The protective effect of alpha-lipoic acid in lipopolysaccharide-induced acute lung injury is mediated by heme oxygenase-1 [J]. Evid Based Compl Alt, 2013,2013:590363.
[9] 史佳, 余剑波, 宫丽荣, 等. 电针减轻内毒素休克诱发兔急性肺损伤的机制:与Nrf2/ARE通路的关系 [J]. 中华麻醉学杂志,2014, 34(7): 843-847.
[10] Yu JB, Dong SA, Luo XQ, et al. Role of HO-1 in protective effect of electroacupuncture against endotoxin shock-induced acute lung injury in rabbits [J]. Exp Biol Med (Maywood), 2013, 238(6):705-712.
[11] Song JG, Li HH, Cao YF, et a1. EIectroacupuncture improves survival in rats with lethal endotoxemia via the autonomic nervous system [J]. Anesthesiology, 2012, 116(2): 406-414.
[12] 高雪松, 宫丽荣, 余剑波, 等. P38MAPK信号通路在电针减轻内毒素休克诱发兔急性肺损伤中的作用:与Nrf2的关系 [J].中华麻醉学杂志, 2015, 35(4): 481-485.
[13] Williams DL, Li C, Ha T, et al. Modulation of the phosphoinositide 3-kinase pathway alters innate resistance to polymicrobial sepsis [J]. J Immunol, 2004, 172(1): 449-456.
[14] Yu JB, Shi J, Zhang Y, et al. Electroacupuncture ameliorates acute renal injury in lipopolysaccharide-stimulated rabbits via induction of HO-1 through the PI3K/Akt/Nrf2 pathways [J]. PLoS One,2015, 10(11): e0141622.
[15] Chiari PC, Bienengraeber MW, Pagel PS, et al. Isoflurane protects against myocardial infarction during early reperfusion by activation of phosphatidylinositol-3-kinase signal transduction:evidence for anesthetic-induced postconditioning in rabbits [J].Anesthesiology, 2005, 102(1): 102-109.
[16] Chen HH, Chen YT, Huang YW, et al. 4-Ketopinoresinol, a novel naturally occurring ARE activator, induces the Nrf2/HO-1 axis and protects against oxidative stress-induced cell injury via activation of PI3K/AKT signaling [J]. Free Radic Biol Med,2012, 52(6): 1054-1066.

