急性胰腺炎血液和胆汁培养的病原菌分布及耐药性分析
陈莎燕,高 雪,白景瑞,孙兰菊,陈明慧,房 杰,常艳敏
在急性胰腺炎(acute pancreatitis,AP)发病过程中由于肠道系统的屏障功能的破环,易发生肠道菌群易位,继发细菌感染[1-3]。在临床微生物检验取材中,多采用血液和胆汁培养[4]。为了更好了解AP患者感染病原菌情况和特点,以便更好地指导临床检验的取材和服务临床治疗,我们收集天津市南开医院2013年5月10日—2017年9月13日的AP患者血液和胆汁培养病原菌检测的数据,并分析其病原菌检出率和种类分布特点以及耐药特征。
1 资料与方法
1.1 标本来源 本组共1603例,男1074例,女529例;年龄18~89岁,平均(55±17)岁。病程10~128天,平均20天。根据2012年修订后的亚特兰大分类标准[5],1195例血液标本来源的患者第一诊断均为AP,其中中重度AP为唯一诊断的有709例(59.32%),第二诊断为胆道疾病的中重度AP为178例(14.90%),第二诊断为腹腔感染的中重度AP为178例(14.90%),第二诊断为其它疾病的中重度AP为95例(7.95%),重度AP为35例(2.93%);408例胆汁标本来源的患者第一诊断也均为AP,其中中重度AP为唯一诊断的有179例(43.87%),第二诊断为胆道疾病的中重度AP为140例(34.31%),第二诊断为腹腔感染的中重度AP为56例(13.73%),第二诊断为其它疾病的中重度AP为19例(4.66%),重度AP为14例(3.43%)。
1.2 仪器与试剂 美国赛默飞371二氧化碳细菌培养箱,法国生物梅里埃BecT/Alert3D全自动血培养仪及配套血培养瓶,VITEK2Compact全自动微生物分析系统。血琼脂培养基、沙保弱真菌培养基、麦康凯琼脂培养基和巧克力琼脂培养基(天津市金章生物科技发展有限公司),1.5升厌氧培养袋(法国生物梅里埃)。
1.3 质控菌株 标准质控菌株金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922和阴沟肠杆菌ATCC700323(由卫生部临床检验中心提供)。
1.4 标本采集 (1)患者发热(T>38.5 ℃),在未使用抗生素,需要细菌培养鉴定时;(2)患者间断反复发热或伴有寒战,现有抗生素效果欠佳时,无菌抽取2~10 mL静脉血送检血液培养。(3)胆汁取材为胆囊或胆管穿刺引流,无菌留取2~10 mL胆汁,注入需氧和厌氧培养瓶中,混匀。
1.5 细菌培养及分离 将培养瓶置于生物梅里埃BecT/Alert3D全自动血培养仪中培养,持续监测2~5 d。未出现阳性警报的培养瓶将转种于血琼脂培养基,若仍无细菌生长,即判定为阴性。出现阳性警报的培养瓶及时转种于血琼脂、麦康凯培养基、沙保弱培养基和巧克力培养基,置于35 ℃和5% CO2的潮湿细菌培养箱中继续培养18~24 h,必要时利用厌氧培养袋培养法进行培养及分离。
1.6 菌株鉴定及药敏实验 采用VITEK 2 Compact全自动微生物分析系统鉴定分离培养出的病原菌及其药敏实验,并结合临床实验室标准化委员会(CLSI)2013—2016年标准判读药敏实验结果。严格按照《全国临床检验操作规程》操作进行所有检测操作。
1.7 统计学处理 采用SPSS 16.0统计软件分析数据。
2 结果
2.1 血和胆汁培养分离出病原菌的阳性率及其分布 本研究中1195例血液培养标本中分离出阳性标本共计111例,阳性检出率为9.2%。检出病原菌的数量为152株,1例标本检出大于1种病原菌的比例为36.9%。其中中重度AP为唯一诊断的病例检出菌的有60例(8.4%),第二诊断为胆道疾病的为14例(7.9%),第二诊断为腹腔感染的为22例(12.4%),第二诊断为其它疾病的为8例(8.4%),重度AP为7例(20.0%)。分离革兰阴性杆菌为56例,占36.8%。革兰阳性球菌为74例,占48.7%。真菌为21例,占13.8%。革兰阳性杆菌为1例,占0.7%,厌氧菌未检出。病原菌按检出率多少依次为凝固酶阴性葡萄球菌(coagulase negative Staphylococci,CNS)、大肠埃希菌、肺炎克雷伯菌、近平滑假丝酵母菌、鲍曼不动杆菌和屎肠球菌。408例胆汁培养标本中分离出阳性标本共计85例,阳性检出率为20.8%。检出病原菌的数量为93株,1例标本检出大于一种病原菌的比例为9.4%。其中中重度AP为唯一诊断病例检出菌的有28例(15.6%),第二诊断为胆道疾病的有36例(25.7%),第二诊断为腹腔感染的有13例(23.2%),第二诊断为其它疾病的有7例(36.8%),重度AP有1例(7.1%)。分离的革兰阴性杆菌为56例,占60.2%。革兰阳性球菌为35例,占37.6%。真菌为2例,占2.2%。无革兰阳性杆菌和厌氧菌检出。病原菌按检出率的多少排名,依次为大肠埃希菌、屎肠球菌、肺炎克雷伯菌、粪肠球菌、凝固酶阴性葡萄球菌和鲍曼不动杆菌。见表1。
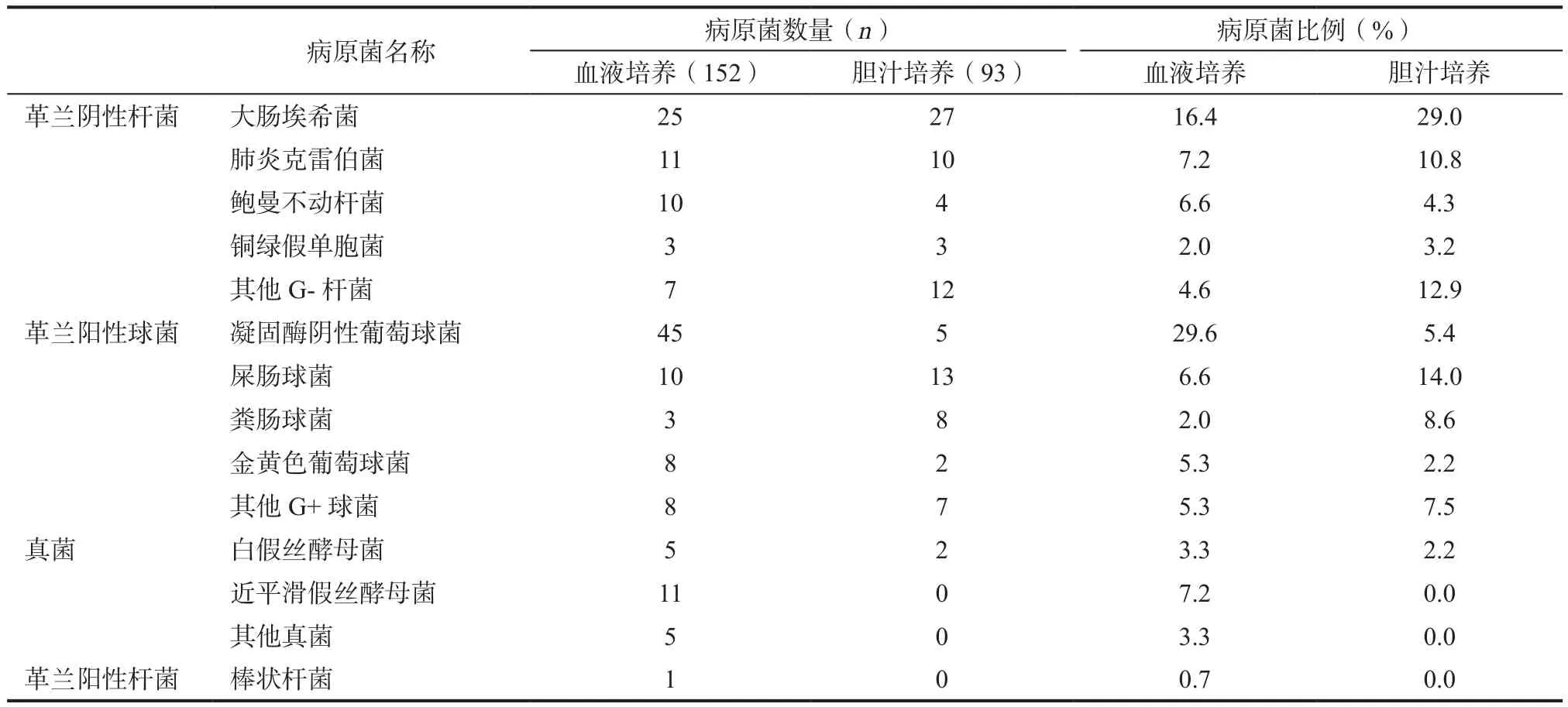
表1 1603例AP患者血液和胆汁标本的病原菌分布及比例
2.2 对革兰阴性杆菌的耐药性 本研究中革兰阴性杆菌最多的是大肠埃希菌,血液和胆汁标本检出数量相近,但检出率有差异,分别为16.4%和29.0%。其产超广谱β-内酰胺酶(ESBLs)的检出率分别为52.0%和66.7%。血液标本中的大肠埃希菌对氨苄西林、头孢唑林、头孢呋辛、头孢曲松、头孢他啶、头孢西丁和环丙沙星的耐药率大于40.0%,稍高于对其他药物的耐药性。而胆汁标本中的大肠埃希菌对氨苄西林、头孢唑林、头孢呋辛、头孢曲松、头孢他啶和头孢西丁的耐药率大于50.0%。可见两者耐药性有一定差异,不过均对丁胺卡那霉素和美洛培南较敏感。
排名第二的肺炎克雷伯菌在血液和胆汁标本中检出数量相近,检出率也相近,分别为7.2%和10.8%,但有各自耐药性特点。首先,产ESBLs的肺炎克雷伯菌检出率有差别,分别为45.5%和70.0%。在血液标本中,对氨苄西林、头孢唑林、头孢呋辛、头孢曲松和头孢他啶的耐药率大于40.0%,高于其他药物的耐药性。对头孢哌酮/舒巴坦、头孢西丁、丁胺卡那霉素和妥布霉素最为敏感。而胆汁标本中对头孢唑林、头孢曲松、氨苄西林、头孢西丁、头孢呋辛、头孢他啶和环丙沙星耐药率均大于50.0%。对头孢哌酮/舒巴坦和亚胺培南最为敏感。
此外,鲍曼不动杆菌在血液和胆汁标本中的检出数量虽分别是10和4株,但检出率相近,分别为6.6%和4.3%。而且对碳氢酶烯类的耐药率也有差异,分别为80.0%和50.0%。两类标本类型的鲍曼不动杆菌对多数抗菌药表现为耐药。在血液标本中,对头孢吡肟、头孢他啶、庆大霉素、头孢曲松、哌拉西林/他唑巴坦、环丙沙星、碳氢酶烯类和妥布霉素的耐药率超过60.0%。在胆汁标本中,对头孢吡肟、头孢他啶、庆大霉素、头孢曲松、哌拉西林/他唑巴坦、环丙沙星、碳氢酶烯类和妥布霉素的耐药率超过50.0%。见表2。

表2 AP患者血液和胆汁标本对主要革兰阴性杆菌的耐药性
2.3 对革兰阳性球菌的耐药性 在本研究中,排名居前三的革兰阳性菌为凝固酶阴性葡萄球菌、屎肠球菌和粪肠球菌。血液标本检出的凝固酶阴性葡萄球菌检出率29.6%。其中耐甲氧西林的葡萄球菌为41例,检出率为91.1%。检出的葡萄球菌对常规药物青霉素耐药率为100.0%,对苯唑西林耐药率为91.1%,对红霉素、克林霉素、环丙沙星和左旋氧氟沙星耐药率均高于50.0%,但对喹努普汀/达福普汀、利奈唑胺、替考拉宁和万古霉素的耐药率最为敏感。胆汁标本检出的凝固酶阴性葡萄球菌检出率为5.4%。其中耐甲氧西林的葡萄球菌为3例,检出率为60.0%。检出的葡萄球菌对青霉素、克林霉素和红霉素耐药率也为100.0%,对苯唑西林和复方新诺明耐药率为60.0%,对氨苄西林、环丙沙星和左旋氧氟沙星耐药率均为40.0%,但对喹努普汀/达福普汀、利福平、利奈唑胺、庆大霉素、替考拉宁和万古霉素的耐药率最为敏感。
血液标本中屎肠球菌的检出率为6.6%,对青霉素耐药率为80.0%,对氨苄西林、环丙沙星、庆大霉素和左旋氧氟沙星耐药率均为70.0%,但对喹努普汀/达福普汀、利奈唑胺、替考拉宁和万古霉素的耐药率最为敏感。胆汁标本中屎肠球菌的检出率为14.0%,对红霉素耐药率为92.3%,对青霉素和氨苄西林耐药率为84.6%,但对喹努普汀/达福普汀、利奈唑胺、替考拉宁、万古霉素的耐药性最为敏感。
就粪肠球菌而言,血液标本中检出率仅为2.0%。其对青霉素、氨苄西林、红霉素和环丙沙星耐药率为100.0%。对四环素耐药率耐药率为33.3%。对利奈唑胺、替考拉宁和万古霉素的耐药性最为敏感。胆汁标本中检出率为8.6%,对红霉素耐药率为75.0%,但对利奈唑胺和万古霉素的耐药性最为敏感。详细见表3。
2.4 真菌的耐药性 本研究中血液标本分离出白假丝酵母菌、近平滑假丝酵母菌和其他真菌,共计21例。而胆汁标本仅分离出白假丝酵母菌,共计2例,不过均未发现其对相关药物有耐药的表现。
2.5 革兰阳性杆菌的耐药性 本研究中血液标本分离出1例棒状杆菌,疑为污染所致,仅鉴定,无药物敏感度分析。

表3 AP患者血液和胆汁培养主要革兰阳性球菌的耐药性
3 讨论
本研究统计了天津市南开医院1195例AP患者血液和408例AP患者胆汁培养标本数据,其血液标本检出111例阳性病例,阳性率为9.2%,低于国内多家医院不分病种单纯分析血培养标本数据的报道[6-7]。这可能与本研究分病种收集有关,或是与收集的标本数量偏大有关系,也可能受地域等因素影响,具体原因有待进一步研究。但检出152株病原菌,1例标本检出大于一种病原菌的比例为36.9%,可见血液标本的多种病原菌感染并不少见。此外重度AP检出菌率(20%)高于其他类型的AP的检出率,可见重度AP血流感染的可能性大于其他类型AP。胆汁标本鉴定出85例阳性病例。阳性率为20.8%,与国内多家医院不分病种单纯分析血培养标本数据相近[6-7],约为血液标本检出阳性率的两倍。不过这有可能是因为血液取材更方便,临床医生以送检血液标本为主,造成统计胆汁标本数量相对而言偏少,以至于存在偏差。具体原因有待进一步分析。胆汁标本检出病原菌的数量为93株,1例标本检出大于一种病原菌的比例为9.4%。约为血液培养标本的一半。可见相对而言,血液标本虽说检出阳性率低于胆汁标本,但是检出多种病原菌的概率还是高于胆汁培养标本(约为2倍)。此外,第二诊断为胆道疾病(25.7%)、腹腔感染(23.2%)和其它疾病(36.8%)的中重度AP的胆汁检出菌率高于中重度AP为唯一诊断病例检出菌率(15.6%)和重度AP(7.1%),与血液培养统计结果不尽相同,可见胆汁培养对于不同类型的AP有不同的实用性。
本研究中血液标本病原菌由多到少依次为凝固酶阴性葡萄球菌、大肠埃希菌、肺炎克雷伯菌、近平滑假丝酵母菌、鲍曼不动杆菌和屎肠球菌。提示血液感染主要病原菌群为革兰阳性菌(74例,占48.7%),这与文献报道的结论相矛盾[8]。还有文献报道[9],儿科的患者血培养病原菌检出是以葡萄球菌为主。虽与本研究分析结果相同,但与本研究AP病人的疾病类型和人群的年龄取样有所不同。可见AP相关的血液感染病原菌的分布具有倾向性[6],有着自身的特点,并且以革兰阳性球菌感染为主也许是AP患者相关的血流感染主要特点之一。
临床上AP可以发生肠道菌群易位[10-11],或者胆道疾病,此时胆汁培养为常用的检测手段。本研究中胆汁标本排名为大肠埃希菌、屎肠球菌、肺炎克雷伯菌、粪肠球菌、凝固酶阴性葡萄球菌和鲍曼不动杆菌。其检出主要是以革兰阴性菌为主(56例,占60.2%),其中大肠埃希菌、肺炎克雷伯菌和鲍曼不动杆菌位居前三。有文献报道,血培养标本的病原菌是以大肠埃希菌和肺炎克雷伯菌为主[12]。与本研究的菌株分布类型结论相一致,只不过相应的标本类型不同罢了。提示大肠埃希菌的高检出率可能是胆汁培养菌独有的分布特点。究其原因,可能是因为血液本身成分的营养优势和胆汁中胆盐类的抑制或干扰造成的,不过这有待于进一步追踪和搜集数据证实。
病原菌耐药性的监测是指导临床合理用药的重要帮手。而就革兰阴性杆菌而言,大肠埃希菌检出数量和比例最多。血液和胆汁标本中产ESBLs的大肠埃希菌检出率分别为52.0%和66.7%,均对氨苄西林、头孢西丁、头孢唑林、头孢呋辛、头孢他啶和头孢曲松耐药率超过40.0%,且对丁胺卡那霉素和美罗培南均较敏感,可见胆汁中的大肠埃希菌比血液中大肠埃希菌更易耐药,原因有待于进一步研究。
血液培养和胆汁标本中产ESBLs的肺炎克雷伯菌检出率分别为45.5%和70.0%。两者对头孢呋辛、头孢唑林、头孢他啶和头孢曲松的耐药性超过40.0%,对头孢哌酮/舒巴坦敏感。不同之处在于,血液标本中仅对丁胺卡那霉素敏感。胆汁标本中还对头孢西丁和环丙沙星耐药率超过40.0%,仅对亚胺培南敏感。
鲍曼不动杆菌是我国乃至全球医院感染的重要病原菌其中的一种,其感染率一直在增加,耐药率也在日益增加。从本研究中鲍曼不动杆菌耐药率位居榜首就可以“一叶知秋”了,在血液和胆汁标本中,鲍曼不动杆菌对头孢吡肟、头孢他啶、庆大霉素、头孢曲松、哌拉西林/他唑巴坦、环丙沙星、碳氢酶烯类和妥布霉素的耐药率均超过60.0%。此外,在血液标本中,对头孢西丁和复方新诺明敏感。但在胆汁标本中,对头孢西丁和丁胺卡那霉素耐药率达到50.0%。可见血液标本中鲍曼不动杆菌的耐药性高于胆汁标本,这可能是因为广泛使用该类药物导致的。所以在AP患者的防治过程中,不可小觑鲍曼不动杆菌的防治,而应该加以重视,谨慎对待,特别是在血液感染防治过程中。
在本研究中,排名居前三的革兰阳性球菌为凝固酶阴性葡萄球菌、屎肠球菌和粪肠球菌。血液培养和胆汁培养标本耐甲氧西林的葡萄球菌检出率分别为91.1%和60.0%。其均对青霉素、苯唑西林、红霉素、克林霉素、环丙沙星和左旋氧氟沙星的耐药率均高于50.0%,不容易对四环素耐药。但未发现对喹努普汀/达福普汀、利奈唑胺、替考拉宁和万古霉素耐药。除此之外,在胆汁培养标本中,凝固酶阴性葡萄球菌有着不同的特点,其对苯唑西林和复方新诺明的耐药率也很高(60.0%),但对利福平和庆大霉素敏感。这类药物在抗生素滥用和耐药菌横行的今天,可能是其防治的最后一根稻草了。这些不同有可能是因为标本本身来源类型的不同造成的。不过应注意的是,本次收集的胆汁培养出的凝固酶阴性葡萄球菌菌株数偏少,与血液培养出的凝固酶阴性葡萄球菌菌株数相差稍大,不知是否对两者有不同影响。另外,有文献报道,单瓶阳性的血培养分离的CNS多为污染所致[13]。而在本次研究中,血液培养标本中CNS的检出率为45例(29.6%),远高于同为革兰阳性的屎肠球菌(10例,6.6%)和粪肠球菌(3例,2.0%)的检出率。所以血液培养标本中居高检出率的CNS有可能是由环境污染或介入性检查或治疗等操作导致的,故应提示临床医生在取材时一定得注意操作规范,并要综合患者症状考虑治疗方案。
血液和胆汁标本检出的屎肠球菌株数相近,但其在胆汁标本中的检出率高于血液标本。两者对红霉素、青霉素、氨苄西林、环丙沙星、庆大霉素和左旋氧氟沙星耐药率均高于40.0%,但对喹努普汀/达福普汀、利奈唑胺、替考拉宁和万古霉素的耐药最为敏感,而胆汁标本中对苯唑西林和复方新诺明耐药率也均高于40.0%,高于血液标本相应菌株耐药性。相反,血液标本中对四环素的耐药率也均高于40.0%,高于胆汁标本相应菌株的耐药性。
粪肠球菌在血液标本和胆汁标本中检出率分别为2.0%和8.6%,其均对氨苄西林、红霉素和左旋氧氟沙星耐药率超过40.0%,对利福平、利奈唑胺、替考拉宁和万古霉素的耐药最为敏感。不同的是,血液标本中粪肠球菌对青霉素和环丙沙星100.0%耐药,而胆汁标本中粪肠球菌才表现为37.5%的耐药。血液标本中粪肠球菌也对苯唑西林和复方新诺明100.0%敏感。而胆汁标本中粪肠球菌表现为37.5%和25.0%的耐药。可见肠球菌对多数抗生素耐药,其中对红霉素、氨苄西林和左旋氧氟沙星等耐药率均高达40%以上,但未发现对利奈唑胺、万古霉素和替考拉宁耐药的肠球菌。
根据文献[14],本研究同时进行需氧及厌氧培养的常规血或胆汁培养模式,以便提高厌氧菌的检出率。但本研究中未分离出厌氧菌,可见其检出率低于不分病种的数据分析[2]。不过也间接地说明了临床上AP相关血液培养和胆汁培养分离出的厌氧菌的小比例情况。
本研究中真菌感染的比例呈上升趋势,特别是血液培养标本。主要是因为临床上抗生素和免疫抑制剂等药物的应用和病人自身的免疫力低下,以及一些侵入性护理或治疗[15]。这可能是患者自身免疫力的下降或是临床上广谱抗菌药物的滥用等原因造成的,本研究中分离到了真菌菌株对常规的几种抗真菌的药物伏立康唑、氟康唑和伊曲康唑显示敏感。尽管显示敏感,但临床AP诊疗中还是应预防真菌感染[16]。
参考文献:
[1] Lankisch PG, Apte M, Banks PA. Acute pancreatitis [J]. Lancet,2015, 386(9988): 85-96.
[2] Manes G, Kahl S, Schulz HU, et al. Early bacterial infection of the pancreas and course of disease in cerulein-induced acute pancreatitis in rats [J]. Digest Liver Dis, 2006, 38(6): 423-428.
[3] De HG, Forcelledo JL, Gutiérrez JM, et al. Selective intestinal bacterial decontamination in experimental acute pancreatitis [J].Gastroenterol Hepatol, 2000, 23(10): 461-465.
[4] Foitzik TK, Mithöfer M, Ferraro J, et al. Time course of bacterial infection of the pancreas and its relation to disease severity in a rodent model of acute necrotizing pancreatitis [J]. Ann Surg,1994, 220(2): 193-198.
[5] Banks PA, Bollen TL, Dervenis C, et al. Classi fi cation of acute pancreatitis-2012: Revision of the Atlanta classification and de fi nitions by international consensus [J]. Gut, 2013, 62(1): 102-111.
[6] 姚玉霞, 徐宝宏, 王乐. 重症急性胰腺炎并发菌血症的临床分析 [J].北京医学, 2012, 34(6): 475-478.
[7] 金松, 吴小军, 蔡璇. 19284份血培养的病原菌分布及耐药性分析 [J]. 武汉大学学报(医学版), 2016, 37(5): 845-848.
[8] 陈斌泽, 张媛媛, 薛荣利, 等. 某三级医院2012—2015年血培养病原菌分布及其耐药性 [J]. 中国感染控制杂志, 2016,15(3): 164-167.
[9] 刘雪梅, 迟富丽, 谈华, 等. 新生儿血培养病原菌分布及耐药性分析 [J]. 南京师大学报(自然科学版), 2016, 39(3): 106-109.
[10] Furuya T, Soeno T, Komatsu M. Strategy for bacterial translocation in acute pancreatitis [J]. Nihon Shokakibyo Gakkai Zasshi, 2004, 101(5): 502-509.
[11] Schwarz M, Thomsen J, Meyer H, et al. Frequency and time course of pancreatic and extrapancreatic bacterial infection in experimental acute pancreatitis in rats [J]. Surgery, 2000, 127(4):427-432.
[12] 徐佳庆, 张肖, 陆峰泉, 等. 2012~2014年江苏某医院血培养阳性病原菌种类及耐药性监测 [J]. 国际检验医学杂志, 2016,37(10): 1350-1351.
[13] 徐雅萍, 罗燕萍, 周光, 等. 凝固酶阴性葡萄球菌所致血行感染的相关研究 [J]. 中华医院感染学杂志, 2006, 16(2): 224-226.
[14] 陈明慧, 房杰, 孙兰菊. 676株血培养病原菌种类分布及耐药性 [J]. 中国中西医结合外科杂志, 2014, 20(5): 496-500.
[15] Rossetto A, Baccarani U, Lorenzin D, et al. Disseminate Fungal Infection after Acute Pancreatitis in a Simultaneous Pancreas-Kidney Recipient [J]. J Transplant, 2010, 2010: 898245.
[16] 覃羽华, 岑光旅, 王春芳, 等. 条件致病性真菌感染的基因分型与耐药性分析 [J]. 中华医院感染学杂志, 2016, 26(20):4598-4601.

