新辅助化疗对胃癌淋巴结分期评估以及预后的影响
邱海江,吴志明,方孙阳
已有研究表明,病理降期的新辅助化疗胃癌患者预后好于单纯手术的胃癌患者[1-2],但是有关新辅助化疗对胃癌患者术后总淋巴结数和阳性淋巴结获取数的影响还不清楚。新辅助化疗在胃癌中的应用是否可能导致总淋巴结数和转移淋巴结数的减少,从而导致患者的淋巴结分期被低估,目前尚不清楚。本文回顾性分析中国医科大学绍兴医院2007年9月—2011年9月收治的部分胃癌病例,总结新辅助化疗对术后淋巴结分期评估以及预后的影响。
1 资料与方法
1.1 一般资料 本组共226例。纳入标准:(1)经组织病理学确诊为胃癌;(2)均完成治疗(化疗加手术);(3)术前经腹部增强CT及超声内镜评估为期ⅢA、ⅢB、ⅢC期(根据2010年第7版AJCC胃癌TNM分期);(4)新辅助化疗方案均为Folfox6;(5)术后随访患者5年。新辅助化疗组58例,男47例,女11例;年龄36~88岁;平均(59.8±10.5)岁;直接手术组168例,男117例,女51例;年龄32~85岁平均(60.3±11.1)岁。所有对象均采用胃镜活检、超声内镜、胸部CT、腹部增强CT等进行术前评估[2-3]。两组患者在年龄、性别、肿瘤位置、肿瘤分期及病理方面比较均无统计学意义(P<0.05),见表1。
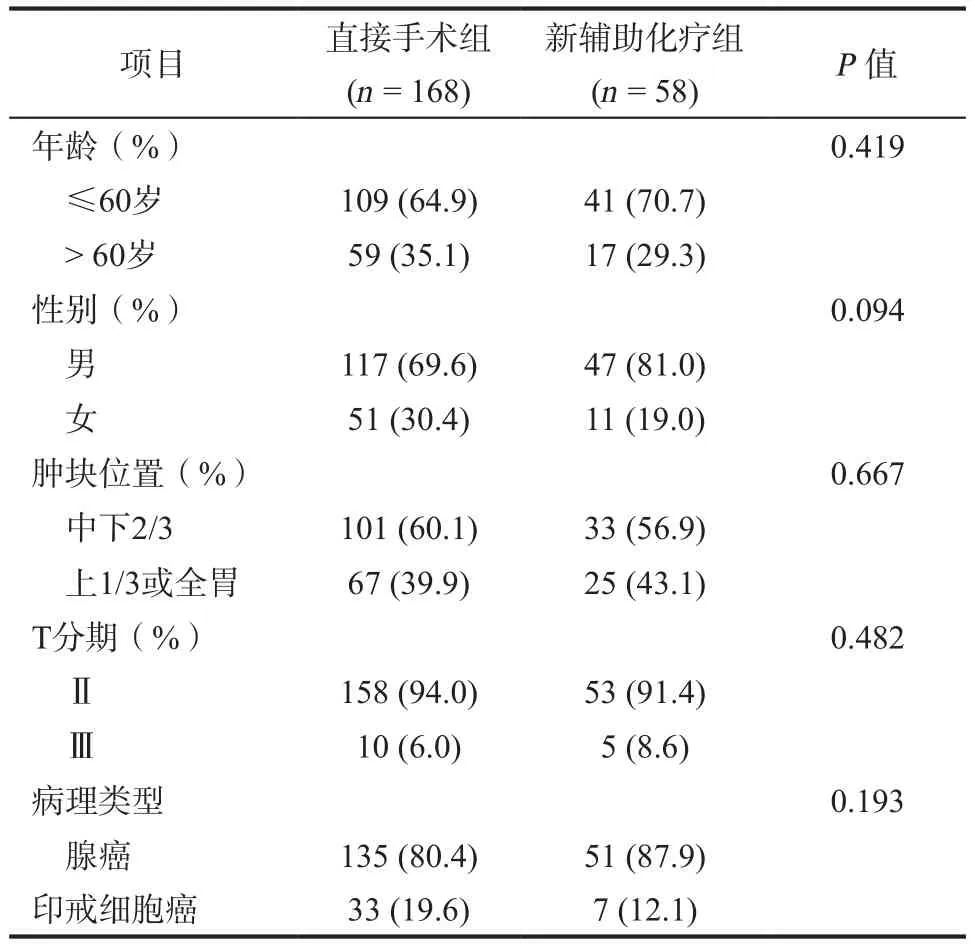
表1 两组患者基本资料比较
1.2 方法
1.2.1 新辅助化疗 新辅助化疗方案(Folfox6):奥沙利铂(OXA):100 mg/m2,静脉滴注2 h,第1 d;亚叶酸钙(LV):200 mg/m2,静脉滴注2 h,第1 d,5-FU 400 mg/m2,静脉推注,后续5-FU 2.4 g/m2以化疗泵持续46 h恒速静脉输入,每2周重复一次,为一个周期。患者在接受两个周期的化疗之后以螺旋CT评估局部情况。对于化疗后局部缓解者,继续进行1~2周期的新辅助化疗;如果局部病灶进展则直接进行手术;若局部病灶改善不明显,与患者及家属充分沟通后自愿选择直接进行手术或者再接受1~2个周期的新辅助化疗。
1.2.2 手术治疗 所有手术均由同一专业组医师实施。新辅助化疗组58例患者在接受两个周期的化疗之后以螺旋CT再评估局部情况,其中40例患者新辅助化疗后局部缓解,继续进行1~2周期的新辅助化疗后行手术;6例局部病灶进展则直接进行手术;12例局部病灶改善不明显,与患者及家属充分沟通后自愿选择直接进行手术。直接手术组168例在住院后完善术前相关检查及准备后行手术治疗两组手术方式均根据术前胃镜、超声内镜及术中探查肿块部位及大体观决定是进行全胃切除或者胃次全切除,标准D2淋巴结清扫。2例怀疑有癌细胞浸润脾脏,1例术中脾脏损伤,行脾脏联合脏器切除。2例侵犯横结肠,行横结肠联合切除。
1.3 病理检查 病理科统一标准取材、制片、检查。
1.4 术后随访 患者随访截至死亡或者到2016年9月1日。术后两年每3月随访一次,术后3~5年每6月随访一次。总随访时间为60月。
1.5 统计学分析 所有数据均采用SPSS19.0 for Windows统计软件进行处理。计量数据以平均数±标准差(±s)表示,两组间差异比较采用t检验,组间计数数据的差异比较采用χ2检验,生存率根据Kaplan-Meier法计算,以Log-rank检验分析组间生存率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术治疗并发症比较 两组患者术后均有出现吻合口瘘、吻合口出血、十二指肠残端瘘、切口感染、肺部感染等并发症,两组间并发症总发生率比较差异无统计学意义。见表2。

表2 两组患者手术治疗并发症比较(n,%)
2.2 两组患者治疗后淋巴结数比较 与直接手术组比较,新辅助化疗组患者术后总淋巴结数明显减少(P< 0.05),小于15枚淋巴结的病例数明显减少(P<0.01)。直接手术组中因评估淋巴结不足15枚而不能正确分期者14例,新辅助化疗组不足15枚而不能正确分期者13例。见表3。

表3 两组患者治疗后总淋巴结数比较
2.3 两组患者治疗后淋巴结转移分期比较 与直接手术组相比较,新辅助化疗组 N1 、N2 、N3分期例数减少,差异有统计学意义,见表4。

表4 两组患者治疗后淋巴结转移分期比较
2.4 两组患者生存率比较 1年生存率(79.3%vs 79.2%)无统计学差异,3年生存率(63.8%vs 47.6%)有统计学差异,5年生存率(34.5% vs 22.7%)有统计学差异。详见图1。

图1 两组患者不同时间点的生存曲线
3 讨论
胃癌仍然是全世界发病率较高的恶性肿瘤之一,尽管欧美等西方国家发病率有下降趋势,但因为大多数病人就诊时肿瘤己处于进展期,预后通常较差[4]。在中国,胃癌的发病率依然居高不下,大多数为进展期胃癌患者,肿瘤细胞常常已侵犯浆膜层或出现了淋巴转移、血行转移及腹腔种植转移。进展期胃癌的总预后较差,即便是区域淋巴结扩大清扫、多脏器联合切除等方式也已证明不能带来更多的生存获益[5-6],新辅助化疗备受关注。新辅助化疗兴起的这20余年,多种观点分析其许多特点。首先,新辅助化疗患者的耐受性和依从性好于术后化疗患者;同时,在手术离断周围血管前进行化疗,疗效会更好[7];新辅助化疗还可以使原发肿瘤降期并缩小肿瘤的原发灶进而使病人有更大的机会接受根治性切除(R0);新辅助化疗还可以在最早期处理进展期胃癌患者体内的微转移,并可以检测患者的化疗敏感性[8]。对于新辅助化疗也存在一些质疑,尽管很多研究表明因新辅助化疗使手术时间延迟并不会降低潜在可切除患者的手术受益程度[9],然而也有研究表明,确有小部分患者在新辅助化疗期间出现了肿瘤进展[10],这也是少部分病人拒绝接受新辅助化疗的原因。2015年最新的meta分析表明当前的临床证据显示新辅助化疗可改善胃癌患者的生存率以及根治性切除率[11]。尤其是MAGIC试验[12],该大样本、随机临床研究证实新辅助化疗能降低肿瘤分期,提高手术R0切除率(79% vs70%),提高5年生存率(36% vs 23%),不良反应可耐受,并不增加手术死亡及并发症,为“新辅助化疗+手术+术后化疗”这种模式的应用提供了高级别循证医学证据。
淋巴结总数在胃癌患者的诊疗评估中是一个很关键的临床参数,高的淋巴结检出率意味着充分的淋巴结分期评估,也为患者预后提供一种有重要参考意义的实用数据[1]。许多研究表明,淋巴结清扫数目与术后病理分期和预后评估密切相关,合适的淋巴结清扫数目能够提高胃癌患者术后病理分期可靠性及预后判断的准确性[13]。国际抗癌联盟(UICC)修订的第5版胃癌TNM分期系统,要求切除的淋巴结数目最低不能少于15枚。梁寒等[14]的研究却认为无论分期早晚,胃癌患者淋巴结清扫数目如超过20枚以上者生存率并没有明显提高,反而会因过多的淋巴结清扫增加手术的难度,也会给患者带来更大的损伤,但如果低于15枚则可能会导致分期不准确,因此他们也推荐以15枚为标准。本文回顾性对比分析了新辅助化疗对胃癌患者的一些临床病理参数,结果显示,与直接手术组患者相比,经新辅助化疗后,胃癌患者总淋巴结数目明显减少[(29.6±11.7) vs(25.3±12.6),P<0.05],小于15枚淋巴结的病例数明显减少 [(14/168) vs (13/58),P<0.005],这个结果提示新辅助化疗减少术后淋巴结总数,从而导致检出小于15枚淋巴结胃癌患者的增加。随着新辅助化疗的推广,小于15枚淋巴结的胃癌患者会有所增加,将有助于进一步分析两者间的关联。
转移淋巴结数对于胃癌患者预后的影响已经得到临床的普遍共识,AJCC/UICC分期是目前胃癌诊治中最权威的分期方法,UICC的TNM分期是以淋巴结转移枚数进行术后N分期,因能准确地表达胃癌的扩展程度及分期与预后的一致性,具有更科学、更简便和更实用的优点,已在临床中逐渐推广应用。本研究显示和直接手术组相比,新辅助化疗后,转移的淋巴结数明显减少[(9.8±2.5) vs (5.7±3.4),P<0.05],淋巴结分期显 示 N2分期 [(90/168) vs (17/58),P<0.005]和N3分期 [(58/168) vs (9/58),P< 0.005]患者明显减少,N1期[19/168) vs (30/58),P<0.005]患者明显增多,有助于降低患者临床病理分期,和Ge等[15]发表的meta分析的结果一致。
影响胃癌的预后因素有很多,Becker等[16]研究认为,单因素分析,术后淋巴结状态、肿瘤浸润深度、分化程度、病理学缓解程度分级对预后有统计学意义,多因素分析显示病理学缓解程度分级及术后淋巴结状态为独立预后因素。Fujitani等[17]研究认为,单因素分析显示,术后淋巴结状态,浸润深度,是否R0切除以及病理学缓解程度对预后有统计学差异,但多因素分析显示只有术后淋巴结状态为独立预后因素。Koh等[18]研究认为,单因素分析,病理学完全缓解,肿瘤分化以及术后淋巴结状态预后有统计学意义,但多因素分析显示术后淋巴结状态以及肿瘤分化为独立预后因素。本研究结果显示和直接手术组相比较,新辅助化疗组患者的3年生存率(63.8% vs 47.6%)和5年生存率(34.5% vs 22.7%)明显提高,淋巴结转移数与患者预后密切相关,成为患者预后重要影响因素。
参考文献:
[1] Liu C, Lu Y, Jun Z, et al. Impact of total retrieved lymph nodes on staging and survival of patients with gastric cancer invading the subserosa [J]. Surg Oncol, 2009, 18(4): 379-384.
[2] Coimbra FJ, Costa WL Jr, Montagnini AL, et al. The interaction between N-category and N-ratio as a new tool to improve lymph node metastasis staging in gastric cancer:Resultsof a single cancer center in Brazil [J]. Eur J Surg Oncol, 2011, 37(1): 47-54.
[3] 陈健, 任刚, 蔡嵘. CT在胃癌pN分期中的价值研究进展 [J].临床和实验医学杂志, 2015, 14(19): 1660-1662.
[4] Schuhmacher C, Gretschel S, Lordick F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954 [J]. J Clin Oncol, 2010, 28(35): 5210-5218.
[5] Maeta M, Yamashiro H, Saito H, et al. A prospective pilot study of extended (D3) and superextended para-aortic lymphadenectomy(D4) in patients with T3 or T4 gastric cancer managed by total gastrectomy [J]. Surgery, 1999, 125(3): 325-331.
[6] Adachi Y, Suematsu T, Yasuda K, et al. Clinicopathologic study of gastric cancer based on Dukes’ classi fi cation [J] .World J Surg,1999, 23(5): 499 -502.
[7] Fujitani K. Overview of adjuvant and neoadjuvant therapy for resectable gastric cancer in the East [J]. Dig Surg, 2013, 30(2):119-129.
[8] Lordick F, Ott K, Sendler A. Gastric cancer and adenocarcinoma of the esophagogastric junction: principles of neoadjuvant therapy[J]. Chirurg, 2011, 82(11): 968-973.
[9] Biondi A, Lirosi MC, D’ugo D, et al. Neo-adjuvant chemo(radio)therapy in gastric cancer: Current status and future perspectives [J].World J Gastrointest Oncol, 2015, 7(12): 389-400.
[10] Ajani JA, Mayer RJ, Ota DM, et al. Preoperative and postoperative combination chemotherapy for potentially resectable gastric carcinoma [J]. Natl Cancer Inst, 1993, 85(22): 1839-1844.[11] Okines AF, Norman AR, McCloud P, et al. Meta-analysis of the REAL-2 and ML 17032 trials: evaluating capecitabinebased combination chemotherapy and infused 5-fluorouracilbased combination chemotherapy for the treatment of advanced oesophago-gastric cancer [J]. Ann Oncol, 2009, 20(9): 1529-1534.
[12] Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer [J]. N Engl J Med, 2006, 355(1): 11-20.
[13] 冯兴宇, 陈映波, 陈实, 等. Ⅱ期胃癌D2根治术淋巴结清扫数目与预后的关系 [J]. 中华胃肠外科杂志, 20l0, l3(5): 346-348.
[14] 梁寒, 薛强, 张汝鹏, 等. 胃癌D2根治术淋巴结切除数目与预后的关系 [J]. 中华胃肠外科杂志, 2007, 10(6): 528-530.
[15] Ge L, Wang HJ, Yin D, et al. Effectiveness of 5-flurouracilbased neoadjuvant chemotherapy in locally- advanced gastric/gastroesophageal cancer:a meta-analysis [J]. World J Gastroenterol, 2012, 18(48): 7384-7393.
[16] Becker K, Langer R, Reim D, et al. Significancer of histopathological tumor regression after neoadjuvant chemotherapy in gastric adenocarcinomas [J]. Ann Surg, 2011,253(5): 934-939.
[17] Fujitani K, Mano M, Hirao M, et al. Posttherapy nodal status, not graded histologic response, predicts survival after neoadjuvant chemotherapy for advanced gastric cancer [J]. Ann Surg Oncol,2012, 19(6): 1936-1943.
[18] Koh YW, Park YS, Ryu MH, er al. Postoperative nodal status and diffuse-type histology are independent prognostic factors in resectable advanced gastric carcinomas after preoperative chemotherapy [J]. Am J Surg Pathol, 2013, 37(7): 1022-1029.

