大鼠体内三聚氰胺及其代谢物双波长HPLC检测方法的建立
李月秋,陆治名,王鑫超,毛 震,张竞文,齐 畅,刘丽艳,邸科前*
(1.河北大学医学综合实验中心,河北保定 071000;2.河北大学公共卫生学院,河北保定 071000)
三聚氰胺常用于食品接触材料中(层板、塑料),也常用于动物饲料氮的补充剂,同时也是杀虫剂环丙氨嗪的代谢物[1],不法经营者也会用于原料奶掺假以提高检测蛋白含量。三聚氰酸是三聚氰胺工业生产中的水解产物[2],其在食物链的各个环节均有存在,对人体的危害亦是全球共知的。
目前,国内外有关应用各种方法对原料乳及乳制品[3-4]、鸡蛋及肉[5]、水产品[6]等各种食品[7]、食品接触产品[8]、饲料[9]中三聚氰胺、三聚氰酸含量测定的报道较多。已有大鼠血浆、肝组织[10]和尿液[11]中三聚氰胺及三聚氰酸同时检测报道。有些研究表明了三聚氰胺、三聚氰酸摄入会最终进入泌尿系统,导致尿酸增多。目前,国内外尚未见到双波长高效液相色谱法同时对不同给药剂量组大鼠肾脏、尿液中三聚氰胺、三聚氰酸及尿酸3种成分同时分离检测的报道。本文研究建立双波长高效液相色谱法,用于跟踪检测不同给药剂量组大鼠肾脏、尿液中三者含量情况,为深入研究三聚氰胺对人体健康影响提供依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 三聚氰酸(98%)、三聚氰胺(99%)、尿酸(99%)均为分析纯试剂,阿拉丁试剂(上海)有限公司产品;甲醇为色谱纯,天津康科德公司产品;乙酸铵、磷酸氢二钾、乙腈、硫酸钠、柠檬酸钠、高氯酸、三氯乙酸等试剂均为分析纯。
1.1.2 实验动物 80只成熟SD大鼠,购自河北省实验动物中心,体重180 g~200 g。
1.1.3 主要仪器 LC-10ATvp高效液相色谱仪、SPD-M10Avp 二极管阵列检测器、CLASS-VP工作站,日本岛津公司产品;PT 2100台式匀浆机,瑞士Kinematica 公司产品;DELTA-320型酸度计,梅特勒-托利多仪器有限公司产品;离心机(TGL-16G),上海安亭科学仪器厂生产。
1.2 方法
1.2.1 动物分组 80只成熟SD大鼠,随机分为4组,每组20只,雌雄各半。第1组为正常对照组,第2组至第4组为给药组。第1组按1 mL /(100 g·d)灌胃鲜牛奶;第2组为0.5 g/kg三聚氰胺组,第3组为1.5 g/kg三聚氰胺组,第4组为2.5 g/kg三聚氰胺+2.5 g/kg三聚氰酸组。第2组至第4组按1 mL/(100 g·d)给予三聚氰胺或三聚氰胺及三聚氰酸鲜牛奶。第1组至第4组均连续灌胃3 d,每组大鼠均自由饮水。
1.2.2 标准储备液配制 精密称定三聚氰胺、三聚氰酸、尿酸对照品适量,分别配成1 mg/mL、1 mg/mL、80 μg/mL标准储备液,置于4℃冰箱中作为标准储备液冷藏保存。使用时用超纯水稀释标准储备液配制混合标准工作液。
1.2.3 样品处理 分别取大鼠肾组织,称重,置5 mL离心管,按1∶40(m/V)的比例加入0.6 mol/L高氯酸蛋白沉淀剂,匀浆、离心(12 000 r/min,15 min),取上层清液,加入等体积高氯酸沉淀剂,在冰浴中放置10 min,12 000 r/min离心15 min,取上层清液,用0.45 μm滤膜过滤后进行分析。
取大鼠尿液,称重,置5 mL离心管,按尿液及0.6 mol/L高氯酸体积比为1∶40的比例加入高氯酸蛋白沉淀剂,涡旋混合、冷冻离心(12 000 r/min,15 min),取上层清液,加入等体积高氯酸沉淀剂,在冰浴中放置10 min,离心(12 000 r/min,15 min),取上层清液,用0.45 μm滤膜过滤后进行分析。
1.2.4 色谱条件 色谱柱为Agela Promosil C18(250 mm×4.6 mm i.d.,5 μm);流动相为:0.5 mmol/L磷酸盐(pH 7.4)-甲醇(95:5),流速1 mL/min,柱温25℃,进样量10 μL,三聚氰胺和三聚氰酸检测波长为213 nm,尿酸检测波长为285 nm。
1.2.5 标准曲线绘制 量取1.2.1标准储备液,用超纯水稀释配制成一系列浓度不同的标准混合溶液(三聚氰胺、三聚氰酸、尿酸的浓度范围分别为0.10~100、0.50~100、0.20~100 μg/mL,按照1.2.4色谱条件依次进样测定。以质量浓度x(μg/mL)对峰面积y作图,绘制标准曲线。
1.2.6 方法学验证
1.2.6.1 检出限 按3倍信噪比(S/N=3)计算检出限(LOD)。
1.2.6.2 回收率和精密度 取空白肾脏样品50.0 mg 9份,空白尿液50 μL 9份,分别加入高、中、低3种浓度的混合标样各3份,按照1.2.3条件对样品进行前处理,然后按照1.2.4色谱条件测定三聚氰胺、三聚氰酸、尿酸的加标回收率及精密度(RSD)。
1.2.6.3 稳定性试验 在肾脏组织匀浆液和尿液中分别加入含有一定量的三聚氰胺、三聚氰酸、尿酸混合标样,按照1.2.3对样品进行处理,分别在0、6、12、24、48、72 h时取样进行测定。
1.2.6.4 专属性试验 取正常组肾脏、尿液样品各2份,其中1份分别添加混合标准品,按照1.2.3项下的样品处理条件处理肾脏和尿液,将处理好的肾脏、尿液样品及混合标准品按照1.2.5试验条件进样测定。
2 结果
2.1 流动相
2.1.1 缓冲体系 以甲醇为有机相,以磷酸盐为缓冲体系,三者均能出峰,而且分离度能够达到要求。
2.1.2 磷酸盐缓冲液pH 以1 mmol/L磷酸盐-甲醇(95∶5,V/V)作为流动相,三聚氰酸、尿酸随pH增加灵敏度稍有增加;pH为7.4时,三者分离效果最好。如图1所示,磷酸盐缓冲液pH选为7.4。
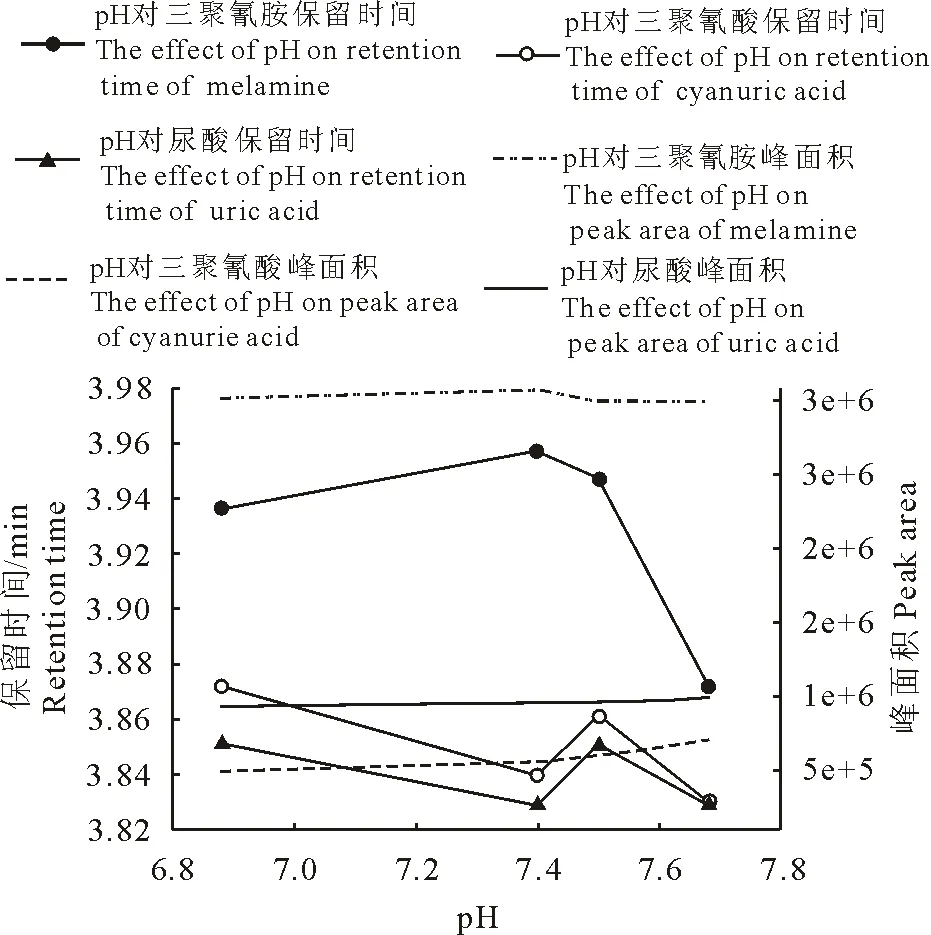
图1 pH对保留时间及峰面积影响Fig.1 Effects of pH on retention time and peak area
2.1.3 磷酸盐缓冲液浓度 以磷酸盐(pH 7.4)-甲醇(95∶5)作为流动相,磷酸盐浓度为0.5 mmol//L时,三者分离效果最好(图2)。
2.1.4 流速 以0.5mmol/L磷酸盐(pH 7.4)-甲醇(95∶5)作为流动相,三者随流速增加,迁移时间均减小,流速大于1 mL/min时,三者分离情况变差;
流速小于1 mL/min时,分离情况受流速影响不大,因此选择1 mL/min。

图2 磷酸盐浓度对保留时间影响Fig.2 Effect of phosphate concentration on retention time
2.2 检测波长
在ClASS-VP工作站中,对三者色谱峰进行分析,表明三聚氰胺、三聚氰酸、尿酸的灵敏检测波长分别为213、213、285 nm。考虑到提高3种物质的检测灵敏度及二极管阵列检测器的优点,由于三聚氰胺、三聚氰酸在285 nm几乎没有吸收,尿酸在285 nm灵敏度明显高于213 nm处,因此选择213 nm作为三聚氰胺、三聚氰酸检测波长,285 nm作为尿酸检测波长(图3)。
2.3 标准曲线和检出限
三聚氰胺、三聚氰酸、尿酸的线性方程、线性范围及检出限(LOD)见表1。

表1 三聚氰胺及其代谢物线性方程、线性范围及检出限
2.4 回收率和精密度
三聚氰胺、三聚氰酸、尿酸的加标回收率及精密度(RSD)见表2。
2.5 稳定性试验
3种物质含量的RSD范围为0.86%~1.03%,说明样品溶液在3 d内检测稳定性良好。
2.6 专属性试验
肾脏、尿液中的内源物质不干扰测定,见图3。
2.7 样品测定
肾脏和尿液中三聚氰胺及其代谢物的测定结果见表3。结果表明,同时摄食三聚氰胺与三聚氰酸,产生肾脏结石的可能性显著高于单纯摄食三聚氰胺(P<0.001),此结果与已报道的结果有相同之处。三聚氰胺高剂量组产生肾脏结石的可能性显著高于低剂量组(P<0.001)。表明体内蓄积三聚氰胺、三聚氰酸的量与灌胃给药中所含三聚氰胺的量呈正相关。另外,摄食三聚氰胺、三聚氰酸造成肾脏结石的同时,也会造成尿液中尿酸含量增多(P<0.001)。
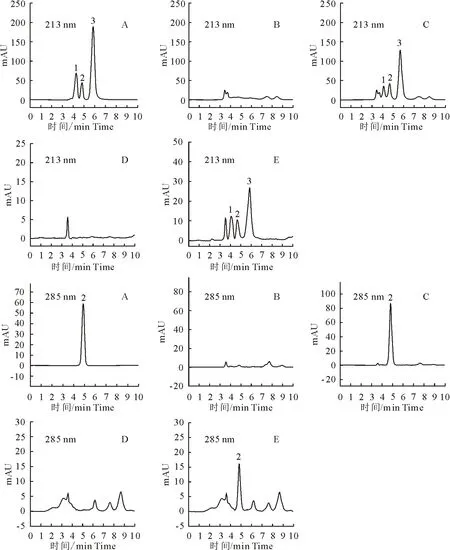
A.混合标准品;B.正常组尿液;C.正常组尿液加标;D.正常组肾脏;E.正常组肾脏加标
1.三聚氰酸 2.尿酸 3.三聚氰胺
A.Mixed standard;B.Urine of normal group;C.Added standard to urine of normal group; D.Kidney of normal group; E.Added standard to kidney of normal group
1.Melamine 2.Uric acid 3.Cyanuric acid
图3 213 nm和285 nm波长下尿液和肾脏色谱图
Fig.3 Chromatography of urine and kidney at 213 nm and 285 nm
3 讨论
3.1 流动相选择
盐离子容易堵塞色谱柱及整个流路系统,试验结束冲洗体系时,需要时间较长,因此不宜选择较高浓度。已报道的三聚氰胺、三聚氰酸同时分离检测的高效液相色谱法的流动相中多含有乙酸铵[3,10]。李玉玉等[12]以纯磷酸盐作为流动相,三者能够同时分析检测。
本研究以磷酸盐(pH 7.4)-甲醇(95∶5)作为流动相,考察磷酸盐浓度(0.5、1、5、10、20 mmol/L)对分离效果影响。如图2所示,三者迁移时间在浓度小于10 mmol/L时,均随浓度增加而增大。浓度大于10 mmol/L时,三者迁移时间均减小。浓度为5 mmol/L时,三聚氰酸和尿酸完全重合,不能分开。磷酸盐浓度为0.5 mmol//L时,三者分离效果最好。综合考虑,选择磷酸盐浓度为0.5 mmol/L。此流动相与李玉玉等人建立的方法相比[12],可以避免纯缓冲液流动相体系对流路系统的损害。

表2 平均回收率及相对标准偏差(n=6)
3.2 样品处理
3.2.1 匀浆器 组织样品在分析检测前需要匀浆处理。因此,试验中分别用手动玻璃匀浆器、匀浆机处理肾脏样品。用手动匀浆处理肾脏样品费时费力、匀浆不易彻底,且会有一部分生物样品粘在匀浆器内壁造成样品直接损失,回收率降低;用均浆机研磨肾脏,能分散生物组织,破碎细胞,同时省时省力,可较好地提高样品回收率。
3.2.2 蛋白质沉淀剂选择 肾脏及尿液中含有蛋白质等成分,组成复杂,因此样品中蛋白质沉淀方法选择非常重要。徐玲[13]选用乙腈作为尿液沉淀剂,乙腈和尿液体积比为1∶1时,沉淀基本完全。何君等[10]对大鼠血浆及组织匀浆液采用乙腈对蛋白质进行沉淀。

表3 肾脏和尿液中三聚氰胺及其代谢物含量测定结果
注:①与0.5 g/kg三聚氰胺组比较,△P<0.05,△△P<0.01,△△△P<0.001;②与1.5 g/kg三聚氰胺组和0.5 g/kg三聚氰胺组比较,*P<0.05,**,P<0.01,***P<0.001。
Note:①Compared with 0.5 g/kg melamine group, △P<0.05, △△P<0.01, △△△P<0.001;②Compared with 1.5 g/kg and 0.5 g/kg melamine group, *P<0.05,**P<0.01,***P<0.001.
本试验考察了乙腈、100 g/L三氯乙酸、0.6 mmol/L高氯酸[14]对蛋白质的沉淀效果。结果表明,前两种作为蛋白质沉淀剂时,在4 min~ 6 min杂质峰较多,干扰测定;而选用高氯酸处理样品时,杂质峰较少,除蛋白质效果较好,这与赵燕燕等[14]应用高效液相色谱法测定大鼠不同脑区中的8种单胺类神经递质所选用的除蛋白质方法相同。
本试验同时考察了高氯酸浓度(0.1 mol/L~0.8 mol/L)、样品和高氯酸比例(0.05∶1、0.05∶2、0.05∶3,m/V)对沉淀蛋白效果影响。试验结果表明,高氯酸浓度低于0.6 mol/L时,蛋白质除不干净,杂质峰较多,高氯酸浓度过高会引起三聚氰胺分解。当0.6 mol/L高氯酸与待分析样品以0.05∶2质量体积比混合时,杂质峰干扰小,基本能达到基线分离。因此,选择0.6 mol/L高氯酸,以0.05∶2质量体积比处理肾脏样品。
3.3 检测结果分析
梁毅文等[2]对大鼠进行三聚氰胺、三聚氰酸联合灌胃,发现大鼠肾脏内会形成一种不溶于水的晶体, 堵塞肾小管造成肾脏损害甚至急性肾功能衰竭, 并可能与尿酸等成分一起诱发泌尿系结石。Dorne J L等[1]的研究结果也表明三聚氰胺、三聚氰酸同时存在于体内的毒性大于单独存在。应用本试验建立的方法对大鼠肾脏、尿液进行检测,结果表明摄食三聚氰胺、三聚氰酸造成肾脏结石的同时,也会造成尿液中尿酸含量增多,与梁毅文等研究结果有相同之处。
综上所述, 本研究建立的双波长高效液相色谱法同时检测大鼠体内三聚氰胺及其代谢物含量,具有操作简便、灵敏度高、结果准确可靠等优点,是测定动物体内三聚氰胺及其代谢物含量的有效方法,可监测摄食三聚氰胺后对肾脏、尿液产生的影响,进一步监测对人体健康产生的影响。
参考文献:
[1] Dorne J L,Doerge D R,Vandenbroeck M,et al.Recent advances in the risk assessment of melamine and cyanuric acid in animal feed[J].Toxicol Appl Pharmacol,2013,270:218-229.
[2] 梁毅文,于永刚,刘 刚,等.三聚氰胺与三聚氰酸联合灌胃致大鼠泌尿系统损害研究[J].解放军医学杂志,2010,35(4):424-428.
[3] 赵善贞,伊雄海,程 甲,等.基质分散固相萃取-高效液相色谱-串联质谱法快速测定婴幼儿配方乳粉中19种非蛋白氮化合物[J].分析化学,2016,44(8):1227-1235.
[4] 赵蕊池,王培龙,石 雷,等.自组装有序纳米银线表面增强拉曼光谱检测牛奶中三聚氰胺[J].分析化学,2017,45(1):175-182.
[5] 李延昭,郝卫强,王余波,等.应用亲水作用色谱检测鸡蛋和肉中三聚氰胺及三聚氰酸二酰胺[J].色谱,2012,30(7):716-720.
[6] Fan Y,Ma X,Li Z,et al.Fast derivatization followed by gas chromatography-mass spectrometry for simultaneous detection of melamine,ammeline,ammelide,and cyanuric acid in fish and shrimp[J].Food Anal Method,2016,9(1):16-22.
[7] 赵善贞,邓晓军,伊雄海,等.固相萃取-亲水相互作用色谱/串联质谱法同时测定食品中三聚氰胺和三聚氰酸[J].色谱,2012,30(7):677-683.
[8] 郝成婷,周志荣,徐 炎,等.高效液相色谱法同时测定食品接触材料水性模拟物中三聚氰胺和苯代三聚氰胺[J].食品工业科技,2014,35(8):54-57.
[9] Fry H,Mietle K,Mähnert E,et al.Interlaboratory validation of an LC-MS/MS method for the determination of melamine and cyanuric acid in animal feed [J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2017,18:1-13.
[10] 何 君,高 虹,李 岩,等.HPLC-MS /MS同时检测大鼠体内三聚氰胺和三聚氰酸含量[J].中国食品卫生杂志,2012,24(4):322-329.
[11] 刘红河,毛丽莎,康 莉,等.固相萃取-亲水作用液相色谱-串联质谱法同时测定水和尿中三聚氰胺及三聚氰酸[J].中华预防医学杂志,2013,47(7):641-647.
[12] 李玉玉,韩虹琳,吕瑞芬,等.高效液相色谱法同时测定三聚氰胺、三聚氰酸、尿酸[J].现代仪器,2010,16(4):31-32,41.
[13] 徐 玲.液相色谱-电喷雾串联质谱法测定人尿中三聚氰胺和三聚氰酸[J].中国卫生检验杂志,2013,23(12):2576-2579,2622.
[14] 赵燕燕, 刘丽艳, 韩媛媛, 等. 高效液相色谱-荧光检测法同时测定大鼠不同脑区中的8种单胺类神经递质[J].色谱, 2011, 29(2):146-151.

