斯氏副柔线虫半胱氨酸蛋白酶Pj-CPR基因的克隆及原核表达
王文龙,冯陈晨,王金玲,呼和巴特尔,刘春霞
(1.内蒙古农业大学兽医学院/农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018;2.内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018)
斯氏副柔线虫病是由斯氏副柔线虫(Parabronemaskrjabini)寄生于骆驼、牛、羊等反刍动物真胃引起的一种寄生虫病,尤以骆驼感染较为严重[1-3]。大量虫体寄生可导致患畜真胃发生炎症、出血及溃疡,严重者造成骆驼死亡,对养驼业危害极大,是危害我国养驼业的一种主要寄生虫病,给农牧民带来了巨大的经济损失。因此,对斯氏副柔线虫病的监测和诊断是骆驼寄生虫病防控中的重点。
由于骆驼多分布在第三世界国家的落后地区,所以时至今日,国内外关于斯氏副柔线虫病的研究相对滞后,主要是关于分类和传播媒介的研究[4-6]。在骆驼斯氏副柔线虫病的防控上,目前存在的主要问题是缺少针对该病的系统的基础理论研究、缺乏有效的生前诊断方法和防治的新方法。适用于许多寄生性线虫的粪便虫卵检查法可用于该病的诊断,但检出率非常低,很难用于临床实践。该病的诊断主要依靠死后剖检(在真胃查找虫体),此类诊断方法不能为早期治疗提供参考。在实际生产中,往往是在没有诊断依据的情况下盲目地给药驱虫,造成经济损失的同时也带来了诸如毒副作用、出现耐药虫株及畜产品兽药残留超标等诸多弊端。
因此,本研究在斯氏副柔线虫转录组测序分析的基础上[7],筛选出了半胱氨酸蛋白酶Pj-CPR基因作为候选抗原基因,对其进行功能注释,生物信息学分析,并对该基因进行了克隆、原核表达和抗原性验证。研究结果可为该病的血清学诊断方法和免疫防控研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 虫体、血清、质粒与菌株 斯氏副柔线虫采自内蒙古巴彦淖尔市乌拉特后旗骆驼体内,液氮中保存;斯氏副柔线虫病骆驼阳性血清、阴性血清均采自内蒙古巴彦淖尔市乌拉特后旗;pMD19-T simple vector,Takara公司产品;表达载体pET30a(+),Invitrogen公司产品;大肠埃希菌DH5α、BL21(DE3),北京全式金生物技术有限公司产品。
1.1.2 主要的酶和试剂 总RNA提取试剂RNAiso Plus、Primer ScriptTM RT reagent Kit、DNA A-Tailing Kit,宝生物工程(大连)有限公司产品;质粒小提试剂盒,DNA凝胶回收试剂盒,AXYGEN公司产品;BCA Protein assay kit、Ni-NTA SefinoseTMResin Kit、限制性内切酶EcoRⅠ、XhoⅠ、Prime STAR®GXL DNA Polymerase、DNA T4连接酶,上海生工生物工程技术服务有限公司产品;化学发光(ECL)底物显影液,Thermo Scientific公司产品;辣根过氧化物酶标记的兔抗骆驼IgG,由上海生工生物工程技术服务有限公司制备。
1.2 方法
1.2.1 Pj-CPR基因生物信息学分析 利用生物信息学软件对斯氏副柔线虫转录组测序得到的Pj-CPR基因进行生物信息学分析。用ExPASy(http://web.expasy.org/translate/)和ORFfinder(https://www.ncbi.nlm.nih.gov/orf finder/)软件预测开放阅读框,SignalIP4.1 server(https://www.ncbi.nlm.nih.gov/ orffinder/)在线软件进行信号肽序列预测;SecretomeP.2.0 server(http://www.cbs.dtu.dk/ services/Secret omeP/)软件进行非典型蛋白分泌物预测;TMHMM server.v.2.0(http://www.cbs.dtu.dk/services /TMHMM/)软件进行跨膜蛋白结构域分析;TargetP 1.1 server(http://www.cbs.dtu.dk/services /TargetP/)软件预测真核生物蛋白亚细胞定位;BepiPred 1.0 Server(http://www.cbs.dtu.dk/ services/BepiPred/)软件进行抗原表位预测。
1.2.2 Pj-CPR基因的扩增及克隆测序 根据斯氏副柔线虫转录组测序中半胱氨酸蛋白酶Pj-CPR基因序列设计1对引物并分别在上游引物和下游引物中引入EcoRⅠ、XhoⅠ酶切位点。上游引物:5′-CGGAATTCATGAAACGTTCCCTCCTC-3′,下游引物:5′-CCGCTCGAGTTCATATGTTTCTTCACC-3′,引物由华大基因有限公司合成。
参照RNAiso Plus说明书提取斯氏副柔线虫总 RNA,利用反转录试剂盒(Primer ScriptTMRT reagent Kit)合成cDNA,再以RNA反转录产物为模板,PCR扩增目的基因。PCR反应条件为:94℃ 5 min;94℃ 30 s,57℃ 30 s,72℃ 90 s,35个循环;最后72℃ 10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。PCR产物经纯化后,与pMD19-T simple vector连接,连接产物转化大肠埃希菌DH5α,PCR及EcoRⅠ/XhoⅠ质粒双酶切鉴定为阳性的菌株由华大基因公司进行双向测序。
1.2.3 原核表达载体的构建 从测序结果正确的菌株中提取克隆质粒(命名为pMD-CPR),将pMD-CPR和表达载体pET30a(+)分别用EcoRⅠ、XhoⅠ双酶切后,以凝胶回收试剂盒回收目的基因和载体片段,用T4 DNA连接酶连接构建Pj-CPR基因原核表达载体(命名为pETCPR)并转化大肠埃希菌BL21(DE3)感受态细胞。在含卡那霉素的固体LB培养基培养后,挑取单菌落分别进行质粒电泳、PCR和质粒双酶切鉴定,阳性菌株送华大基因公司进行序列测定。
1.2.4 重组菌的诱导表达及诱导条件的优化 重组表达菌BL21(pETCPR)用1.0 mol/L IPTG诱导表达后,经超声波裂解菌体,离心收集超声上清和超声沉淀,SDS-PAGE检测重组蛋白的表达形式。
采用不同诱导剂浓度、不同时间及不同温度诱导重组表达菌,SDS-PAGE电泳分析,确定最佳诱导条件。Pj-CPR基因重组表达菌诱导培养后,收集菌体,以溶菌酶和超声波法裂解菌体,离心收集包涵体沉淀,用8 mol/L尿素溶解,再离心收集上清液,以0.45 μm孔径滤器过滤后,按照上海生工Ni-NTA SefinoseTMResin Kit步骤纯化重组蛋白。
1.2.5 重组蛋白的Western blot检测 重组蛋白经SDS-PAGE分离后,转移至硝酸纤维素膜上。用含50 g/L脱脂奶粉的封闭液于室温封闭3 h;以骆驼斯氏副柔线虫病阳性血清(1∶1 000)为一抗,同时设阴性血清对照;以辣根过氧化物酶标记的兔抗骆驼IgG为二抗(1∶5 000),用ECL超敏显影液显色进行Western blot检测。
2 结果
2.1 Pj-CPR基因生物信息学分析
通过ExPASy和ORFfinder在线软件对Pj-CPR基因进行特征性分析,结果显示,Pj-CPR基因核酸序列长度为291 bp,蛋白分子质量为11.93 ku,含有一个编码97个氨基酸的完整ORF,其中有强酸氨基酸14个,强碱氨基酸14个,疏水氨基酸26个和极性氨基酸34个,等电点为7.304。
用SignalP和SecretomeP软件对基因编码蛋白的信号肽序列进行预测和非典型分泌蛋白分析,结果Pj-CPR存在信号肽序列,且SecretomeP软件预测中NN-Score=0.860,属于分泌蛋白(图1)。用BepiPred软件预测基因编码蛋白抗原表位,结果表明,Pj-CPR蛋白存在5个抗原表位,分别为STGNTNELE(aa 20-28)、LG(aa 39-40)、EQLR(aa 42-45)、QYSKPDADANL(aa 57-67)、ERYKRGEETYE(aa 87-97),表明Pj-CPR编码的分泌性蛋白具有较好抗原性。
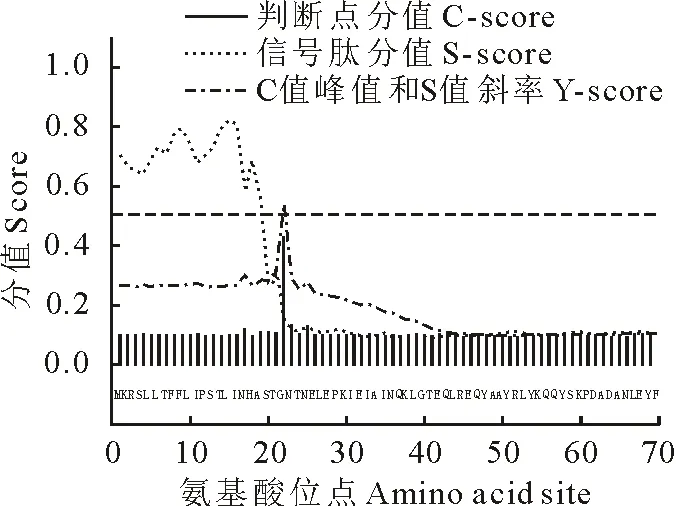
图1 Pj-CPR基因信号肽序列分析Fig.1 The analysis of signal peptide sequence of Pj-CPR gene
用TMHMM和TargetP软件对基因进行蛋白跨膜区预测和蛋白亚细胞定位分析,并分析跨膜蛋白中氨基酸在胞外区、跨膜区和胞内区的数量。结果显示,Pj-CPR不是跨膜蛋白,且整个蛋白均位于胞外(图2);在TargetP软件预测中由于信号肽的存在,该蛋白也被定位到分泌途径中。

图2 Pj-CPR蛋白跨膜区分析Fig.2 The analysis of Pj-CPR transmembarne domain
2.2 目的基因的克隆及重组表达质粒的鉴定
以斯氏副柔线虫RNA反转录产物为模板,采用特异性引物对Pj-CPR基因进行扩增,经琼脂糖凝胶电泳检测,结果表明,获得了约291 bp的特异性条带,与预期大小相符(图3)。经PCR鉴定为阳性的重组表达菌,提取质粒经EcoRⅠ、XhoⅠ双酶切,得到了约291 bp的片段,表明Pj-CPR基因已插入到表达载体pET30a(+)上(图4)。

M.DNA标准DL 2000;1、2.Pj-CPR基因;3.阴性对照
M.DNA Marker DL 2 000; 1,2.RT-PCR products of Pj-CPR gene; 3.Negative control
图3 Pj-CPR基因RT-PCR产物电泳
Fig.3 Electrophoresis of RT-PCR products of Pj-CPR gene

M.DNA标准DL 2 000;1~3.pETCPR载体 M.DNA Marker DL 2 000;1-3.pETCPR vector图4 表达载体pETCPR酶切鉴定结果Fig.4 Enzyme digestion results of pETCPR
2.3 序列分析
将斯氏副柔线虫Pj-CPR基因克隆载体和表达载体测序结果同转录组测序基因序列进行比较。结果表明,Pj-CPR基因序列与转录组测序的序列完全一致,说明成功构建了该基因的原核表达载体。
2.4 重组菌诱导表达
重组表达菌BL21(pETCPR)经IPTG诱导表达后,SDS-PAGE电泳检测,与BL21(DE3)空菌和空载体转化菌BL21(pET30)相比,出现了特异性目的基因融合蛋白表达带,与预期结果一致(图5)。分析其超声上清和超声沉淀,目的蛋白绝大部分在沉淀中,表明目的蛋白主要是以包涵体的形式表达(图6)。
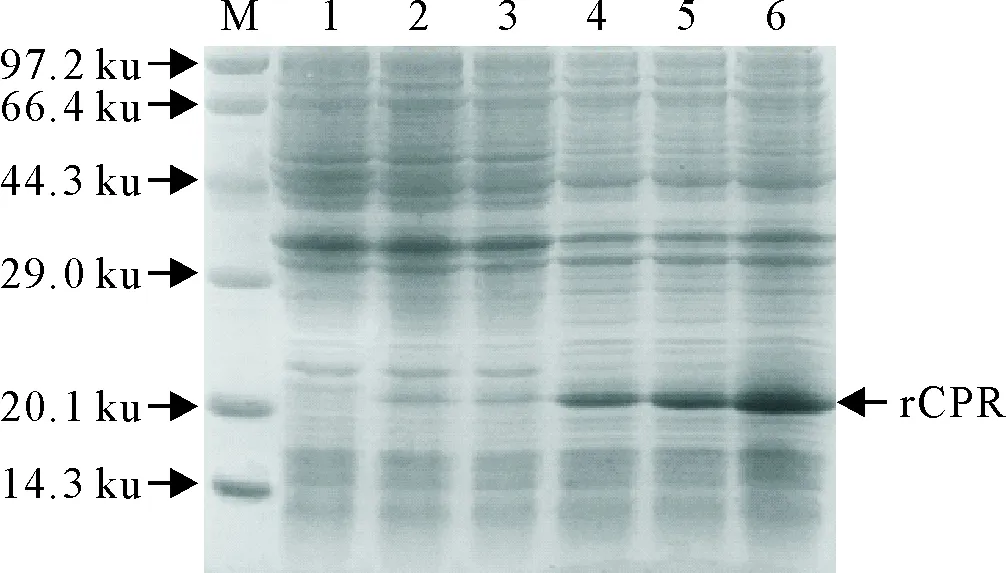
M.蛋白分子质量标准; 1.BL21(DE3)空菌; 2.BL21(pET30)诱导前; 3.BL21(pET30)诱导后; 4~6.BL21(pETCPR)在25℃、30℃和37℃下诱导表达
M.Protein molecular weight Marker; 1.BL21(DE3);2.Before induced BL21(pET30);3.After induced BL21(pET30);4-6.BL21(pETCPR) induced at 25℃,30℃ and 37℃ respectively
图5重组菌诱导表达电泳结果
Fig.5 Electrophoresis of expression products of recombinant bacteria
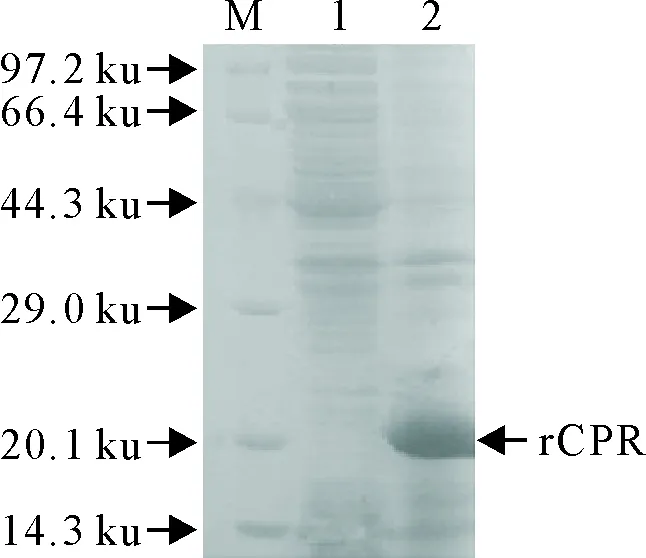
M.蛋白分子质量标准;1. BL21(pETCPR)裂解上清; 2. BL21(pETCPR)裂解沉淀
M.Protein molecular weight Marker; 1.Supernatant of the lysate of BL21(pETCPR);2.Pellets of the lysate of BL21(pETCPR)
图6 rCPR表达形式的电泳结果
Fig.6 SDS-PAGE analysis of rCPR expression inE.coli
2.5 重组蛋白Western blot分析
重组Pj-CPR蛋白(简称rCPR)Western blot结果表明,重组蛋白rCPR与阳性血清在17.6 ku处出现了特异性显色带,阴性血清对照在相应位置无显色条带(图7)。说明rCPR能够与斯氏副柔线虫感染骆驼血清中的IgG特异性结合,具有较好的免疫活性。

M.蛋白分子质量标准;1、2.阳性血清;3.阴性血清
M.Protein molecular weight Marker;1,2.Positive serum;3.Negative serum
图7 rCPR Western blot检测结果
Fig.7 Western blot analysis of the rCPR
3 讨论
高通量测序分析技术是近年来发展起来的一种高效的研究手段,促进了生物学研究领域的快速发展[8]。在寄生虫的研究上,也得到了广泛的应用[9-10],寄生虫的一些分泌性蛋白同源物,如氨肽酶类、蛋白酶类及毒性分泌物等,被认为是与寄生虫免疫相关的抗原蛋白,具有免疫原性,在寄生虫免疫调节、免疫逃避及寄生虫与宿主互作中起关键作用[11-14]。这些功能性抗原可以为筛选疫苗抗原、发掘药物靶点及确定诊断抗原提供依据[15-16]。目前,国内外未见关于斯氏副柔线虫病免疫学诊断和免疫防控的研究报道。本研究所选的半胱氨酸蛋白酶Pj-CPR基因是在斯氏副柔线虫转录组和蛋白质组学分析的基础上,结合其他相关线虫的免疫学候选基因研究,筛选出的一种免疫候选基因[17]。生物信息学分析表明,斯氏副柔线虫Pj-CPR基因编码产物注释功能为半胱氨酸蛋白酶,是一种具有信号肽序列的分泌蛋白。蛋白跨膜区预测和蛋白亚细胞定位分析表明,该蛋白属非跨膜蛋白,主要位于胞外;抗原表位预测有5个抗原表位,具有较好的抗原性。通过生物信息学分析,斯氏副柔线虫Pj-CPR基因符合寄生虫免疫学诊断和免疫防控候选基因的特点。
本研究从斯氏副柔线虫中克隆了Pj-CPR基因并构建了该基因的原核表达载体,测序结果表明克隆的基因与转录组测序结果一致,成功构建了该基因的原核表达载体。原核表达载体转入大肠埃希菌BL21(DE3)后,以IPTG进行诱导表达,SDS-PAGE电泳结果表明,与BL21(DE3)空菌和含有pET30a(+)空载体的BL21(pET30a)相比,获得了预期大小的重组蛋白表达。Western blot结果证实了重组Pj-CPR蛋白能够与感染斯氏副柔线虫的骆驼血清中的抗体特异性结合,而与未感染斯氏副柔线虫的骆驼血清不发生反应,说明所获得的重组蛋白为斯氏副柔线虫Pj-CPR基因重组蛋白,该基因编码产物,在自然感过程中能够刺激宿主产生特异性抗体。由于该基因在GenBank中与常见反刍动物寄生虫基因比较为该病原特有基因,是一种具有重要生物功能的蛋白酶,所以该基因可以作为斯氏副柔线虫的免疫学诊断和防控的候选基因。研究结果可为家畜,特别是骆驼斯氏副柔线虫相关研究奠定基础。
参考文献:
[1] 杨莲茹,杨晓野,刘珍莲,等.内蒙古地区骆驼斯氏副柔线虫(Parabronemaskrjabini)病调查[J].内蒙古农业大学学报:自然科学版,2004,25(1):43-45.
[2] Seyed S H.Molecular characterization of the first internal transcribed spacer of rDNA ofParabronemaskrjabinifor the first time in sheep[J].Ann Parasitol,2015,61(4):241-246.
[3] Hasheminasab S S,Jalousian F,Meshgi B.Molecular and morphological characterization ofParabronemaskrjabiniof sheep and goats at three different geographical zones in Iran[J].Ann Parasitol,2016,62(1):55-61.
[4] Hasheminasab S S. 5.8 S rRNA sequence and secondary structure inParabronemaskrjabiniand related habronematidae species[J].Iran J Parasitol,2016,11(2):253-258.
[5] 陈林军,史红蕾,杨莲茹,等.角蝇各龄期幼虫体内斯氏副柔线虫的分子生物学鉴定[J].中国兽医杂志,2016,52(2):15-21.
[6] 邓 侨,杨莲茹,杨晓野,等.骆驼斯氏副柔线虫病传播媒介西方角蝇和截脉角蝇的幼虫龄期划分[J].昆虫学报,2015,58(3):341-350.
[7] 冯陈晨,王文龙,呼和巴特尔.骆驼斯氏副柔线虫转录组的高通量测序及分析[J].中国兽医学报,2017,37(4):671-675.
[8] Blazie S M,Babb C,Wilky H,et al.Comparative RNA-Seq analysis reveals pervasive tissue-specific alternative polyadenylation inCaenorhabditiselegansintestine and muscles[J].BMC Biol,2015,13:4.doi: 10.1186/s12915-015-0116-6.
[9] Liu G H,Xu M J,Chang Q C,et al.De novo transcriptomic analysis of the female and male adults of the blood flukeSchistosomaturkestanicum[J].Parasites & Vectors,2016,9:143.
[10] 巨 艳,李子华,王娅娜,等.细粒棘球绦虫原头蚴mRNA测序及表达谱分析[J].中国人兽共患病学报,2015,31(1):21-25.
[11] 曹晓丹.日本血吸虫排泄分泌蛋白的研究[D].北京:中国农业科学院,2016.
[12] Tritten L,Clarke D,Timmins S,et al.Dirofilariaimmitisexhibits sex-and stage-specific differences in excretory/secretory miRNA and protein profiles[J].Vet Parasitol,2016,232:1-7.
[13] Eberle R,Brattig N W,Trusch M,et al.Isolation,identification and functional profile of excretory-secretory peptides fromOnchocercaochengi[J].Acta Trop,2015,142:156-66.
[14] Djafsia B,Ndjonka D,Dikti J V,et al.Immune recognition of excretory and secretory products of the filarial nematodeOnchocercaochengiin cattle and human sera[J].J Helminthol,2015,11:1-9.
[15] Cao X,Fu Z,Zhang M,et al.iTRAQ-based comparative proteomic analysis of excretory-secretory proteins of schistosomula and adult worms ofSchistosomajaponicum[J].J Proteomics,2016,138:30-39.
[16] Cao X,Fu Z,Zhang M,et al.Excretory/secretory proteome of 14-day schistosomula,Schistosomajaponicum[J].J Proteomics,2016,130:221-230.
[17] 李孝军.捻转血矛线虫分泌排泄抗原基因的研究[D].浙江杭州:浙江大学,2005.

