我国部分地区奶牛乳房炎主要病原菌的分离鉴定及药敏试验
杜 琳,王丽芳,冯小慧,张三粉,宋 洁,姚一萍,史 培,申 捷
(1.内蒙古自治区农牧业科学院,内蒙古呼和浩特 010010;2.内蒙古自治区疫病预防控制中心,内蒙古呼和浩特 010010)
全球范围内,奶牛乳房炎是影响奶业发展的重要因素之一。每年因乳房炎造成的经济损失巨大,每年全球因奶牛乳房炎损失将近350亿美元[1],其中美国损失20亿美元[2],英国损失3亿英镑[3],荷兰每头牛因患乳房炎损失114欧元[4],我国每年损失150亿元~450亿元[5]。目前治疗奶牛乳房炎主要依赖于抗生素的使用,从而导致药物残留等问题[6],威胁着我国的食品安全。奶牛乳房炎及其致病菌对奶牛的高感染率和强耐药性,已经严重制约奶业的健康发展,而且由于其流行范围广、感染部位多、多重耐药性等也给临床防治带来巨大的困难[7]。我国奶业在奶牛乳房炎病原菌的防控和兽药残留方面面临的问题尤为严峻。因此,为摸清我国奶牛被病原菌感染情况和耐药情况,急需开展奶牛乳房炎病原菌的耐药性风险评估,其研究成果不仅将为兽医临床用药提供可靠的理论依据,防止滥用抗生素,而且将为控制细菌耐药性的扩散提供帮助。同时通过开展不同地域奶牛感染病原菌情况的了解,掌握各地区不同病原菌的感染率,将为国家政府部门有目的、有计划、有步骤的开展病原菌防控和兽药残留监管提供指导意见[8]。
1 材料与方法
1.1 材料
1.1.1 奶样 对我国生鲜乳主产省区黑龙江、内蒙、山东、河北及上海5个省(市、自治区)共247批次患乳房炎(包括临床乳房炎与隐性乳房炎)病牛乳样。每个省(市、自治区),选择4种规模的牧场奶牛存栏:①500头以下;②500头~ 1 000头;③1 000头~3 000头;④大于3 000头,每个类型10个~15个,其中内蒙古、黑龙江、上海、河北各50份样本,山东47份。采样时弃去前3把乳,无菌取乳样50 mL左右,4℃保存待检。
1.1.2 主要试剂与培养基 绵羊脱纤血琼脂培养基、胰酪胨大豆肉汤培养基(TSB培养基)、甘露醇氯化钠琼脂培养基、伊红美蓝琼脂培养基、麦康凯琼脂培养基,青岛海博生物技术有限公司产品;氟苯尼考、氨曲南、利福平、氧氟沙星、复方新诺明、氯霉素、万古霉素、头孢西丁、青霉素、庆大霉素、四环素、环丙沙星、克林霉素、苯唑西林、妥布霉素、利奈唑胺、美罗培南、奥格门汀、红霉素、氨苄西林、头孢噻呋、阿奇霉素、哌拉西林,由上海星佰生物技术有限公司定制成革兰阳性菌药敏板、革兰阴性菌药敏板。药敏试验药物的选择参考美国临床与实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)和农业部奶产品质量风险评估实验室(北京)提出的药敏试验方案制定的药敏试验标准;2×EasyTaq®PCR Super Mix、细菌基因组DNA小量纯化试剂盒,北京全式金生物技术有限公司产品;DNA标准DL 2 000、Agarose,宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 细菌的分离培养 取1 mL无菌采集的牛奶样本,3 000 r/min离心10 min,去除上层脂肪层,取菌体沉淀,用灭菌棉拭子分别于绵羊脱纤血琼脂培养基、胰酪胨大豆肉汤培养基(TSB 培养基)、甘露醇氯化钠琼脂培养基、伊红美蓝琼脂培养基及麦康凯琼脂培养基上划线培养。37℃培养16 h后观察菌落形态。挑取疑似菌落染色镜检、进行纯培养。并对分离获得的流行菌株编号,对其分离时间、分离地点等信息进行记录归档。
1.2.2 分子生物学鉴定
1.2.2.1 细菌基因组DNA的小量提取 参照全式金提取细菌基因组DNA小量纯化试剂盒说明书进行。
1.2.2.2 16 S rDNA基因的PCR扩增 以提取出的细菌基因组DNA为模板,根据GenBank上的DNA序列设计[9]通用引物,其引物序列为:Bacterial 16s-F:ACGCGTCGACAGAGTTTGATCCTGGCT,Bacterial 16s-R:CGCGGATCCGCTACCTTGTTACGACTT。反应程序为:94℃ 5 min;94℃ 45 s,55℃ 45 s,75℃ 90 s,反应进行30个循环;72℃ 10 min。预期目的条带大小为1 500 bp。
1.2.2.3 PCR产物的基因测序及序列分析 将PCR产物纯化后连接pEasy-T1载体上,转化至Trans-T1感受态细胞中,选取阳性克隆送上海生工生物工程技术服务有限公司进行测序。所测基因序列与GenBank中已有序列进行Blast同源性比对。
1.2.3 药敏试验 对分离出的主要病原菌进行药敏试验,按照CLSI推荐的肉汤稀释法进行,用大肠埃希菌标准菌株(ATCC25922)作为质控菌,根据CLSI(2016)的标准判断其耐药性[10]。
2 结果
2.1 细菌的形态学鉴定结果
对分离到的菌株进行形态学鉴定,金黄色葡萄球菌在高盐甘露醇培养基上显黄色,其外围有一黄色的晕环。链球菌在50 mL/L绵羊脱纤血琼脂平板上呈淡灰白色、隆起、闪光的小菌落。大肠埃希菌在伊红美蓝培养基上菌落中心呈紫黑色,有金属光泽。克雷伯氏菌在麦康凯培养基上呈红色,用接种环挑取,有明显的拉丝现象。
革兰染色并在油镜下进行镜检,金黄色葡萄球菌呈现革兰阳性的球菌,排列成葡萄串状。链球菌呈现革兰阳性球菌,链状排列。大肠埃希菌呈现革兰阴性直杆菌,两端钝圆。克雷伯菌呈现较粗短的革兰阴性杆菌。
2.2 分子生物学鉴定结果
用通用引物对分离株进行细菌16 S rDNA基因扩增,所得产物通过琼脂糖凝胶电泳,均扩增出1 500 bp大小的片段。在NCBI上进行Blast比对。其中大肠埃希菌65株,占 37.14%;金黄色葡萄球菌30株,占17.14%;粪肠球菌21株,占12.00%;克雷伯菌18株,占10.29%;链球菌13株,占7.43%;柠檬酸杆菌12株,占6.86%;腐生葡萄球菌5株,占2.86%;变形杆菌4株,占2.29%;黏质沙雷菌3株,占1.71%;表皮葡萄球菌2株,占1.14%;产色葡萄球菌1株,占0.57%;乡间布丘菌1株,占0.57%。每个省(市、自治区)的细菌分离情况见表1。
2.3 药敏试验结果
2017年上半年共采集黑龙江省、内蒙古自治区、河北省、上海市及山东省5个省(市、自治区)247批次患病乳房炎奶牛乳样,分离出革兰阳性菌72株。对分离的革兰阳性菌进行药敏性试验,以确定其耐药情况。
本年度调研中用于革兰阳性菌耐药性试验的20种药物来自11大类药物,其中β内酰胺类7种、氨基糖苷类2种,四环素类1种,磺胺类1种,喹诺酮类2种,林可酰胺类1种,大环内酯类2种,氯霉素类1种,糖肽类1种,噁唑烷酮类1种,安莎霉素类1种。
革兰阳性菌的药敏试验结果见表2。本次试验分离到的革兰阳性菌大部分具有不同程度的耐药性,并且大多数为多重耐药菌,其中耐单一药物的6株,耐药种类数最多的只有1株,能够耐受11种药物。单种药物药敏结果表明,所分离得到革兰阳性菌对氨曲南的耐药率最高,达到了100%,其次为青霉素(80.56%)、氟苯尼考(56.94%)、红霉素(52.78%)、氧氟沙星(43.06%)、头孢西丁(43.06%)、美罗培南(43.06%)、克林霉素(43.06%)和妥布霉素(40.28%)耐药率均高于40%。耐药率低于10%的为万古霉素(全部敏感)、苯唑西林(全部敏感)、利奈唑胺(全部敏感)、奥格门汀(全部敏感)、复方新诺明(2.78%)、氯霉素(2.78%)、环丙沙星(6.94%)和氨苄西林(9.72%)。

表1 各个地区的细菌分布情况

表2 革兰阳性菌的药敏试验结果
2017年上半年共采集黑龙江省、内蒙古自治区、河北省、北京市、上海市、山东省及四川省等5个省市自治区247批次患病乳房炎奶牛乳样,分离出革兰阴性菌103株。对分离的革兰阴性菌进行药敏性试验,以确定其耐药情况。
本年度调研中用于耐药性试验的15种药物来自7大类药物,其中β内酰胺类7种,氨基糖苷类1种,四环素类1种,磺胺类1种,喹诺酮类2种,氯霉素类2种,大环内酯类1种。
革兰阴性菌的药敏试验结果见表3。本次试验分离到的革兰阴性菌大部分具有不同程度的耐药性,并且大多数为多重耐药菌,其中,耐单一药物的8株(7.77%)。耐药种类数最多的只有2株,能够耐受10种药物。单种药物药敏结果表明,所分离得到革兰阴性菌对氨苄西林的耐药性最高,达到了83.50%,其次为氟苯尼考(44.66%)、四环素(43.69%)耐药率均高于40%。耐药率低于10%的有美罗培南(全部敏感)、头孢西丁(5.83%)和氨曲南(9.71%)。
3 讨论
本试验从黑龙江、内蒙、山东、河北和上海等地区共计247份乳房炎乳样中分离到到细菌 175 株,通过形态学鉴定和分子生物学鉴定。确定最终分离到大肠埃希菌65株,金黄色葡萄球菌30株,粪肠球菌21株,克雷伯菌18株,链球菌13株,柠檬酸杆菌12株,腐生葡萄球菌5株,变形杆菌4株,黏质沙雷菌3株,表皮葡萄球菌2株,产色葡萄球菌1株,乡间布丘菌1株。这说明乳房炎不仅仅是由单一细菌引起的,而是由多种细菌共同感染导致[11]。其中大肠埃希菌、金黄色葡萄球菌、粪肠球菌、克雷伯菌为奶牛乳房炎的主要病原菌。
从每个省(市、自治区)的细菌分离情况来看,细菌分布呈现明显的区域性[12]。其中内蒙古地区大肠埃希菌的分离率明显高于其他4个地区,大肠埃希菌是引起乳房炎最重要的环境致病菌,大肠埃希菌广泛存在于牛群的环境之中。牛舍中的粪便和牛床垫料都存在环境性病原菌,在挤奶、挤奶间歇期及干奶期时乳腺组织均可被感染,由于奶牛不断地与环境中的病原菌接触,加之在内蒙古地区采样前不久,刚刚下过雨,这可能导致了奶牛的牛床和运动场较为泥泞,加重了大肠埃希菌等环境性致病菌的感染[13]。黑龙江地区的金黄色葡萄球菌分离率明显高于其他4个地区,金黄色葡萄球菌则是引起奶牛乳房炎最重要的传染性病原菌,金黄色葡萄球菌对乳腺组织有高度的亲和力,主要损害乳房上皮细胞和腺泡的功能,导致牛奶产量和质量下降[14]。河北地区的病原菌则以粪肠球菌为主,粪肠球菌是哺乳动物的正常菌群的一部分,当奶牛乳头闭锁不全或受损时,粪肠球菌机会性的侵入乳房,引起感染。
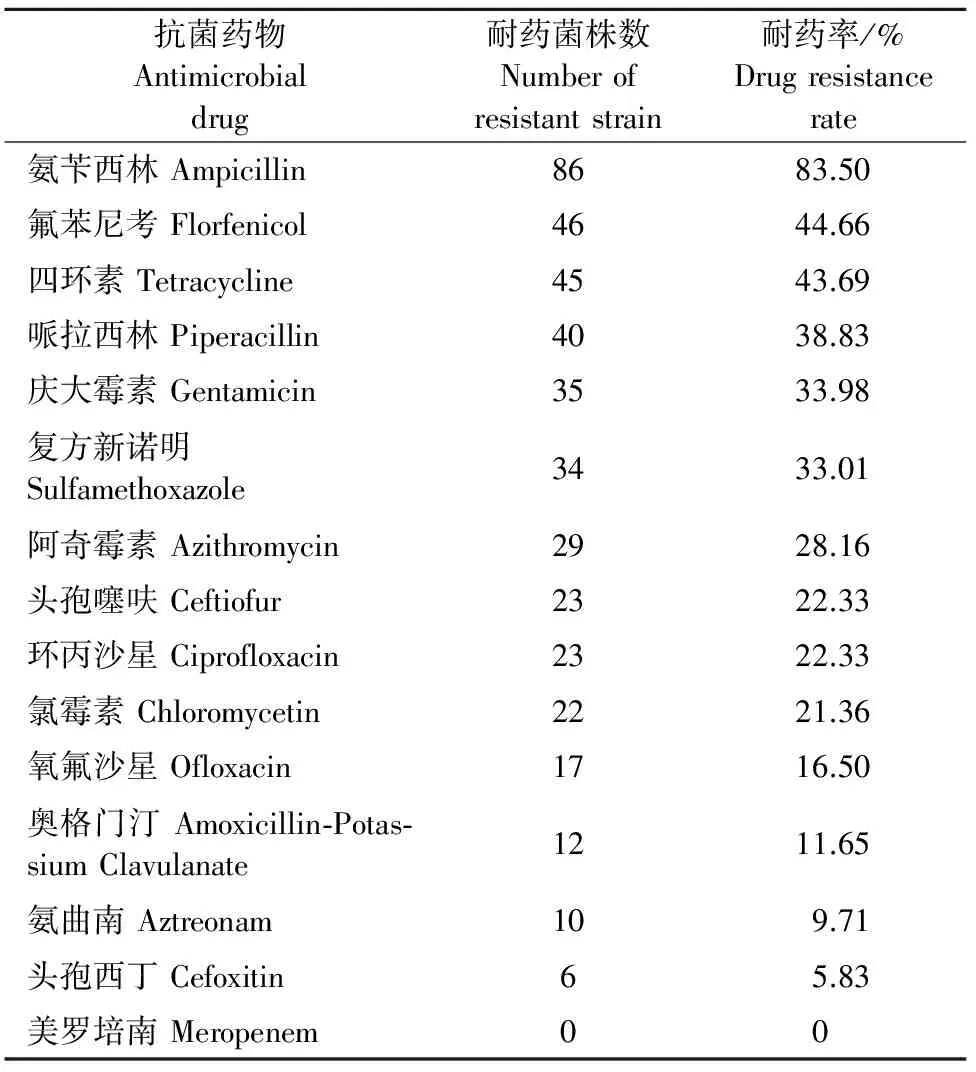
表3 革兰阴性菌的药敏试验结果
本研究通过药物敏感性试验进行分析,结果表明乳房炎病原菌对临床上使用的抗菌药物产生了不同程度的耐药性,尤其革兰阳性菌对氨曲南、青霉素、氟苯尼考、红霉素、氧氟沙星、头孢西丁、美罗培南、克林霉素及妥布霉素耐药。革兰阴性菌对氨苄西林、氟苯尼考及四环素耐药。因此,在使用兽药时应根据各地区流行菌株的耐药特点,选择敏感性高的药物。
目前,细菌的耐药性已得到了国内和国际上的广泛关注[15-16],我国为了加强兽用抗菌药物管理,保障动物源性食品安全和公共卫生安全,我国农业部兽医局在2017年组织起草了《全国遏制动物源细菌耐药行动计划(2017年-2020年)》,对生鲜乳中主要病原微生物的分离鉴定以及耐药性的检测,为兽药残留监控、动物源性细菌耐药监测、监管体系建设与完善提供专业指导,为牧场和奶牛的饲养管理提供更切实有效的用药方案,切实保障养殖业生产安全、动物性食品安全、公共卫生安全和生态环境安全。
参考文献:
[1] Mungube E,Tenhagen B,Regassa F,et al.Reduced milk production in udder quarters with subclinical mastitis and associated economic losses in crossbred dairy cows in Ethiopia[J].Trop Anim Health Pro,2005,37(6): 503-512.
[2] Kayitsinga J,Schewe R L,Contreras G A,et al.Antimicrobial treatment of clinical mastitis in the eastern United States: The influence of dairy farmers' mastitis management and treatment behavior and attitudes.[J].J Dairy Sci,2016,100(2):1388-1407.
[3] Down P M,Bradley A J,Breen J E,et al.A Bayesian micro-simulation to evaluate the cost-effectiveness of interventions for mastitis control during the dry period in UK dairy herd:[J].Prev Vet Med,2016,133:64-72.
[4] Harel D A.IDF : Les chance de guerre s’accroissent sur les fronts libanais et syrien[J].J Dairy Sci,2015,98(4):2369-2380.
[5] 曹立亭.乳酸链球菌素治疗奶牛临床型乳房炎的研究[D].浙江杭州:浙江大学,2009.
[6] Barkema H W,Schukken Y H,Lam T J G M,et al.Incidence of clinical mastitis in dairy herds grouped in three categories by bulk milk somatic cell counts[J].Dairy Sci,1998,81:411-419.
[7] 李新圃,李宏胜,罗金印,等.奶牛乳房炎致病菌的分离鉴定及耐药性研究[J].动物医学进展,2015,36(11):36-39.
[8] 苏 洋,蒲万霞,陈智华,等.牛源金黄色葡萄球菌的耐药性及耐甲氧西林金黄色葡萄球菌的检测[J].中国农业科学,2012,45(17):3602-3607.
[9] Weisburg W G,Barns S M,Pelletier D A,et al.16S ribosomal DNA amplification for phylogenetic study[J].J Bacteriol,1991,173(2):697.
[10] Jorgensen J H.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; approved guideline[M].United States:Clinical and Laboratory Standards Institute,2015.
[11] 韩 笑,刀筱芳,张焕容,等.奶牛隐性乳房炎主要病原菌分离鉴定及耐药性分析[J].动物医学进展,2015,36(7):131-134.
[12] 郝景锋,李静姬,张宇航,等.吉林省奶牛乳房炎病原菌分离鉴定及药敏试验[J].动物医学进展,2016,37(12):126-129.
[13] 赵建荣.奶牛环境性乳腺炎灭活疫苗的研制及效果评价[D].内蒙古呼和浩特:内蒙古农业大学,2009.
[14] 唐吉思,吴金花,布日额,等.牛乳腺炎金黄色葡萄球菌肠毒素A基因的克隆及序列分析[J].中国动物传染病学报,2011,19(3):38-42.
[15] Tian J,Zhang J,Yang J,et al.Conjugated polymers act synergistically with antibiotics to combat bacterial drug resistance[J].Acs Appl Mater Inter,2017,9(22):18512-18520.
[16] 张纯萍,宋 立,吴辰斌,等.我国动物源细菌耐药性监测系统简介[J].中国动物检疫,2017,34(3):34-38.

