猪流产胎儿中猪繁殖与呼吸综合征病毒的检测及GP5抗原分析
蒋增海,赵攀登,邓同炜,陈 益,徐耀辉
(1.河南牧业经济学院动物医学院,河南郑州 450046;2.河南省猪病防控工程技术研究中心,河南郑州 450046)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起猪的一种繁殖障碍和呼吸系统的传染病,其特征为母猪厌食、发热、妊娠后期发生流产,产死胎和木乃伊胎;仔猪发生呼吸系统疾病和大批死亡[1]。其中高致病性猪繁殖与呼吸综合征(HP-PRRS)是由PRRSV变异株引起的一种急性高致死性疫病,感染猪发热、皮肤发红、呼吸困难和急性死亡[2]。童光志等[3]证明了PRRSV变异株是2006年南方猪“高热综合症”流行的主要病因,以NSP2发生30氨基酸的不连续缺失为特征。自从高致病性PRRSV毒株出现,全国各地均有高致病性猪繁殖与呼吸综合征发生的报道[4-7],2016年11月份河南某中小规模化猪场,饲养基础母猪300余头,连续16窝妊娠后期母猪发生产死胎现象,怀疑为猪繁殖与呼吸综合征感染所致流产,通过RT-PCR检测,最终确诊为猪繁殖与呼吸综合征所致。为了分析猪繁殖与呼吸综合征免疫失败原因,进行ORF5基因序列及其推导氨基酸序列的遗传变异分析与比较,以及GP5抗原性分析。
1 材料与方法
1.1 材料
1.1.1 病料 选择2头死产胎儿(分别来自2窝流产母猪所产死胎),编号HeNan-XinY1和HeNan-XinY2,分别采集肺脏,反复冻融3次,用于提取病毒RNA。
1.1.2 主要试剂 RNA提取试剂Trizol,北京鼎国昌盛生物技术有限公司产品;5X All-In-one RT Master Mix,Abm公司产品(Applied Biological Materials Inc,Canada);2×TaqPlus Master Mix(Dye Plus),南京诺唯赞生物科技有限公司产品;DNA Marker DL 2 000等,宝生物工程(大连)有限公司产品。
1.1.3 引物 按照参考文献[8]合成引物,其中一对引物能够扩增ORF5全部基因和部分ORF4、ORF6序列(PRRSV-ORF5F:5-TGGCAATTTGAATGTTCAAGTATG-3,PRRSV-ORF5R:5-CTGTGCTATCATTGCAGAAGTCGT-3);另外一对引物扩增NSP2部分序列(PRRSV-Nsp2-del-F:5-TGGGCGACAATGTCCCTAAC-3); PRRSV-Nsp2-del-R:5-GCTGAGTATTTTGGGCGTGTG-3,扩增产物508 bp(经典毒株)或418 bp(高致病性毒株)。
1.2 方法
1.2.1 病毒RNA提取和反转录 按照RNA提取试剂Trizol说明书提取病毒RNA。反转录按照说明书操作,5×All-In-one RT Master Mix 2 μL,病毒RNA模板3 μL,Nuclease-free H2O 5 μL,总体积为10 μL;混合后,离心数秒;反应条件为25℃ 10 min,50℃ 42 min,85℃ 5 min,然后放冰上冷却,进行下一步试验,或置-20℃保存备用。
1.2.2 PCR反应与产物测序 PCR反应体系为2×TaqPlus Master Mix(Dye Plus)12.5 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,cDNA模板2 μL,灭菌去离子水9.5 μL。PCR反应条件参照参考文献[8]进行:95℃ 5 min;94℃ 30 s,57℃ 30 s,72℃ 1 min,35个循环;72℃ 10 min。取PCR产物5 μL,经10 g/L琼脂糖凝胶电泳检测,用Bio-Rad成像系统观察扩增片段是否与预期大小一致。将ORF5 PCR扩增产物送上海生工生物工程技术服务有限公司测序。
1.2.3 遗传进化分析 利用MEGA5.05和DNA Star软件对获得的ORF5基因序列进行分析。从GenBank下载PRRSV部分毒株ORF5基因序列(表1)做进化分析。
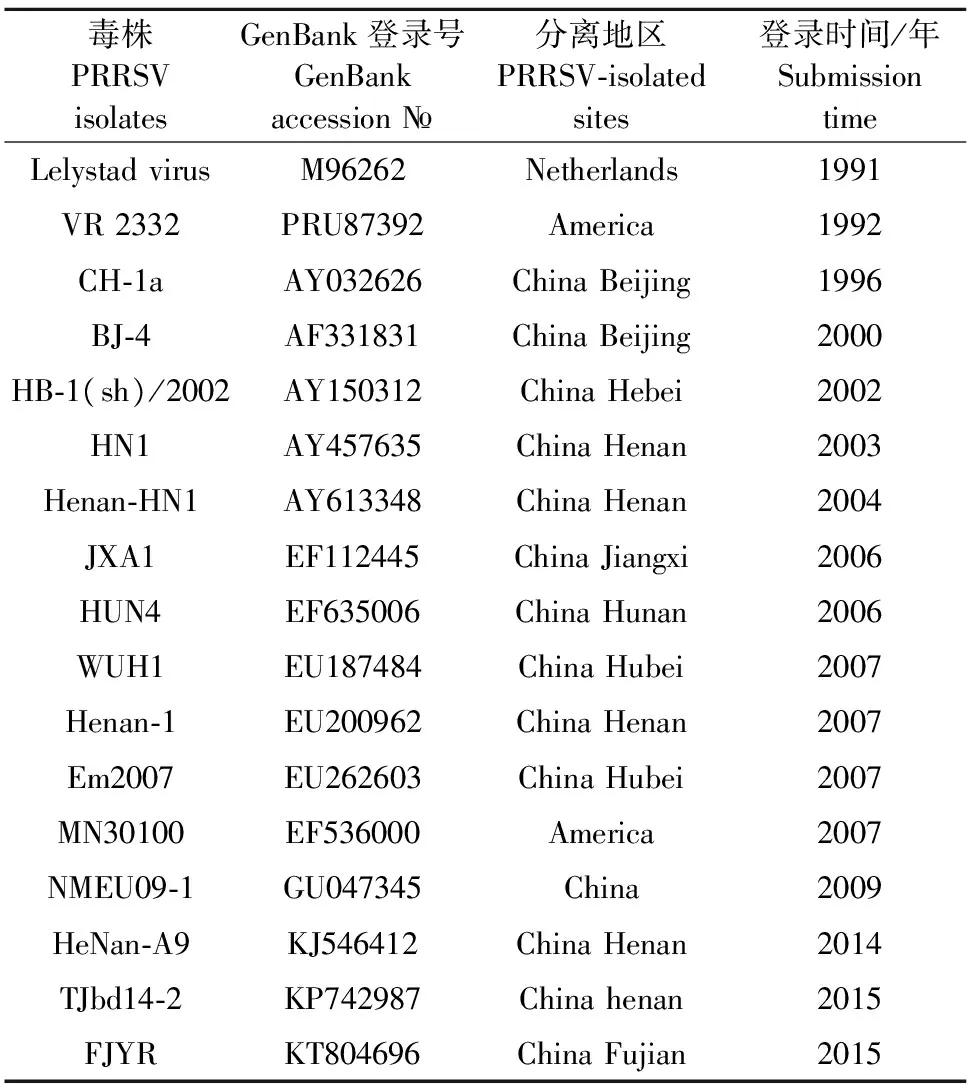
表1 参考毒株信息
1.2.4 GP5蛋白抗原分析 用DNA Star Protean软件对病料检测株GP5蛋白的抗原指数进行预测分析。
2 结果
2.1 PCR扩增结果
从2头胎儿肺脏组织提取核酸,进行RT-PCR扩增,均扩增到PRRSV NSP2大小约418 bp片段,同时也扩增到大小约为700bp包含ORF5基因全长的片段,与预期一致。根据文献[8],判定为高致病性猪繁殖与呼吸综合征病毒感染(图1)。

1.DNA 标准DL 2 000;2、3.HeNan-XinY1、HeNan-XinY2的NSP2基因部分片段;5、6.HeNan-XinY1、HeNan-XinY2的ORF5基因;4、7.阴性对照
1.DNA Marker DL 2 000;2,3.PCR-based amplification targeting part of NSP2 genes from HeNan-XinY1 and HeNan-XinY2 PRRSV strains ;5,6.PCR-based amplification targeting ORF5 genes from HeNan-XinY1 and HeNan-XinY2 PRRSV strains;4,7.Negative control
图1 Nsp2基因部分片段和ORF5基因扩增结果
Fig.1 Results of PCR-based amplification targeting part of NSP2 genes and ORF5 gene from HeNan-XinY1 and HeNan-XinY2 PRRSV strains
2.2 OFR5基因测序
将扩增的包括ORF5全长的基因片段,纯化后进行测序,经过BLAST分析比对,2份病料中检测到ORF5基因序列完全一致,其大小603 bp,与NCBI数据库中PRRSV毒株FJYR ORF5基因同源性最高,为97.0%。
2.3 ORF5序列分析
病料检测毒株的ORF5序列与2015年福建分离毒株FJYR、河南分离毒株TJbd14-2的同源性最高,分别为97.2%和97.0%;与美洲型经典毒株VR-2332、BJ-4、CH-1a的同源性分别为87.7%、86.9%、93.2%,与高致病毒株HuN4、JXA1、WUH1的同源性为96.7%、96.7%、95.7%,与欧洲型毒株Lelystad Virus、NMEU09-1的同源性为62.8%和62.6%(图2和图3)。因此,本研究检测的引起胎儿流产的PRRSV毒株属于美洲型,与近年中国福建和中国河南分离的毒株同源性最高。

HeNan-XinY1、HeNan-XinY2为病料检测毒株,其他毒株信息见表1 HeNan-XinY1 and HeNan-XinY2 PRRSV strains tested in this study,other PRRSV strains included in the table 1图2 PRRSV不同毒株ORF5基因遗传进化树Fig.2 Phylogenetic tree based ORF5 gene sequences of different PRRSV strains

图3 PRRSV不同毒株同源性比较结果Fig.3 Percent identity between different PRRSV strains
2.4 ORF5序列推导氨基酸序列分析
根据DNA Star MegAlign比较,病料检测毒株推导的GP5蛋白氨基酸序列与高致病PRRSV毒株Em2007、HB-1(sh)/2002、JXA1、WUH1、Henan-1、HeNan-A9、HUN4、TJbd14-2、FJYR的同源性为88.6%~95.5%,共13个位点的氨基酸发生了变异:L-S2、F-S23、S-T32、N-H35、D-E54、Q-E58、F-L87、A-V94、Y-C102、V-G124、R-K151、R-K191、Q-R196(图4);与VR-2332毒株的同源性为84.1%;与Lelystad virus毒株的同源性为58.5%。根据参考文献[9],与毒力相关的13位和151位氨基酸,病料检测毒株为R13、R151,与强毒株相同;区分野毒株与疫苗株的137位氨基酸,病料检测毒株为S137,说明导致该猪场母猪流产的毒株是野毒株。
2.5 GP5蛋白抗原分析
应用DNA Star Protean软件对病料检测株GP5蛋白的抗原指数进行预测分析,发现病料检测毒株HeNan-XinY1抗原表位主要分布与其他9种PRRSV强毒株的类似,但存在一定差距,第1-5 aa出现抗原指数高于零,与其他毒株不同,第30-40、51-63 aa抗原指数明显低于其他高致病性毒株(图5)。同时,发现病料检测毒株HeNan-XinY1 GP5在1-5 aa有较好的亲水性及表面可及性(图6和图7),结合该处有较高的抗原指数,根据文献[10]预测,在该处可能出现B细胞抗原表位,而其他毒株在该处无抗原表位。
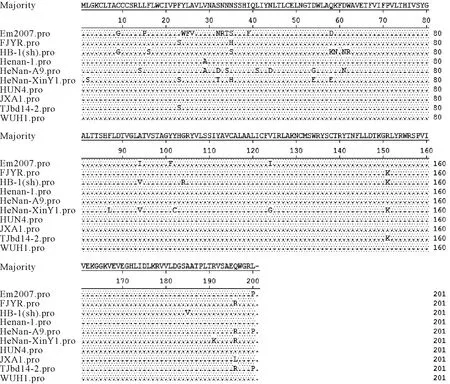
图4 HeNan-XinY1毒株与其他高致病性PRRS毒株ORF5推导氨基酸变异分析Fig.4 Analysis of ORF5 genes-deduced amino acid mutations between HeNan-xinY1 PRRSV strain in this study and other HP-PRRSV strains

图5 HeNan-XinY1毒株与其他高致病性PRRS毒株GP5抗原指数比较Fig.5 Comparison of GP5 antigen indexes between HeNan-XinY1 PRRSV strain in this study and other HP-PRRSV strains
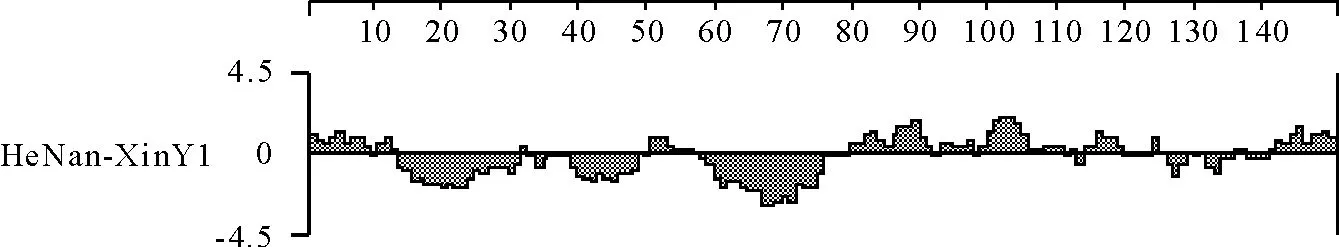
图6 HeNan-XinY1毒株GP5亲水性分布图Fig.6 Hydrophilicity plot about GP5 of PRRSV HeNan-XinY1 strain
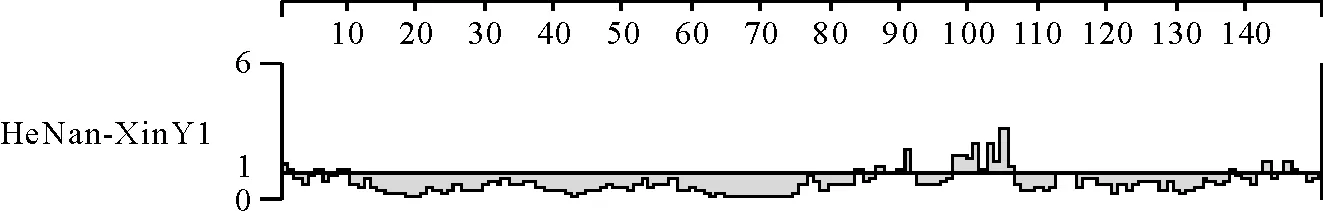
图7 HeNan-XinY1毒株GP5表面可及性分布图Fig.7 Surface probability plot about GP5 of PRRSV HeNan-XinY1 strain
3 讨论
目前,我国已批准上市的疫苗种类繁多,乱用疫苗严重,多种疫苗间或疫苗株与野毒株间容易发生重组与变异[2],当前猪繁殖与呼吸综合征疫苗在保护流行毒株感染方面,完全没效或者部分有效[11-12],估计是导致免疫失败的根本原因。本研究结果发现,病料检测毒株与我国流行的其他9种高致病性PRRSV毒株ORF5推导的氨基酸同源性为88.6%~95.5%,共有13个位点的氨基酸发生了变异,即使进行了猪繁殖与呼吸综合征高致病性弱毒疫苗的免疫,也无法保护怀孕母猪的健康而导致流产,证明了上述观点正确性。
本研究从使用过高致病性猪繁殖与呼吸综合征弱毒疫苗的猪场流产胎儿体内,检测出了PRRSV,根据其ORF5基因序列和推导的氨基酸序列进行了分析和比对,发现病毒发生了较大变异,不属于疫苗毒株,是一种高致病性美洲型的野毒株,与2015福建分离毒株FJYR、河南分离毒株TJbd14-2同源性最高,分别为97.2%和97.0%。据此推断,该PRRSV毒株可能是由中国分离的上述2株高致病性毒株演变而来。
GP5蛋白抗原指数分析发现,与其他9种同源性相近的高致病毒株相比,病料毒株GP5第1-5 aa抗原指数高于零, 并且有较好的亲水性和表面可及性,推测该处出现B细胞抗原表位,与其他毒株不同;第30-40、51-63 aa抗原性明显低于其他高致病性毒株。据此,笔者推测,这是导致本猪场免疫高致病性猪繁殖与呼吸综合征失败的根本原因。
普遍认为,猪繁殖与呼吸综合征弱毒疫苗可以保护猪群,免于PRRSV毒株感染而引起的临床症状,但是目前还没有猪繁殖与呼吸综合征弱毒疫苗能够完全阻止同源性毒株引起呼吸道感染、胎盘传播及猪与猪之间传播;使用猪繁殖与呼吸综合征弱毒疫苗造成毒力返强的例子已经有多次报道;同时,对于野毒株感染,猪繁殖与呼吸综合征弱毒疫苗也不能提供完全交叉保护[12]。本研究结果同样表明,高致病性猪繁殖与呼吸综合征弱毒疫苗免疫接种,也无法抵御高致病性猪繁殖与呼吸综合征变异毒株的感染而致病。
因此,猪场应慎重选用高致病性猪繁殖与呼吸综合征弱毒疫苗免疫接种,田克恭[2]认为对于疫情相对稳定的猪场,一般不推荐使用高致病性猪繁殖与呼吸综合征弱毒疫苗。周磊等[13]认为采用生物安全控制措施、闭群技术、后备母猪驯化、PRRSV 检测与淘汰等措施综合措施,是防控PRRS的明智之举。
参考文献:
[1] 陈溥言.兽医传染病学[M].6版.北京:中国农业出版社,2015:223-224.
[2] 田克恭.高致病性蓝耳病的流行历程及趋势分析[J].今日猪业,2015(2):51-52.
[3] Tong Guangzhi,Zhou Yanjun,Hao Xiaofang,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerg Infect Dis,2007,13(9):1434-1436.
[4] 付向晶,王丹阳,王兴龙,等.1株猪繁殖与呼吸综合征病毒ORF5基因缺失毒株的基因组特征与演化分析[J].畜牧兽医学报,2012,43(11):1773-1779.
[6] 相 群,尹仁福,杨闽楠,等.高致病性猪蓝耳病病毒吉林株的分离鉴定及生物学特性[J].中国兽医学报,2014,34(7):1033-1038.
[5] 丁国杰,张智明,王全杰,等.2株高致病性蓝耳病病毒的分离鉴定及其非结构蛋白Nsp2基因特性分析[J].中国兽药杂志,2015,49(7):17-21.
[7] 周 峰,常洪涛,赵 军,等.2012-2013年猪繁殖与呼吸综合征病毒河南流行株的分离鉴定及分子流行病学调查[J].中国兽医学报,2014,34(9):1398-1404.
[8] Li Bin,Fang Liurong ,Guo Xueliang ,et al.Epidemiology and evolutionary characteristics of the porcine reproductive and respiratory syndrome virus in China between 2006 and 2010[J].J Clin Microbiol,2011 ,49(9):3175-3183.
[9] Allende R,Lewis T L,Lu Z,et al.North American and European porcine reproductive and respiratory syndrome viruses differ in non-structural protein coding regions[J].J Gen Virol,1999,80(2):307-315.
[10] 曹琛福,梁云浩,花群俊,等.非洲猪瘟病毒p54蛋白抗原表位预测及鉴定[J].中国预防兽医学报,2014,36(11):848-851.
[11] Martelli P,Gozio S,Ferrari L,et al.Efficacy of a modified live porcine reproductive and respiratory syndrome virus (PRRSV) vaccine in pigs naturally exposed to a heterologous European (Italian cluster) field strain:clinical protection and cell-mediated immunity[J].Vaccine,2009,27(28):3788-3799.
[12] Kimman T G,Cornelissen L A,Moormann R J,et al .Challenges for porcine reproductive and respiratory syndrome virus (PRRSV) vaccinology[J].Vaccine,2009,27(28):3704-3718.
[13] 周 磊,杨汉春,姜 平,等.猪繁殖与呼吸综合征综合防控技术与应用[J].中国畜牧杂志,2015,51(6):62-67.

