原料米对广东客家黄酒发酵及产γ-氨基丁酸的影响
钱 敏,汤斯斯,赵文红,,*,黄敏欣,许伟萍,李 斌
(1.仲恺农业工程学院轻工食品学院,广东广州 510225;2.华南农业大学,广东广州 510642)
传统广东客家黄酒是一种营养丰富的低度甜型酿造酒。原料米被形象地称为客家黄酒的“酒之肉”[1],对用红曲酿造的黄酒质量有很大影响。已有研究表明,不同原料米为发酵基质对红曲代谢产物中GABA具有显著的影响[2-3]。传统的广东客家黄酒酿造以糯米为原料,但是由于糯米原料价格昂贵,且产量低,已经远远不能满足生产的需要,因此近年来以传统糯米为主要原料酿制的黄酒受到一定的负面影响,生产厂家纷纷寻找成本低、风味淡爽、有丰富营养的原料米。目前,除了名优黄酒采用糯米为酿酒原料外,普通黄酒大部分采用粳米和籼米为原料。但是工厂实践经验不足,理论基础匮乏,因此研究原料米对黄酒营养成分的影响非常重要。
γ-氨基丁酸(GABA)为一种重要的神经介质,促进人脑的新陈代谢,并具有降血压、促进长期记忆、活化肝肾以及防止动脉硬化等功能[4-5]。谢广发等[6]研究表明,黄酒含有较丰富的GABA,且通过黄酒改善大鼠学习与记忆的实验,推测出丰富的GABA是黄酒提高大鼠学习记忆能力的原因所在。广东客家黄酒发酵过程中的基础指标总糖、总酸、pH和氨基酸态氮含量是微生物生长代谢和发酵的重要体现,而酒醪中GABA主要来源于微生物的生长代谢;同时,在GABA的生物合成中,存在于微生物体内的GAD酶起着重要的作用,是生物催化谷氨酸(Glu)合成GABA的唯一关键限速酶[7-8]。因此这些指标可间接说明不同原料米中微生物的生长代谢情况,从而更好地说明不同原料米对客家黄酒产GABA的影响。
本实验从发酵基质原料米入手,考察了糯米、粳米、籼米在相同发酵工艺条件下对黄酒中GABA的影响,为生产优质、高产GABA的客家黄酒提供理论参考。
1 材料与方法
1.1 材料与仪器
红曲、麦曲、酒药 广东省紫金县某酒厂提供;糯米 山西丰园食品有限公司;粳米 吉水县金泰米业有限公司;籼米 南陵县永兴米业有限公司;米酒(29度) 广东石湾酒厂有限公司。
1100系列高效液相色谱仪 美国Agilent科技有限公司;LX-C35L自动电热压力蒸汽灭菌器 合肥华泰医疗设备有限公司;LRH-250A生化培养箱 广东省医疗器械厂;BS223S电子天平 北京赛多利斯仪器系统有限公司;VAL1酒精计 上海一恒科技有限公司;DHS-3C精密pH计 上海雷磁仪器厂;TG16-W高速离心机 湖南湘立科学仪器有限公司等。
1.2 实验方法
1.2.1 广东客家黄酒的酿造工艺流程
1.2.2 不同原料米客家黄酒发酵过程中各项指标的测定 客家黄酒中总糖、总酸、氨基酸态氮测定:按GB/T 13662-2008黄酒国标[10]。
1.2.3 不同原料米客家黄酒发酵过程中GABA含量的测定 a、氨基酸标准曲线:取GABA标准品0.3 g,用流动相定容至100 mL。氨基酸标准品按0.5、1.0、1.5、2.0、2.5 μL的进样量进样;b、样品的测定:分别采用糯米、粳米、籼米酿酒,高效液相色谱检测酒液中GABA含量[11-12]。高效液相色谱检测GABA的条件:采用紫外检测检测器,其检测波长为340 nm;色谱柱为4.6×150 mm,3.5 μm Agilent氨基酸柱,柱温为40 ℃;流动相A(NaH2PO4)=0.02 mol/L(pH为7.8);流动相B(V甲醇MeOH∶V乙腈ACN∶V水H2O)=45∶45∶10。
依次吸取0 μL H2O→5 μL缓冲液→1 μL OPA衍生剂→0 μL H2O→10 μL酒样→0 μL H2O→进样。
表1 高效液相色谱梯度洗脱的程序Table 1 Gradient elution program of high performance liquid chromatography
1.2.4 不同原料米对客家黄酒发酵过程中GAD酶活性的影响 分别用糯米、粳米、籼米酿造黄酒。从主酵第3 d开始,每隔3 d取2.50 g酒醅。向酒醅中加入5 mL的pH5.8 K3PO4缓冲液(缓冲液中磷酸吡哆醛0.2 mmol/L、EDTA 2 mmol/L、2-巯基乙醇2 mmol/L),之后磨成匀浆,再进行离心,取得上清液。量取2 mL上述上清液,添加1%谷氨酸1 mL,在40 ℃水浴条件下进行加热2 h,接着在90 ℃水浴条件下进行加热灭酶5 min[13],再进行冷冻离心,取得上清液,最后过0.45 μm膜,待高效液相色谱测定GABA。每1 h生成1 μmol GABA为一个酶活单位,研究不同原料米对GAD酶活性的影响。
1.3 数据分析与处理
采用SigmaPlot 11.0软件对实验结果进行统计分析,各组实验数据用X±S(平均数±标准偏差)表示。
2 结果与分析
2.1 不同原料米对发酵过程中总糖含量的影响
在发酵过程中,总糖含量是一个重要指标。原料在红曲、麦曲和酒药中多种微生物及酶的作用下进行边糖化边发酵。前发酵主要是淀粉的液化糖化,生成以葡萄糖为主的可发酵性糖,后发酵则主要是酵母菌利用麦芽糖、葡萄糖这些可发酵性糖发酵产酒精,并伴随着一些新物质的合成[14]。客家黄酒属于传统型甜黄酒,按照国标(GB/T 13662-2008),传统型甜黄酒要求总糖(以葡萄糖计)>100 g/L。糯米、粳米、籼米黄酒的总糖含量均达到要求,说明在总糖的理化指标下,糯米、粳米、籼米均适合酿造黄酒。
从图1可看出,在主发酵阶段0~6 d内,糯米、粳米总糖浓度大体均呈下降趋势,籼米稍有波动,后发酵(第6 d加入白酒后)从开始到后期,三者总糖含量先在6~9 d不断下降,第9 d后总体持平,贮藏一个月后,粳米、糯米、籼米的总糖含量分别为297、272、253.2 g/L。然而,无论是前发酵还是后发酵,总糖含量为粳米>糯米>籼米,这说明粳米和糯米易于糖化,产生较多的糖类物质,能为微生物的生长代谢提供较多的营养物质,更适宜酿造黄酒。也说明了在发酵基质粳米和糯米中,微生物有较强的生命活动。同时,发酵过程中,酒体的糖度不同,会影响微生物在期间的发酵情况,糖度高,营养物质较多,微生物生长旺盛,进而将影响微生物的代谢产物。
图1 不同原料米对发酵过程中总糖含量的影响Fig.1 Effects of different rice on content of total sugar during fermentation process
2.2 不同原料米对发酵过程中总酸含量的影响
总酸对酒的品质和酸败十分重要,酸度是实际生产中需要检测的一项指标。黄酒中总酸(以乳酸计)在发酵过程中主要由乳酸杆菌产生,且酵母发酵利用糖来产生酒精的同时,也产生少量有机酸,这都造成总酸的变化。
从图2可以看出,主酵阶段0~6 d,糯米黄酒的总酸含量不断上升,而粳米、籼米几乎不发生变化。后酵阶段(第6 d加入白酒后),在第6~9 d时三者总酸含量急速下降,第6~18 d时三者总算含量均不断上升,第18 d后糯米、粳米的总酸含量继续上升,而籼米则略有所下降,三者在第21 d后含量趋于稳定。原因在于,后酵刚开始时,发酵醪液被加入的白酒稀释,造成总酸含量低;之后一部分产酸菌和酵母快速繁殖,生命活动旺盛,产酸菌产生大量有机酸,酵母则发酵产酒精和少量有机酸,使得总酸不断上升,在第12 d时糯米、粳米、籼米的总酸含量分别达到6.10、4.3、4.9 g/L;当达到一定酸度和酒精度后,再继续发酵时,产酸菌的活性会受到抑制,发酵到后期,总酸含量趋于稳定,后酵的21 d后,总酸含量为糯米>粳米>籼米,贮藏一个月后,糯米、粳米、籼米的总酸含量分别达到7.08、5.6、4.9 g/L。
图2 不同原料米对发酵过程中总酸含量的影响Fig.2 Effects of different rice on content of total acid during fermentation process
按照国标(GB/T 13662-2008),传统型甜黄酒要求总酸(以乳酸计)的范围:4.0~8.0 g/L,在本实验中,糯米、粳米、籼米黄酒整个发酵过程中的总酸含量都符合要求,说明在总酸这个指标,糯米、粳米、籼米都可用来酿造黄酒。然而,在整个发酵过程中糯米黄酒的总酸含量最高,说明黄酒酿造时,糯米作为原料产酸较多,微生物的生长代谢活跃,可使酒的风味更好[15]。同时,发酵基质的不同导致发酵环境的酸碱度不同,这会造成微生物的生长环境不同,直接影响微生物的代谢活动。
2.3 不同原料米对发酵过程中氨基酸态氮含量的影响
氨基酸态氮含量体现客家黄酒发酵过程中氨基酸及小肽总体水平,可用于评判客家黄酒成品的优劣。按照国标(GB/T 13662-2008),传统型甜黄酒氨基酸态氮含量:≥0.40 g/L为优级黄酒,≥0.35 g/L为一级黄酒,≥0.30 g/L为二级黄酒。
3种原料客家黄酒的氨基酸态氮含量总体都呈上升趋势,氨基酸态氮含量为糯米>粳米>籼米。糯米、粳米原料酿出的黄酒在整个发酵过程中的氨基酸态氮含量超过0.40 g/L,为优级黄酒,而籼米黄酒在发酵后期(第6 d加入白酒后)和贮藏后(30 d后)氨基酸态氮含量低于0.40 g/L但≥0.35 g/L,为一级黄酒,说明在氨基酸态氮这个指标,本实验里糯米、粳米、籼米都可用于黄酒的酿造。从实验结果来看,氨基酸态氮含量虽然受原料米中蛋白质含量的影响,但微生物利用原料的情况对其影响更大。糯米、粳米黄酒氨基酸态氮含量较多,与籼米黄酒差异明显,这说明糯米和粳米被各种酶和微生物分解利用的程度高,同时也说明微生物在糯米和粳米的发酵基质中生长代谢旺盛。
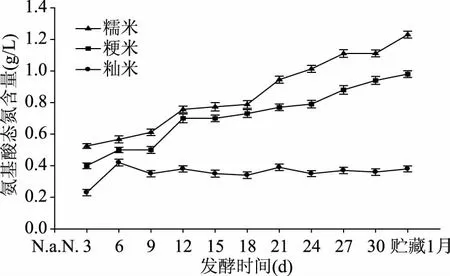
图3 不同原料米对发酵过程中氨基酸态氮含量的影响Fig.3 Effects of different rice on content of amino nitrogen during fermentation process
2.4 不同原料米对发酵过程中GABA含量的影响
2.4.1 氨基酸标准曲线 由图4、图5可知,GABA出峰时间是14.098 min,和其他氨基酸不重叠,说明此方法对定量分析客家黄酒中GABA具有较高准确性,图6可看出此方法可以较好地分开客家黄酒中GABA和其他氨基酸。GABA的标准曲线方程为y=214.5536x+1.5632(y为峰面积,x为响应值),相关系数为0.99972。GABA的峰面积与其进样量在一定范围内呈良好的线性关系,因此能较准确地对客家黄酒中的GABA进行定性定量分析。
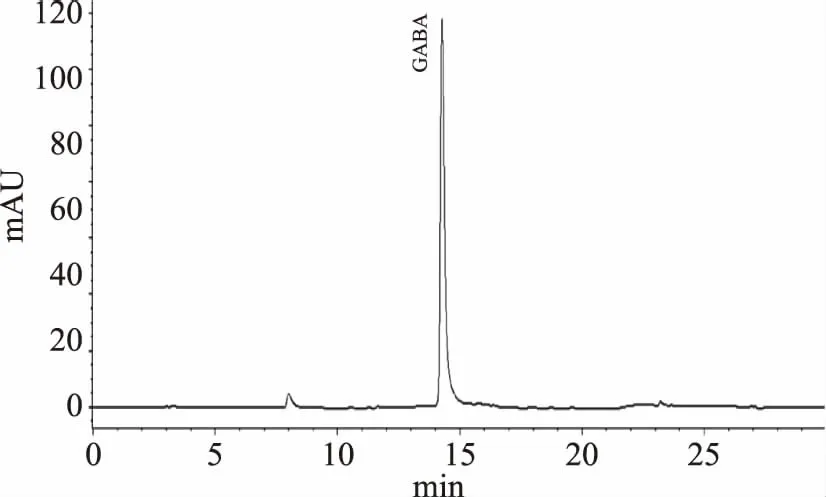
图4 GABA标准品的高效液相色谱图Fig.4 Figure of GABA standard by high performance liquid chromatography
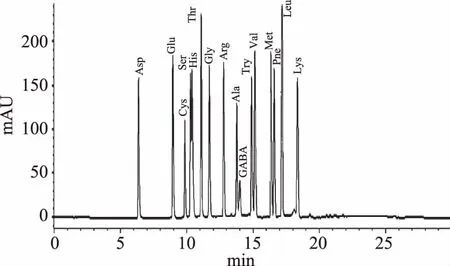
图5 氨基酸标准品的高效液相色谱图Fig.5 Figure of amino acid standard by high performance liquid chromatography
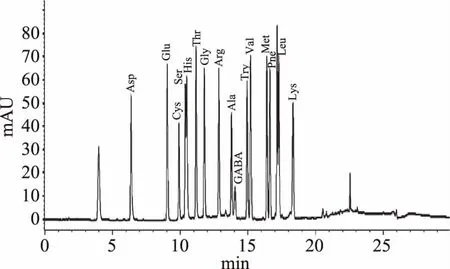
图6 客家黄酒中氨基酸和GABA高效液相色谱图Fig.6 Figure of amino acid and GABA of hakka rice wine by high performance liquid chromatography
2.4.2 样品的测定 由图7可看出,糯米、粳米、籼米在发酵过程中GAGB含量的变化呈波动状态。主酵期间(0~6 d),GAD将Glu脱羧生成GABA,GABA含量呈现上升的趋势。第6 d加入白酒后,白酒稀释了醪液,GABA含量下降;在后酵的9~18 d,随着发酵醪液酒精度的上升,耐酒精的酵母等继续代谢生成GABA,而不耐酒精的部分糖化菌其GABA生成则受到阻碍,同时,发酵的继续进行使得细胞内溶液pH上升,从而导致转氨酶活性上升,致使部分GABA被降解损失,因此GAGB呈现波动状态,变化不明显;到了后酵的第21~30 d,部分微生物死亡,体内部分GABA溶出,导致GABA含量上升。发酵过程中,GABA含量糯米最高,粳米次之,籼米最低,贮藏一个月后,糯米GABA含量达到260.45 mg/L,分别为粳米、籼米的1.13倍、1.44倍。这是因为,原料米是传统使用的固态发酵基质,原料米品种不同,米中蛋白质在蛋白酶的作用下,生成的氨基酸等小分子物质的种类和数量不同,因此GAD可以作用的底物浓度有差异,引起GAD表达的差异,使得产生GABA含量不同。同时,因为原料米的营养成分、米饭的粘性和吸水性不同,米饭硬或者蓬松,这直接影响发酵环境。因此微生物在不同原料米中的发酵情况不同,进而可能影响微生物的生长和代谢产物GABA的生成。还有研究报道指出,GAD的表达会受到其编码基因表达的影响[16]。
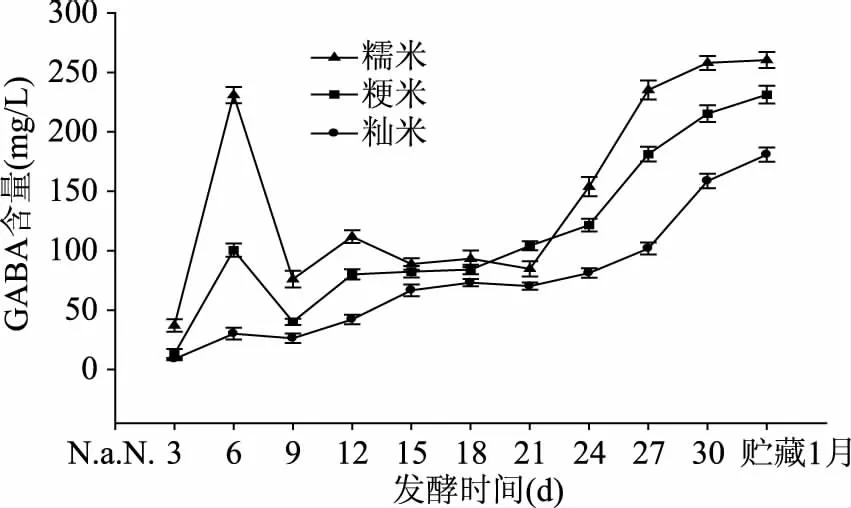
图7 不同原料米对发酵过程中GABA含量的影响Fig.7 Effects of different rice on GABA content during fermentation process
2.5 不同原料米对发酵过程中GAD酶活性的影响
GAD是GABA合成的关键酶,GABA的积累是GAD催化的酶促反应。GAD是一种钙调素结合蛋白,其酶活性直接影响GABA的生成量。
从图8可知,在发酵过程中,不同品种的原料米酿造的客家黄酒GAD酶活性不同。糯米、粳米黄酒的GAD酶活性较大且两者接近,而籼米GAD酶活性较小,与糯米、粳米相差较大,结果与图7 GABA的结果对应。在发酵过程中,GAD酶有差异,可能是因为原料基质不同,导致原料被各种酶分解的情况不同,造成微生物可利用的营养物质有所差异,使得微生物在其中的发酵情况不同,最终导致酒体环境不同,例如pH不同,会导致GAD的酶活性不同。
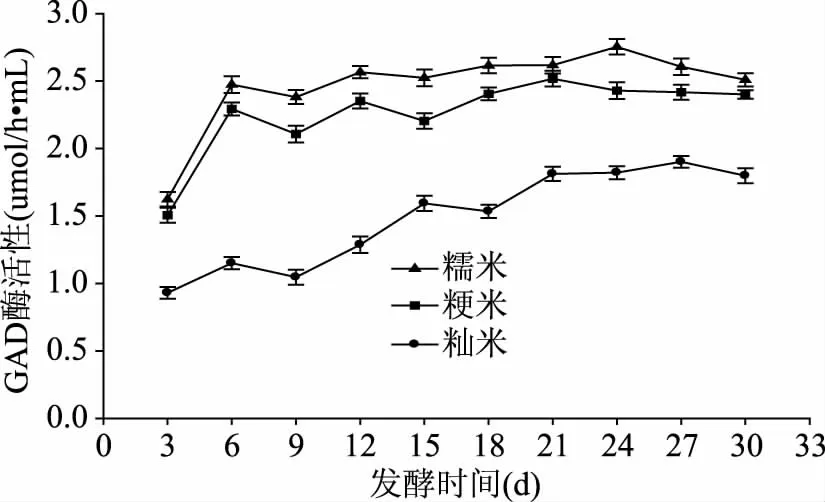
图8 不同原料米对发酵过程中GAD酶活性的影响Fig.8 Effects of different rice on GAD activity during fermentation process
3 结论
在总糖、总酸、氨基酸态氮指标下,糯米、粳米、籼米都适合酿造客家黄酒,但糯米黄酒、粳米黄酒总糖、总酸和氨基酸态氮含量较高,因为在糯米黄酒、粳米黄酒发酵过程中微生物的生命活动较剧烈;发酵过程中,GABA含量糯米黄酒最高,粳米黄酒次之,籼米黄酒最低;贮藏一个月后,糯米黄酒GABA含量达到260.45 mg/L,分别为粳米黄酒、籼米黄酒的1.13、1.44倍。糯米、粳米黄酒的GAD酶活性较大且两者接近,而籼米GAD酶活性较小,与糯米、粳米相差较大。综上所述,对比三种原料米,糯米最有利于客家黄酒的发酵及产GABA,粳米次之,籼米较不利。
原料米对广东客家黄酒产GABA有一定影响,原料米的化学成分、持水特性、比表面积、导热率、硬度、孔隙度及孔隙分布等是否是影响黄酒发酵的重要因素需深入研究。同时,早、中、晚稻对广东客家黄酒产GABA和GAD酶是否差异,仍可做进一步的分析研究。解析原料米的这些性质和发酵产物GABA的关系,为探究发酵基质特性结构对微生物环境以及微生物代谢产生GABA提供理论依据。
[1]陈晓芸. 广东客家娘酒传统酿造工艺研究及主要酒曲微生物的分离和特性[D]. 南昌:南昌大学,2011.
[2]高红,彭月菊,李贞景,等. 八种稻米基质对红曲重要代谢产物的影响[J]. 中国食品添加剂,2015,(4):137-142.
[3]梁恒宇,邓立康,林海龙,等. 新资源食品——γ-氨基丁酸(GABA)的研究进展[J]. 食品研究与开发,2013,34(15):119-123.
[4]Hayakawa K,Kimura M,Kasaha K,et al. Effect of a gamma-aminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J]. British Journal of Nutrition,2004,92(3):411-417.
[5]章清杞,陈健勇,张书标,等. 巨胚稻胚重与糙米粒形的关系[J]. 福建农林大学学报:自然科学版,2006,35(1):1-5.
[6]谢广发,戴军,赵光鳌,等. 黄酒中的γ-氨基丁酸及其功能[J]. 中国酿造,2005,(3):49-50.
[7]康彬彬,陈团伟,陈绍军,等. 高γ-氨基丁酸稻米品种的筛选[J]. 山地农业生物学报,2007,26(6):471-475.
[8]Baeks H,Park S,Lee H G. Hypocholesterolemic action of fermented brown rice supplement in cholesterol-fed rats:Cholesterol-lowering action of fermented brown rice[J]. Journal of Food Science,2005,70(8):527-531.
[9]赵文红,莫依灿,洪泽淳,等. 红曲对广东客家黄酒抗氧化活性的影响[J]. 现代食品科技,2016,32(1):143-150.
[10]方晓弟,白卫东,赵文红,等. 响应面法优化低聚异麦芽糖客家娘酒的发酵工艺[J]. 中国酿造,2013,32(2):41-44.
[11]程威威,周婷,吴跃,等. 高效液相色谱法测定发芽糙米中-氨基丁酸含量[J]. 食品科学,2014,35(12):98-101.
[12]Xing Z Q,Li L X,Qiu X P,et al. Determination ofγ-aminobutyric acid and L-glutamic acid in tea by HPLC[J]. Food and Fermentaion Industries,2009,35(3):147-152.
[13]赵健,李凤华,杨丽,等. 超高效液相色谱-质谱/质谱联用法测定泰山白首乌中γ-氨基丁酸含量及其相关药效分析[J]. 世界科学技术:中医药现代化,2012,(5):2029-2035.
[14]赵玉斌,冷云伟,赵梅,等. 黄酒发酵过程的糖代谢研究[J]. 中国酿造,2010,(10):84-86.
[15]白卫东,赵文红,冯爱军,等. 广东客家娘酒风味物质在发酵过程中的变化研究[J]. 中国食品学报,2013,13(4):241-244.
[16]许辉,廖攀,许明,等. 水稻谷氨酸脱羧酶基因(OsGAD3)分子进化与表达分析[J]. 福建农林大学学报:自然科学版,2011,40(2):156-160.

