乳苣不同溶剂提取物对α-淀粉酶的抑制作用及光谱研究
高义霞,陶超楠,郑 婷,朱玉芳,周向军,*
(1.天水师范学院生物工程与技术学院,甘肃天水 741001;2.甘肃省大樱桃工程技术研究中心,甘肃天水 741001)
α-淀粉酶是一种随机水解α-1,4糖苷键的Ca2+依赖性内切淀粉酶,其催化淀粉转化生成少量葡萄糖和糊精,已广泛用于食品、化工等行业中。目前,国内外有关α-淀粉酶的研究,主要集中在其高产菌筛选和鉴定、基因重组、表达及其抑制剂等方面[1-6]。α-淀粉酶抑制剂是一种糖苷酶抑制剂,可有效抑制消化道内淀粉酶活性,阻止食物糖类的水解和吸收,降低人体血糖含量,抑制脂肪合成,临床上常用于糖尿病、肥胖症、高血糖和高血脂等疾病预防[7-8]。
乳苣(MulgediumtataricumL.),又名蒙山莴苣、紫花山莴苣及苦菜等,为菊科乳苣属药食两用草本植物。乳苣全草可药用,主要化学成分为倍半萜和三萜类化合物[9],具有抗菌、抗癌及消炎等作用[10-12]。山楂叶、白芸豆等活性成分对α-淀粉酶具有一定抑制作用[13-14],但有关乳苣中α-淀粉酶抑制剂的研究还未见报道。研究不同溶剂乳苣提取物对α-淀粉酶的抑制作用、动力学及作用机制等,不仅有助于从不同角度探讨酶结构与功能的关系,且为寻找天然、安全降糖药物提供重要的科学依据。
本实验以乳苣全草为材料,α-淀粉酶为研究对象,研究水、正丁醇、石油醚、氯仿和乙酸乙酯提取物对α-淀粉酶的抑制作用、类型、动力学参数、紫外光谱和表面疏水性等影响,旨在为糖尿病、肥胖症和高血脂等疾病预防提供科学依据。
1 材料与方法
1.1 材料和仪器
乳苣(MulgediumtataricumL.) 甘肃省白银市靖远县农田和水渠边,经鉴定为菊科乳苣属乳苣。乳苣全草,室温风干,粉碎,过80目筛备用;α-淀粉酶(58.7 U/mg)、8-苯胺-1-萘磺酸(>97%纯度) Sigma产品;可溶性淀粉、磷酸氢二钾、氢氧化钠、3,5-二硝基水杨酸、酒石酸钾钠和亚硫酸氢钠 国产分析纯;3,5-二硝基水杨酸(DNS) 甲液:6.9 g结晶苯酚溶于15.2 mL 10% NaOH溶液,蒸馏水稀释至69 mL,再加入6.9 g亚硫酸氢钠;乙液:225 g酒石酸钾钠溶于300 mL 10% NaOH溶液,再加入880 mL 1% 3,5-二硝基水杨酸溶液,混合甲乙溶液,棕色瓶放置一周后使用;0.05 mol/L pH6.8磷酸盐缓冲液:七水合磷酸氢二钠3.35 g,二水合磷酸二氢钠1.95 g,450 mL蒸馏水溶解,调pH6.8,蒸馏水定容至500 mL。
UV1800型紫外可见分光光度计、RF-5301PC型荧光分光光度计 日本岛津;AL204精密分析天平 瑞士梅特勒;电热恒温水浴锅:上海精宏实验设备有限公司;雷磁PHS-3D型pH计 上海精密科学有限公司。
1.2 实验方法
1.2.1α-淀粉酶反应进程曲线制作 采用Bernfeld法[15],稍作修改。取11.4 mL 0.05 mol/L pH6.8磷酸缓冲液于50 mL三角瓶中,加入0.6 mL 0.5 mg/mLα-淀粉酶液,充分混匀,50 ℃水浴20 min。加入3.0 mL 1%可溶性淀粉(预先经50 ℃水浴)作为底物,混匀计时。酶促进程曲线制作:前5 min每隔30 s,后5 min每隔1 min,取0.5 mL酶解液沸水灭活3 min,加入DNS试剂1.0 mL,沸水5 min,加水补至5.0 mL后540 nm测吸光值,制作酶促进程曲线,确定线性时间。
1.2.2 乳苣提取物制备及其对α-淀粉酶的抑制作用 乳苣的水、正丁醇、石油醚、氯仿和乙酸乙酯提取物制备参考高义霞等方法[16]。取0.05 mol/L pH6.8磷酸缓冲液3.8 mL,加入0.5 mg/mLα-淀粉酶0.2 mL,混匀后加入各提取物(水、正丁醇、石油醚、氯仿和乙酸乙酯提取物),使其终浓度分别为0.0、0.5、1.0、2.0、4.0、8.0 mg/mL,充分混匀,50 ℃水浴20 min,加入50 ℃预热的1%可溶性淀粉溶液1.0 mL,1.5 min后沸水灭活,加入DNS试剂1 mL,沸水5 min,室温中冷却后,蒸馏水定补至5.0 mL,520 nm处测吸光值。以0.2 mL磷酸盐缓冲溶液代替酶液,作为空白对照。α-淀粉酶抑制率(%)=(A0-A1)/A0×100。式中:A0为未添加提取物吸光值,A1为添加提取物吸光值。
1.2.3 乳苣提取物对α-淀粉酶的抑制类型和动力学参数 取1%可溶性淀粉1.0 mL,分别测定0.0、0.5、2.0、4.0 mg/mL各提取物(水、正丁醇和石油醚提取物)时,α-淀粉酶活性随其浓度变化趋势,以酶含量为横坐标,吸光值为纵坐标,判断不同提取物对α-淀粉酶的抑制类型。固定α-淀粉酶浓度为0.02 mg/mL,测定可溶性淀粉浓度分别为0.5、1.0、2.0和4.0 mg/mL时,水和石油醚提取物对应的Ki,可溶性淀粉浓度分别为0.5、1.0和2.0 mg/mL时,正丁醇提取物对应的Kis或Ki[17-18]。
1.2.4 乳苣提取物对α-淀粉酶紫外和表面疏水性的影响 固定α-淀粉酶浓度为0.5 mg/mL,测定各提取物(水、正丁醇和石油醚提取物)分别为0.0000、0.0125、0.0250、0.0375和0.0500 mg/mL时,作用10 min后其对α-淀粉酶紫外光谱的影响,同时作对照实验;固定ANS为8.0 mmol/L,α-淀粉酶浓度为0.5 mg/mL,各提取物(水、正丁醇和石油醚提取物)分别为0.00、0.25、0.50和1.00 mg/mL,作用10 min。在激发波长344 nm,400~600 nm扫描,测定其对α-淀粉酶表面疏水性影响,同时作对照实验[19]。
1.3 数据处理
实验重复3次,采用SPSS 16.0中Profit分析方法计算半抑制浓度IC50,利用Origin 7.5作图。
2 结果与讨论
2.1 酶促反应进程曲线
酶活力测定,首先需确定线性反应时间,线性时间应在初速度范围内选择,而初速度对应的时间范围需通过酶促反应进程曲线来选择。进程曲线常以单位时间内产物增加量与反应时间的关系曲线表示。
反应起始阶段,曲线斜率几乎不变,但随时间延长,曲线平缓,速率降低,可能原因是底物浓度降低、产物浓度增加引起的逆反应加强、产物对酶抑制或酶本身部分失活等[20]。酶促反应进程曲线见图1。吸光值随时间延长几乎成线性增加,随后逐渐趋于平缓,产物增加量减慢。1.5 min内线性较好,相关系数达0.99以上,时间延长则线性降低,不利于后续数据拟合。因此,酶活测定时间选择1.5 min。

图1 酶促反应进程曲线Fig.1 Enzymatic reaction curve
2.2 乳苣提取物对α-淀粉酶的抑制作用
由图2可知,在0~8.0 mg/mL范围内,水、正丁醇和石油醚提取物对α-淀粉酶抑制作用均随其浓度增大而增强(p<0.05)。当提取物浓度大于2.0 mg/mL时,水、正丁醇和石油醚提取物抑制率均超过50%,大于8.0 mg/mL时,石油醚提取物抑制率接近100%。在0~2.0 mg/mL范围内,随氯仿提取物浓度增加,其对α-淀粉酶的抑制作用出现波动,在2.0~8.0 mg/mL范围内,氯仿提取物对α-淀粉酶抑制作用逐渐增强(p<0.05);在0~6.0 mg/mL范围内,乙酸乙酯提取物对α-淀粉酶几乎无抑制作用,当大于6.0 mg/mL时,抑制作用急剧增强(p<0.05);利用SPSS 16.0软件中的Profit分析方法,其中,响应频率为抑制率,协变量为抑制剂浓度[21],求得水、正丁醇、石油醚、氯仿和乙酸乙酯提取物对α-淀粉酶IC50分别为2.002、4.086、1.248、4.299和6.904 mg/mL。后续实验选择抑制作用较稳定且较强的水、正丁醇和石油醚提取物。

图2 不同乳苣提取物对α-淀粉酶抑制作用Fig.2 Inhibition effects of Mulgedium tataricum L.extracts on α-amylase
2.3 乳苣提取物对α-淀粉酶的抑制类型和动力学特征
图3、图5和图7中,C为各溶剂提取物浓度。在底物浓度和水/正丁醇提取物浓度不变条件下,体系吸光值随α-淀粉酶含量增加呈线性增加。不同水/正丁醇提取物浓度条件下,各直线几乎相交于原点,且直线斜率随提取物浓度增加而下降,表明水/正丁醇提取物对α-淀粉酶的抑制作用,不是通过降低有效酶量导致活力下降的,而是通过抑制酶活性导致催化效率降低,表现为可逆抑制作用[22];石油醚提取物对α-淀粉酶抑制作用则与此不同,以吸光值对酶含量作图,为一组平行直线,见图7。随石油醚提取物浓度不断增大,直线平行从原点向右移动,说明石油醚提取物在反应初期对酶为不可逆抑制,使酶永久失活,从而减少有效酶量。因此,石油醚提取物与α-淀粉酶间存在一定化学计量数的抑制关系,仅当酶的物质的量大于石油醚提取物时,即有过量酶分子时,才表现出活力。此时,不同抑制剂浓度条件下的反应初速度,随酶量增加表现为与对照组一样,为相互平行的直线[23]。但对照组未通过原点,可能是该体系中存在某些未知α-淀粉酶激活因素或某些激活因素占优。
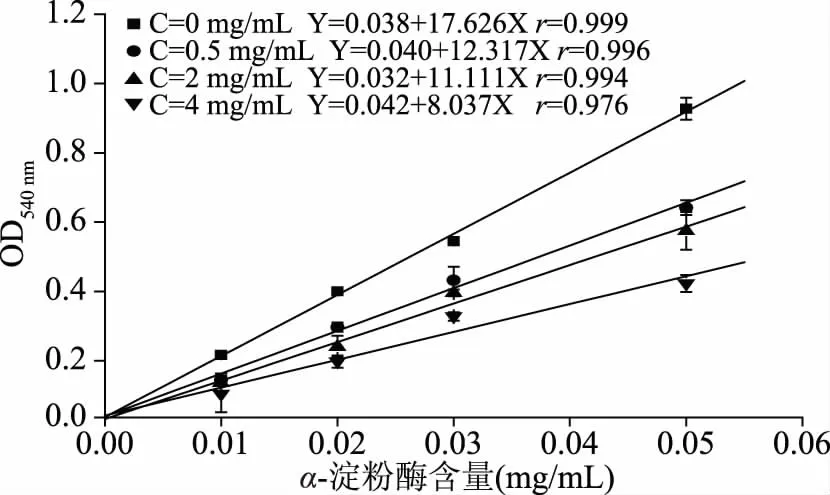
图3 水提取物对α-淀粉酶抑制类型Fig.3 Inhibition type of water extract on-amylase

图5 正丁醇提取物对α-淀粉酶抑制类型Fig.5 Inhibition type of butanol extracts on α-amylase

图7 石油醚提取物对α-淀粉酶抑制类型Fig.7 Inhibition type of petroleum ether extracts on α-amylase
图4中,以1/V对1/S作图,V为反应速度,S为底物浓度。双倒数作图得到一组横轴截距不变的直线,水提取物不影响米氏常数(Km),只影响最大反应速度(Vmax),抑制类型为非竞争性抑制。这表明水提取物与α-淀粉酶活性中心外必需基团结合,且这种结合并不影响酶与底物结合,同时,底物与酶的结合,也不影响酶与水提取物的结合,两者相互独立。但由于酶-底物-水提取物不能进一步形成产物,所以不能通过增加底物浓度来降低其对酶的抑制程度[24]。以双倒数作图各斜率对水提取物浓度作图,求得Ki为1.653 mg/mL。
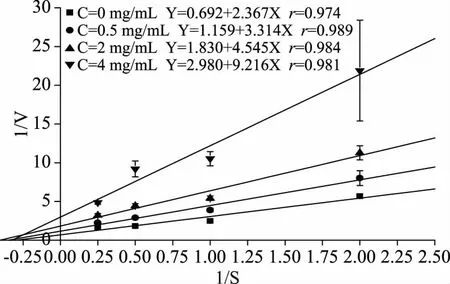
图4 水提物的1/V-1/S曲线Fig.4 1/V-1/S curve of water extraction
由图6可知,双倒数作图得到一组斜率不同,并交于第三象限的直线,抑制类型为线性混合抑制类型,即兼具反竞争性和非竞争性抑制。线性混合抑制作用类似于非竞争性抑制作用,酶可首先与底物或抑制剂结合,酶与底物结合不影响其与抑制剂进一步结合,反之,酶与抑制剂结合也不影响其与底物进一步结合。但线性混合型抑制中,酶与底物或抑制剂结合次序不同,则具有不同的反应常数[25]。以双倒数作图各斜率和截距分别对正丁醇提取物浓度作图,求得Ki和Kis分别为0.795和0.435 mg/mL,前者约为后者1.828倍,表明正丁醇提取物与酶-底物络合物的亲和力强于其与游离酶亲和力[26]。当底物浓度和正丁醇提取物均为4.0 mg/mL时,α-淀粉酶活性几乎被完全抑制,故图6未设置此组实验。

图6 正丁醇提取物的1/V-1/S曲线Fig.6 1/V-1/S curve of butanol
由图8可知,双倒数作图得到一组斜率不同,并几乎交于Y轴的直线,为竞争性抑制。这表明石油醚提取物可能与底物具有某些结构相似性,与底物共同竞争酶活性中心结合位点,不能与酶-底物络合物结合,主要通过诱导酶结构发生变化而使酶催化活性降低[27],属于底物型不可逆抑制,亦即邹承鲁教授提出的竞争性不可逆抑制[28-29],求得Ki为2.893 mg/mL。

图8 石油醚提取物的1/V-1/S曲线Fig.8 1/V-1/S of petroleum ether extracts
2.4 乳苣提取物对α-淀粉酶紫外光谱的影响
α-淀粉酶最大吸收波长在280 nm附近,主要由色氨酸(Trp)和酪氨酸(Tyr)侧链的光吸收引起,其波长或吸收强度变化可反映Trp和Tyr残基所处微环境的改变,故可选择紫外吸收光谱探讨α-淀粉酶结构变化。由图9~图11可知,未加α-淀粉酶时,0.05 mg/mL的水、正丁醇和石油醚提取物在280 nm均无特征吸收峰。当水、正丁醇和石油醚提取物浓度增大时,α-淀粉酶紫外吸收均逐渐增强,表明上述提取物与α-淀粉酶相互作用后,改变了Trp和Tyr等芳香族残基的微环境,从而引起α-淀粉酶吸收强度改变[30]。但α-淀粉酶紫外光谱均无明显红移或蓝移现象,这说明各提取物与α-淀粉酶相互作用,仅通过氢键、范德华力、离子键和疏水相互作用等非共价作用,轻微改变其空间构象,并不发生共价作用。
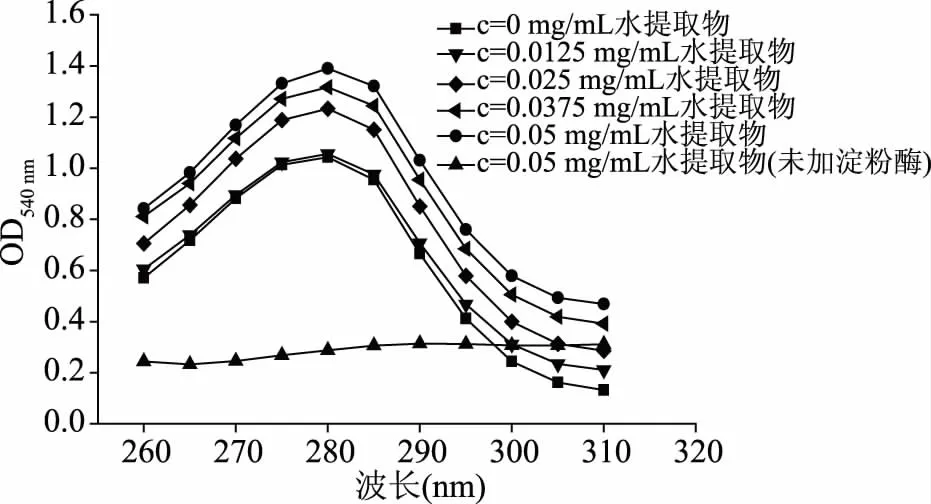
图9 水提取物紫外光谱Fig.9 Ultraviolet spectrum of water extract

图10 正丁醇提取物紫外光谱Fig.10 Ultraviolet spectrum of n-butyl alcohol extract
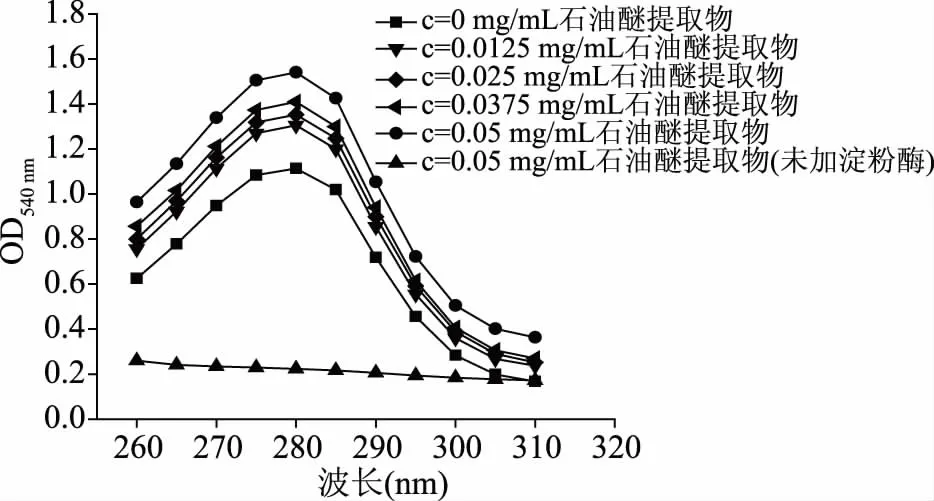
图11 石油醚提取物紫外光谱Fig.11 Ultraviolet spectrum of petroleum ether extract
2.5 乳苣提取物对α-淀粉酶表面疏水性的影响
蛋白质表面疏水性与其来源、加工方法、加工条件和溶剂有关,也与其理化性质和结构有关[31]。荧光探针ANS单独存在时,最大发射波长在510 nm附近,荧光强度极小。水提取物对α-淀粉酶表面疏水性的影响见图12。由图12可知,当水提取物处理时,ANS最大发射波长由510 nm迁移至470 nm附近。随水提取物浓度增大,ANS荧光强度逐渐增强,表明适宜浓度水提取物处理,可增强酶分子表面更多疏水区域暴露,诱发了α-淀粉酶的解折叠[32],从而可结合更多的ANS阴离子使荧光强度增强;正丁醇提取物对α-淀粉酶表面疏水性影响见图13。由图13可知,当正丁醇提取物处理时,ANS最大发射波长由510 nm迁移至450 nm附近。当正丁醇提取物较低(0.25 mg/mL)时,增强了荧光强度,这可能是低浓度正丁醇提取物与ANS结合,使酶分子部分伸展,导致蛋白质表面更多疏水区域暴露,从而可结合更多ANS阴离子;但当正丁醇提取物浓度较高(0.5~1.0 mg/mL)时,正丁醇提取物与ANS阴离子同时竞争结合酶分子表面,因而导致与ANS阴离子结合减弱,荧光强度下降[33];石油醚提取物对α-淀粉酶表面疏水性的影响见图14。由图14可知,当石油醚提取物处理时,ANS最大发射波长由510 nm迁移至490~500 nm附近。与正丁醇提取物不同,当低浓度(0.25 mg/mL)石油醚提取物处理时,其可能镶嵌于酶分子的疏水性空穴中,并通过静电相互作用部分稳定了酶分子的空间结构,相当于阻止了疏水基团暴露,因而降低了荧光强度。当高浓度(0.5~1.0 mg/mL)石油醚提取物处理时,其主要作用是使酶分子的空间结构完全伸展,疏水基团最大化暴露,因而增强了荧光强度。各提取物的荧光强度并未随溶剂极性增大而降低,即未遵循“正溶剂动力学”效应[34],原因是不同溶剂提取物的结构和性质不同,其对α-淀粉酶和ANS荧光强度的影响叶不同。另外,水提取物荧光强度明显高于正丁醇和石油醚提取物,原因是水是质子性溶剂,ANS与其形成氢键能力较强,相当于在ANS周围形成了有序的簇集体系[35],有效保护了ANS荧光发射。正丁醇虽为质子性溶剂,但质子供体能力远低于水分子,石油醚为非质子性溶剂,因此两者较为接近,且远低于水提取物荧光强度。

图12 水提取物对α-淀粉酶表面疏水性的影响Fig.12 Effects of water extract on surface hydrophobicity of α-amylase

图13 正丁醇提取物对α-淀粉酶表面疏水性的影响Fig.13 Effects of n-butyl alcohol extract on surface hydrophobicity of α-amylase
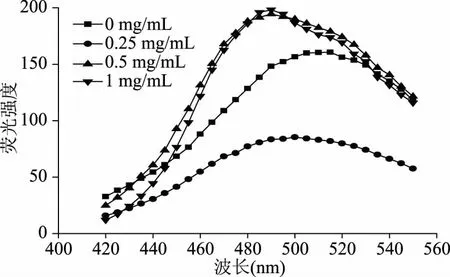
图14 石油醚提取物对α-淀粉酶表面疏水性的影响Fig.14 Effects of petroleum ether extract on surface hydrophobicity of α-amylase
3 结论与讨论
水、正丁醇、石油醚、氯仿和乙酸乙酯对α-淀粉酶的IC50分别为2.002、4.086、1.248、4.299和6.904 mg/mL,其中,石油醚提取物对α-淀粉酶的抑制作用最强。由于在0~2.0 mg/mL范围内,氯仿提取物对α-淀粉酶的抑制作用出现波动,且氯仿毒性较大;在0~6.0 mg/mL范围内,乙酸乙酯提取物对α-淀粉酶几乎无抑制作用,故后续实验未考虑氯仿和乙酸乙酯提取物。由上述分析可见,乳苣的水、正丁醇和石油醚提取物是一种潜在有效的α-淀粉酶抑制剂,可通过分离纯化进一步筛选其单体,以用于糖尿病、肥胖症等疾病预防。另外,水、正丁醇、石油醚提取物均可增加α-淀粉酶的紫外吸收强度,但不改变其吸收峰位置,这主要是3种提取物均可改变α-淀粉酶空间构象,使芳香族氨基酸而分布在酶分子表面,从而增强了紫外吸收能力,但未发生共价相互作用,不破坏酶分子的一级结构;水、正丁醇、石油醚提取物均可使ANS发生蓝移,改变了其荧光发射峰位置。
本实验中,乳苣不同溶剂提取物对α-淀粉酶的抑制类型与其它植物提取物不完全一致。水提取物对α-淀粉酶为可逆非竞争性抑制;正丁醇提取物对α-淀粉酶为可逆混合性抑制,属于反竞争性和非竞争性混合抑制,类似于非竞争性抑制作用。该类混合抑制的特点是双倒数曲线相较于第三象限,ES+IEIS的平衡常数小于Kis;石油醚提取物对α-淀粉酶为不可逆竞争性抑制,属于底物型不可逆抑制,亦即邹承鲁教授提出的竞争性不可逆抑制。刘华[27]研究表明,大黄酸对α-淀粉酶是一种可逆竞争性抑制剂,并与对照阿卡波糖进行了对比。另外,随大黄酸浓度增加,大黄酸诱导α-淀粉酶空间构象变得更加精密而不利于活性中心形成。刘自琴[36]研究表明,红茶和绿茶浸提液对猪α-淀粉酶均为可逆非竞争性抑制,且该相互作用过程中,α-淀粉酶紫外吸收强度增加,绿茶浸提液使吸收峰发生红移。这说明,不同的植物种类或溶剂提取物,对不同的酶具有不同的抑制类型,主要取决于提取物有效成分的化学结构。
[1]Parashar D,Satyanarayana T. Enhancing the production of recombinant acidicα-amylase and phytase in Pichia pastoris under dual promoters[constitutive(GAP)and inducible(AOX)]in mixed fed batch high cell density cultivation[J]. Process Biochemistry,2016,51(10):1315-1322.
[2]Homoki J R,Nemes A,Fazekas E,et al. Anthocyanin composition,antioxidant efficiency,andα-amylase inhibitor activity of different Hungarian sour cherry varieties(PrunuscerasusL.)[J]. Food Chemistry,2016,194:222-229.
[3]Wei Yu-tuo,Wang Xiao-bao,Liang Jia-yuan,et al. Identification of a halophilicα-amylase gene fromEscherichiacoliJM109 and characterization of the recombinant enzyme[J]. Biotechnology Letters,2013,35(7):1061-1065.
[4]王培立. 高温α-淀粉酶耐热嗜酸的分子改良及其高效表达的研究[D]. 北京:中国农业科学院,2016.
[5]Sun Li-jun,Chen Wei-qi,Meng Yong-hong,et al. Interactions between polyphenols in thinned young apples and porcine pancreaticα-amylase:Inhibition,detailed kinetics and fluorescence quenching[J]. Food Chemistry,2016,208:51-60.
[6]Yu Ji-hua,Li Yang-yang,Xiang Mian,et al. Molecular cloning and characterization ofα-amylase/subtilisin inhibitor from rhizome of Ligusticum chuanxiong[J]. Biotechnology Letters,2016,39(1):141-148.
[7]Patel H,Royall P G,Gaisford S,et al. Structural and enzyme kinetic studies of retrograded starch:Inhibition ofα-amylase and consequences for intestinal digestion of starch[J]. Carbohydrate Polymers,2017,164:154-161.
[8]Sun Li-jun,Warren F J,Netzel G,et al. 3 or 3′-galloyl substitution plays an important role in association of catechins and theaflavins with porcine pancreaticα-amylase:The kinetics of inhibition ofα-amylase by tea polyphenols[J]. Journal of Functional Foods,2016,26:144-156.
[9]钱春香,孙丽娜,薛璇玑,等. 乳苣全草石油醚部位化学成分的研究[J]. 中草药,2017,48(7):1302-1305.
[10]王小雄. 菊科和木贼科三种药用植物化学成分及其生物活性[D]. 兰州:兰州大学,2006.
[11]Wang Xiao-xiong,Lin Chang-jun,Jia Zhong-jian. Triterpenoids and sesquiterpenes from mulgedium tataricum[J]. Planta Med,2006,72(8):764-767.
[12]张彩艳,刘小敏,华子义,等. 乳苣水提物诱导肺癌细胞H1299和A549的凋亡[J]. 上海师范大学学报(自然科学版),2014,43(2):196-203.
[13]陶益,陈锥,张玉峰.亲和超滤耦联液相色谱-质谱快速检测山楂叶中的α-淀粉酶抑制剂[J]. 分析化学,2013,41(2):229-234.
[14]马艳丽,让一峰,赵 伟,等. 白芸豆α-淀粉酶抑制剂对α-淀粉酶抑制特性的研究[J]. 食品工业科技,2017,38(12):109-112.
[15]Bernfeld P. Amylases,αandβ[J]. Methods in Enzymology,1955,1(1):149-158.
[16]高义霞,周向军,杨声,等. 不同溶剂提取乳苣的抗氧化作用研究[J]. 食品工业科技,2012,33(1):85-87.
[17]申启荣.中药黄嘌呤氧化酶抑制剂的筛选及抑制动力学研究[D]. 南昌:南昌大学,2015.
[18]曹少谦,刘亮,杨震峰,等. 几种抑制剂对水蜜桃多酚氧化酶的抑制效应[J]. 中国食品学报,2014,14(7):144-149.
[19]Cardamone M,Puri N K. Spectrofluorimetric assessment of the surface hydrophobicity of proteins[J]. Biochemical Journal,1992,282(2):589-593.
[20]王镜岩,朱圣庚,徐长法. 生物化学[M](上册,第三版). 北京:高等教育出版社,2002.
[21]赵斌,葛金芳,朱娟娟,等.小议在MTT法测细胞增殖抑制率中IC50的计算方法[J]. 安徽医药,2007,11(9):834-836.
[22]Seong H J,Young B R,Marcus J C,et al. Tyrosinase inhibitory polyphenols from roots of morus lhou[J]. Journal of Agricultural and Food Chemistry,2009,57(4):1195-1203.
[23]陈惠黎. 分子酶学[M]. 北京:人民卫生出版社,1983:232-233.
[24]罗磊,周燕燕,朱文学,等. 金银花多酚氧化酶特异性及抑制剂动力学研究[J]. 农业机械学报,2014,45(7):202-208.
[25]龚仁敏. 酶可逆抑制作用中线性混合型抑制的动力学[J]. 安徽师范大学学报(自然科学版),1998,21(1):46-49.
[26]黄晓冬,吴雅清,许瑞安,等. 红树植物桐花树叶片多酚提取物对酪氨酸酶活性抑制及抗自由基和抗菌活性分析[J].植物资源与环境学报,2014,23(1):30-38.
[27]刘华,李仕祥,钟业俊,等.大黄酸对α-淀粉酶的抑制机理分析及分子模拟[J]. 现代食品科技,2015,31(2):47-51.
[28]梁之彦. 生理化学[M]. 上海:上海科学技术出版社,1985:238-240.
[29]杨同成. 赤小豆抑制剂对胰蛋白酶不可逆抑制作用的动力学探讨[J]. 生物化学杂志,1991,7(2):221-224.
[30]雷芳.茶碱、咖啡因、可可碱对胰α-淀粉酶部分理化性质的影响[D]. 成都:四川大学,2006.
[31]Huang Wei-ning,Sun Xiu-zhi. Adhesive properties of soy proteins modified by sodium dodecyl sulfate and sodium dodecyl benzene sulfonate[J]. Journal of the American Oil Chemists Society,2000,77(7):705-708.
[32]刘华,李仕祥,钟业俊,等.木犀草素对酪氨酸酶活性抑制及构象诱导作用[J]. 现代食品科技,2014,30(7):51-55.
[33]余晶梅.荧光探针法和疏水相互作用层析法分析蛋白表面疏水性[D]. 杭州:浙江大学,2014.
[34]吴世康.超分子光化学导论-基础与应用[M]. 北京:科学出版社,2005:170-174.
[35]孙延春.溶剂对TNS与ANS荧光光谱的影响[J]. 光谱实验室,2009,26(6):1590-1593.
[36]刘自琴,黄惠华.绿茶和红茶浸提液对α-淀粉酶的抑制作用研究[J]. 现代食品科技,2010,26(7):680-683.

