鼠李糖乳杆菌grx10降血脂效果初探
柳园,李晶晶,石磊,马亚,胡雯
四川大学华西医院 临床营养科,四川 成都 610041
血脂异常(dyslipidemia)是指由于机体脂质合成增加和/或血液中脂质清除能力减弱而导致的一种代谢障碍性疾病。国内外大量指南共识提出血脂异常是众多心血管疾病(cardiovascular disease,CVD)的独立危险因素,CVD已经成为危害人类健康最为严重的疾病之一,针对心血管疾病防治的研究十分必要[1-5]。益生菌通过产生胆盐水解酶、与胆固醇结合、粘附、转化等机制调节肠道功能参与体内胆固醇代谢,改善血脂水平,益生菌也成为了防治CVD的一种潜在手段[6-8]。本研究所使用的鼠李糖乳杆菌grx10(Lactobacillusrhamnosusgrx10,简称grx10)由我国自主筛选,其降血脂的健康效益已经在体外实验和动物研究中得到了验证,目前尚未见人体的相关文献报道[9]。因此,本课题拟采用随机、双盲、安慰剂对照研究,旨在观察grx10对血脂水平的改善作用,为血脂代谢异常达到用药指针前的非药物干预及CVD防治提供新的思路。临床试验注册号为ChiCTR-IIR-15007384。
1 对象与方法
1.1受试者的选择
1.1.1纳入标准 (1)年龄≥18岁;(2)参考《中国成人血脂异常防治指南2016版》,选择血清胆固醇水平达到边缘升高的低危、中危人群为本研究的受试对象,即血脂检测总胆固醇(TC)为5.2~7.2 mmol/L,和(或)低密度脂蛋白胆固醇(LDL-C)为3.4~4.9 mmol/L;(3)签订知情同意书,自愿参加试验者。
1.1.2排除标准 根据益生菌代谢特点及生物医学伦理要求,并依照ASCVD发病危险分层[1],排除可能被列为高危、极高危人群的因素,汇总排除标准:(1)已诊断患有ASCVD、高血压和/或糖尿病者;(2)BMI>28 kg/m2者;(3)过敏体质,尤其乳制品过敏或不耐受者;(4)妊娠、哺乳期或更年期妇女;(5)具有早发缺血性心血管病家族史者,或合并有心、肝、肾和造血系统等严重疾病,精神病患者;(6)研究期间食用除本菌粉外的其他各种形式的含益生菌的食品或产品,如酸奶等;(7)研究期间服用抗生素者;(8)近2周曾服用调脂药物,影响到对结果的判断者;(9)患有消化系统疾病,如胃肠道感染、胃肠道溃疡者;(10)住院的血脂异常者;(11)未按规定食用受试样品,或资料不全,影响功效或安全性判断者;(12)研究者认为不适合参加本研究的其他志愿者。
1.2研究方法与内容
1.2.1研究方法 将筛选出符合纳入排除标准的受试对象,随机分为对照组、低剂量组、高剂量组。对照组每日食用安慰剂(脱脂乳粉)10 g/d,低剂量组每日食用grx10粉剂4 g/d(活菌量为3.2×1010CFU/d)以及安慰剂6 g/d,高剂量组每日食用grx10粉剂10 g/d(8.0×1010CFU/d)。试验周期:2周洗脱期+6周干预期。所有纳入对象在正式接受干预前需经历2周的洗脱期,要求不摄入任何含有益生菌的食品。在干预期间,也要求受试对象不摄入干预样品之外的含有益生菌的产品。所有受试对象在入组前、干预期结束后均接受我院营养医师的饮食调查;在入组前及试验结束后进行血液指标检测。为保证研究对象的饮食及生活习惯在入组前后无差异,整个试验期间不为受试者提供饮食及生活方式建议。
受试对象所有血液采用全自动生化检测仪进行检测。营养师负责收集患者的饮食记录结果。
1.2.2观察指标 (1)基本信息:姓名、年龄、性别、教育程度、职业、身高、体重、吸烟、饮酒情况、体育活动情况等;(2)应用中国成人血脂异常防治指南推荐的高脂血症患者膳食评价表评估膳食情况,评分总和<3分为合格,3~5分为轻度膳食不良,≥6分为严重膳食不良;(3)血清TC、LDL-C、HDL-C(高密度脂蛋白胆固醇)、TG(甘油三酯)检测结果;(4)血常规、肝、肾功能等安全性指标检查及不良反应监测。
1.3质量控制 研究者根据随机数字表法随机分配受试对象的入组情况,每位受试对象以编号来区分,不同组别的干预物以A、B、C区分,所有结果在试验结束后揭盲。采用双人双录入法进行数据录入,录入完毕后对数据库进行纠错。
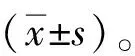
2 结 果
2.1一般情况 招募符合纳入排除标准70人,其中15人由于个人原因未能坚持服用,6人因身体不适而中止试验,5人因干预中途使用降脂药物或抗生素而中止试验。最终完成试验44人。其中高剂量组17人,低剂量组14人,安慰剂组13人;男14人,女30人;年龄为20~64岁,平均年龄(43.34±11.11)岁,均为原发性血脂升高者,不伴有其他慢性病。
2.2干预前组间基线情况比较 试验开始前三组志愿者组间性别、年龄、体重、BMI、吸烟率、饮酒率、体育活动率、空腹血糖、血脂等比较差异均无统计学意义。见表1。
2.3干预后受试者基本情况组内比较 对受试者的体重、BMI、吸烟率、饮酒率、体育活动率、膳食得分进行组内比较,结果显示除高剂量组体重及BMI干预后显著降低外,其余指标差异无统计学意义(表1vs表2)。
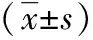
表1 干预前三组研究对象组间基线情况比较
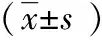
表2 干预结束后研究对象饮食、生活方式变化
注:a:与自身干预前比较。
2.4干预后血脂指标变化 各组组内干预前后比较:经自身配对t检验,与干预前相比,grx10高剂量干预组血清TC、TG、LDL-C显著下降[TC(5.66±1.44)mmol/L,P=0.0138;TG(1.57±0.67)mmol/L,P=0.0091;LDL-C(2.98±1.18)mmol/L,P=0.0262],HDL-C差异无统计学意义[(1.81±0.77)mmol/L,P=0.0672];低剂量组、安慰剂组组内比较,干预前后血脂指标差异均无统计学意义。
干预后三组组间比较:将高、低剂量组干预后的血脂值分别与安慰剂组比较,t检验显示高剂量组干预后TG指标显著下降[(1.57±0.67)mmol/L,P=0.0306],但TG改变差值及其余血脂指标差异均无统计学意义。见表3。
2.5安全性指标及不良反应监测 干预过程中,对所有受试对象血常规、肝功能、肾功能、空腹血糖等指标进行监测,干预前后上述指标差异均无统计学意义。
3 讨 论
本次随机、双盲、安慰剂对照试验结果发现,经过6周的干预,高剂量grx10组组内前后对照TC、TG、LDL-C差异有统计学意义。将高低剂量组血脂变化分别与安慰剂组比较,发现组间血脂变化差异无统计学意义。三组间的有关饮食、行为、生活方式指标,如体重、BMI、吸烟率、饮酒率、体育活动率、血脂异常膳食得分等差异均无统计学意义 。综上,研究结果显示当grx10达到较高剂量时可以降低血清TC、TG、LDL-C水平,但是尚不能说明grx10干预与安慰剂组的作用有差异。可能的原因有:
3.1疾病严重程度较低 本次研究旨在观察grx10的单独效应,综合生物医学伦理要求,建议血脂水平达到边缘升高的下限并且经危险度评定后ASCVD中、低危且未服药人群参加本项目。Greany等[10]和Ivey等[11]的RCT研究观察益生菌对健康人群血脂水平影响,疾病严重程度低可能是得到阴性结果的原因。Fuentes等[7]的开展的临床试验得出结论,患者的TC水平越高,益生菌降低CVD风险的效果越好。由于临床试验设计差异较大,Meta分析将不同研究中受试者的血脂基线进行亚组分析,同样指出益生菌对血脂TC较高人群的干预效果更明显[12-13]。尽管如此,为了受试者的安全考虑,我们纳入研究对象疾病严重程度较低,这可能影响了grx10的干预效果。
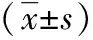
表3 干预后血脂指标变化
注:a:组内干预前后自身配对t检验;b:高、低剂量组分别与安慰剂组比较。
3.2依从性较低,样本量小 本次研究采用公共网络平台招募的形式纳入受试人群,未能如期坚持服用益生菌的人数较多,同时,受试人群血脂升高程度较低,随着时间的推移研究对象对自己血脂水平的关注度下降,使得本研究失访率较高。依从性是影响干预结果的因素之一。由于此次研究是grx10首次应用于人体,我们的纳入排除标准较为严格,限制了志愿者的入组,使得样本量较小,未来仍然需要大样本临床试验支持益生菌的人体功效。
3.3饮食和生活方式等混杂因素较多 血脂水平异常的治疗性生活方式改变包括控制体重、戒烟、限酒和坚持规律的中等强度代谢运动[1],无论是否使用调脂药物,饮食治疗和改善生活方式是血脂异常治疗的基础措施[14]。为控制这些混杂因素,本项目研究人员没有给受试者提供相关建议,但从干预前后吸烟、饮酒率来看,研究对象没有主动做出改变;通过血脂异常者膳食得分量表的评价也可以看出,受试者没有限制饮食中饱和脂肪含量较高,可能升高胆固醇的食物;体育活动率在干预结束后出现下降,也进一步说明受试者难以坚持非药物的治疗方式,依从性不高。
3.4剂量及疗程 目前对于益生菌的服用剂量尚无一个明确的标准。由于菌株特异性,不同的益生菌菌株、同一株益生菌不同剂量、不同干预周期或不同人群,对益生菌的效果相差影响很大。我国《益生菌类保健食品申报与审评规定》指出益生菌类食品保质期内的活菌数≥106CFU/mL(g)。大部分关于益生菌降血脂的RCT试验采用108~1010CFU/d的益生菌剂量,相关研究大都处于剂量摸索阶段,故研究者多设置高、低剂量组来评估益生菌的效果。Sharafedtinov等[15]的RCT研究益生菌剂量达7.5×1012CFU/d,有可能我们目前所使用的干预剂量不是这一菌株作用于人体的最佳剂量。此外,益生菌与血脂的Meta分析指出多种菌株混合、干预周期长,比单一菌株、干预周期短降脂效果更好[12-13],但我们同时需要考虑长时间使用可能发生的安全性问题[16]。
[1] 诸骏仁, 高润霖, 赵水平, 等. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016(10):937-953.
[2]Miller M, Stone NJ, Ballantyne C, et al. Triglycerides and cardiovascular disease:A scientific statement from the American Heart Association[J]. Circulation, 2011, 123(20): 2292-2333.
[3]Jacobson TA, Ito MK, Maki KC, et al. National lipid association recommendations for patient-centered management of dyslipidemia: Part 1-full report[J]. J Clin Lipidol, 2015, 9(2): 129-169.
[4]Stone NJ, Robinson JG, Lichtenstein AH, et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2014, 63(25 Pt B): 2889-2934.
[5]Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidemias: The Task Force for the Management of Dyslipidemias of the European Society of Cardiology(ESC) and European Atherosclerosis Society(EAS) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation(EACPR)[J]. Atherosclerosis, 2016, 253: 281-344.
[6]Jones ML, Martoni CJ, Prakash S. Cholesterol lowering and inhibition of sterol absorption byLactobacillusreuteriNCIMB 30242: A randomized controlled trial[J]. Eur J Clin Nutr, 2012, 66(11): 1234-1241.
[7]Fuentes MC, Lajo T, Carrión JM, et al. Cholesterol-lowering efficacy ofLactobacillusplantarumCECT 7527, 7528 and 7529 in hypercholesterolaemic adults[J]. Br J Nutr, 2013, 109(10): 1866-1872.
[8]Rerksuppaphol S. A randomized double-blind controlled trial ofLactobacillusacidophilusplusBifidobacteriumbifidumversus placebo in patients with hypercholesterolemia[J]. J Clin Diagnostic Res, 2015, 9(3): 1-4.
[9]顾瑞霞, 朱小红, 杨振泉, 等. 具有降胆固醇及抑菌能力的鼠李糖乳杆菌grx10及其制备方法、用途[P]. 中国: CN101328470A, 2008-12-24.
[10] Greany KA, Bonorden MJ, Hamilton-Reeves JM, et al. Probiotic capsules do not lower plasma lipids in young women and men[J]. Eur J Clin Nutr, 2008, 62(2): 232-237.
[11] Ivey KL, Hodgson JM, Kerr DA, et al. The effect of yoghurt and its probiotics on blood pressure and serum lipid profile: A randomised controlled trial[J]. Nutr Metab Cardiovasc Dis, 2015, 25(1): 46-51.
[12] Cho YA, Kim J. Effect of probiotics on blood lipid concentrations[J]. Medicine, 2015, 94(43): e1714.
[13] Sun J, Buys N. Effects of probiotics consumption on lowering lipids and CVD risk factors: A systematic review and meta-analysis of randomized controlled trials[J]. Ann Med, 2015, 47(6): 430-440.
[14] 诸骏仁. 正确认识合理使用调脂药物[J]. 中华心血管病杂志, 2001(12): 4-5.
[15] Sharafedtinov KK, Plotnikova OA, Alexeeva RI, et al. Hypocaloric diet supplemented with probiotic cheese improves body mass index and blood pressure indices of obese hypertensive patients-a randomized double-blind placebo-controlled pilot study[J]. Nutr J, 2013, 12(1): 138.
[16] Boyle RJ, Robins-Browne RM, Tang ML. Probiotic use in clinical practice: What are the risks?[J]. Am J Clin Nutr, 2006, 83(6): 1256-1264, 1446-1447.

