高效液相色谱法测定花椒中的苯甲酸
李曦,仲伶俐,赵珊,雷欣宇,魏超,郭灵安
(四川省农业科学院分析测试中心,四川成都 610066)
花椒为天然植株芸香科落叶灌木或小乔木蜀椒的果实,分布于亚洲、美洲、非洲及大洋洲的热带和亚热带地区[1],在我国主要产于山西、陕西、四川、山东、河北和河南等省。研究表明,花椒的主要化学成分有:蛋白质、碳水化合物、脂肪、矿物质元素、氨基酸、挥发油、生物碱、酰胺和香豆素等[2]。
凤凰网2017年6月报道,山东淄川区食药监局在对一超市的花椒抽检中检出苯甲酸,此外,在作者的日常检测中,也在花椒中有检出苯甲酸。GB 2760-2014《食品安全国家标准 食品添加剂使用标准》规定食品中苯甲酸及其钠盐以苯甲酸计,花椒不在其范围内视为不得检出[3]。花椒中检出苯甲酸与国家安全标准冲突,因而明确花椒中是否含有苯甲酸、含量如何,就成为当前亟待解决的问题。明确其系内源性苯甲酸或添加物,对判定厂家是否有非法添加行为至关重要。
苯甲酸,也称为安息香酸,属芳香族酸,未离解酸具抗菌活性,因而常以钠盐形式被添加饮料、果酱、蜜饯、糖果、酱油和醋等多种食品中[3]。苯甲酸以游离态和结合态的形式天然存在于许多植物和动物中,是植物和有机体的一种普遍代谢产物[4]。大多数浆果中均含有0.05%左右的苯甲酸,红枣中苯甲酸含量可达到74~95 mg/kg[5]。除此之外,蜂蜜、牛奶和小麦中也都存在一定量的苯甲酸[6,7]。
传统的检测苯甲酸山梨酸的方法有液相色谱法、气相色谱法、毛细管电泳法、紫外分光光度法和薄层层析法等[8]。因高效液相色谱法简便、高效、准确、稳定,于2016年12月发布的GB 5009.28-2016《食品安全国家标准 食品中苯甲酸、山梨酸和糖精钠的测定》也采用其作为测定苯甲酸和山梨酸的第一法[9]。标准中对一般食品、含胶基食品、高油脂食品和液体食品的前处理方法进行了详细的分类说明,基本步骤是使用沉淀剂沉淀蛋白之后,用水定容过膜供液相色谱分析。该方法操作简便,检测限和回收率均符合要求,对大多数食品来说,分离效果良好。而对于像花椒这样的天然复杂基质,含有比一般食品更加复杂的成分,该方法由于除杂效果有限,花椒中的目标物苯甲酸不能和其他成分有效地分离开。因而,有必要建立花椒中苯甲酸的高效液相色谱检测方法,并对花椒中苯甲酸的含量进行初步研究。
1 材料与方法
1.1 原料
花椒:共40批次样品,抽取于四川各城市批发市场。
甲醇:色谱纯,美国Fisher公司;甲酸:色谱纯,德国CNW公司;氨水、磷酸二氢钾、磷酸氢二钾:分析纯,西陇化工;苯甲酸标准品:德国DR公司;混合阴离子小柱(60 mg/3 mL):waters公司MAX小柱;实验用水均为超纯水。
1.2 仪器与设备
1100高效液相色谱仪:美国Agilent公司;离心机:LD5-2A北京京立离心机有限公司;0.45 μm微孔滤膜:天津津腾实验设备有限公司;超纯水系统:成都优普公司。
1.3 试验方法
1.3.1 标准溶液配制
准确称取苯甲酸标准品50.0 mg于50 mL容量瓶,用甲醇定容至刻度配置成1.0 mg/mL的标准储备液。量取储备液0.1、0.2、0.5、1.0、2.0 mL至100 mL容量瓶中,用流动相定容后经0.45 μm滤膜过滤,得到浓度分别为1.0、2.0、5.0、10.0、20.0 μg/mL的系列标准工作液。
1.3.2 样品前处理
(1)样品的提取
称取2 g样品于50 mL离心管中,加入2%氨水溶液21 mL,震摇2 min,超声提取10 min,加入92 g/L的亚铁氰化钾和183 g/L的乙酸锌溶液各2 mL,涡旋混匀,以5000 r/min离心5 min。上清液待净化。
(2)样品的净化
依次用3 mL甲醇、3 mL水活化固相萃取小柱,准确吸取提取液5.0 mL过此小柱。再依次用2%氨水溶液3 mL、甲醇3 mL淋洗,抽干小柱。用5%甲酸甲醇溶液2.0 mL洗脱,洗脱液过0.45 μm滤膜后,供高效液相色谱测定。
1.3.3 色谱条件
色谱柱:Waters sunfire C18柱(4.6 mm×250 mm,5 μm);柱温:35 ℃;流动相A:磷酸盐缓冲溶液(磷酸二氢钾2.5 g和磷酸氢二钾2.5 g定容至1 L),流动相B:甲醇,A:B=97:3;流速:0.9 mL/min;进样量:10 μL;紫外检测器波长:230 nm。
2 结果与讨论
2.1 提取净化方法的选择

图1 苯甲酸标准溶液及不同前处理图谱Fig.1 The chromatograms of benzonic acid standard and samples with different pretreatment
GB 5009.28-2016中一般食品试样的前处理方法如下:2 g样品→加水25 mL涡旋→50 ℃超声→亚铁氰化钾和乙酸锌各2 mL→离心转移水相于50 mL→残渣加水再次提取转移水相至 50 mL容量瓶→定容→0.22 μm滤膜过滤。该方法简便易操作,利于批样处理。实验中除了亚铁氰化钾配合乙酸锌作为澄清剂沉淀蛋白之外,没有更多的除杂和净化步骤。
因此我们除了使用亚铁氰化钾和乙酸锌沉淀蛋白外,增加了固相萃取小柱净化过程。实验采用Waters Oasis MAX固相萃取小柱,装载混合型阴离子交换反相吸附剂,对酸性化合物具有高的选择性和灵敏度。通过固相萃取步骤将花椒基质中的分析物分成两部分:酸性化合物和碱性/中性化合物,通过收集洗脱液得到包含目标物苯甲酸在内的酸性化合物混合液。
图1是苯甲酸标准溶液以及同一花椒样品分别采用以上两种前处理之后的色谱图,其中a为按照GB 5009.28-2016处理的色谱图,b按本文1.3.2进行前处理的色谱图,c为浓度10.0 μg/mL的苯甲酸标准溶液。图中可见,色谱图a未经固相萃取净化,谱图杂峰较多,且在苯甲酸出峰位置正好有干扰峰;色谱图b经过阴离子交换固相萃取之后,谱图较干净,苯甲酸峰形完整,分离度合适。
2.2 仪器条件的优化
2.2.1 色谱柱的选择

图2 四种色谱柱的标样图谱Fig.2 The standard chromatograms of four different columns
本研究比较了以下四种色谱柱的分离效果:Waters sunfire C18(4.6 mm×250 mm,5 μm)、和Shiseido MGⅡC18(4.6 mm×250 mm,5 μm)、Agilent Zorbax SB-AQ(4.6 mm×150 mm,5 μm)和Agilent Zorbax SAX(4.6 mm×150 mm,5 μm)。流动相条件为:10% MeoH+90%磷酸盐缓冲溶液,流速 0.9 mL/min,进样量10 μL,检测波长230 nm。在此条件下,苯甲酸在四种色谱柱的出峰时间先后分别为SB-AQ、MGⅡ、Sunfire、SAX,相应的峰面积为414,427,429和384。分离杂质与目标峰的需要,色谱柱需要对苯甲酸有较强的保留,且结合峰面积,因而本实验选用Sunfire色谱柱对花椒中苯甲酸进行分离。
2.2.2 流动相
比较 20 mM/L乙酸铵-甲醇(国标 GB 5009.28-2016中使用的流动相)和磷酸盐缓冲溶液-甲醇作为流动相的分离效果,两种盐溶液和甲醇的比例均为90:10。其他分析条件一致:流速0.9 mL/min,柱温35 ℃,检测波长230 nm,Waters sunfire C18色谱柱。
在此条件下,乙酸铵-甲醇和磷酸盐缓冲溶液-甲醇作为流动相苯甲酸的出峰时间分别为:6.147和9.157,色谱峰面积431和429。因而本实验选用了对苯甲酸有着更强保留作用的磷酸盐缓冲溶液-甲醇作为流动相。实验比较了磷酸盐缓冲溶液-甲醇比例85:15、90:10、95:5、98:2 四种比例下的色谱图情况,发现当甲醇含量过高时,花椒样品溶液中苯甲酸与相邻峰未分离开。为满足分离度要求,确定流动相磷酸盐缓冲溶液和甲醇比例的97:3。
2.2.3 方法的线性范围和检出限
配制质量浓度为1.0、2.0、5.0、10.0、20.0 μg/mL的标准溶液,从低浓度到高浓度依次进样,计算各自的峰面积(每个样平行进样三次)。按实验结果计算标准曲线,以浓度(X)对色谱峰面积(Y)进行线性回归,计算回归方程(见表1)。根据仪器灵敏度和添加回收实验,以信噪比(S/N)≥3计算方法的检出限为2.0 mg/kg,低于国标GB 5009.28-2016的检出限5.0 mg/kg,能够满足国家限量标准要求。
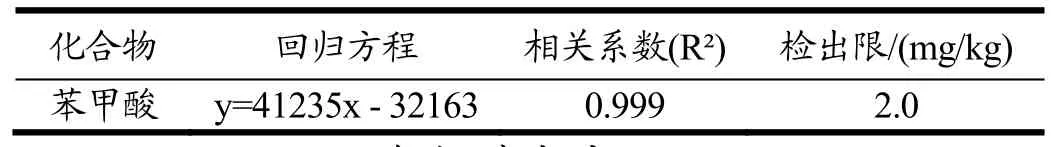
表1 回归方程、相关系数和检出限Table 1 Regression equations, correlation coefficient and LOD
2.2.4 方法回收率与精密度
对花椒样品进行添加回收实验。加标浓度为2.0、5.0和20.0 mg/kg,每个浓度做三次平行试验。结果如表2,苯甲酸的加标回收率为73.1%~94.3%,RSD为2.8%~7.4%。结果表明,经混合阴离子固相萃取小柱净化后,HPLC测定花椒中苯甲酸的准确度和精密度较好,能满足检测要求。

表2 回收率与精密度实验Table 2 Results of recovery test and precision experiment
2.3 样品测定
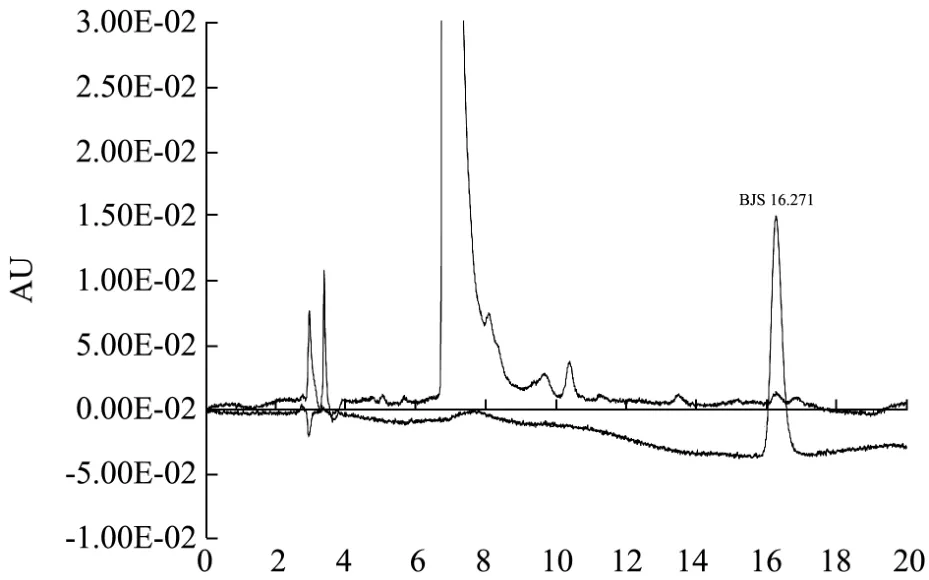
图3 苯甲酸标准溶液及11号样品的图谱Fig.3 The chromatograms of benzonic acid standard and No. 11 sample

表3 花椒样品中的苯甲酸含量(mg/kg)Table 3 The content of benzonic acid in Sichuan pepper samples (mg/kg)
采用本实验筛选出的方法对 40个花椒样品中的苯甲酸进行了测定,标样及11号样品的图谱见图3。结果表明,苯甲酸在39个花椒样品中有检出,含量为2.08~12.20 mg/kg,平均含量6.02 mg/kg,结果见表3。可见花椒中含有一定量的苯甲酸,而少量的苯甲酸对人体无毒害,它可以在体内很快被吸收,主要与甘氨酸结合以马尿酸的形式排出体外,也有一小部分与葡糖醛酸结合为 1-苯甲酰葡糖醛酸而排出[10]。10~14 h便可从体内全部排出,因此少量的苯甲酸不会有积蓄作用。
3 结论
3.1 本研究确定了花椒中苯甲酸的高效液相色谱检测方法并进行了含量测定。在前处理中采用混合阴离子固相萃取小柱以净化样品,以磷酸盐缓冲溶液-甲醇(95:5)为流动相,选用Waters sunfire C18色谱柱在230 nm下进行高效液相色谱分析,方法检出限为2.0 mg/kg。该方法能有效地分开花椒中的目标物和干扰物质,具有简便性和通用性,能满足添加剂检测要求和国内外限量标准要求,适用于复杂基质中苯甲酸的测定。
3.2 采用该方法对四川的花椒主产区的40批次样品进行分析,检测结果显示 39批花椒样品中检出苯甲酸,含量为2.08~12.20 mg/kg,平均含量6.02 mg/kg。可见花椒中含有一定量的苯甲酸,而少量的苯甲酸在人体内可通过代谢排出。世界卫生组织国际化学品安全署暂定的苯甲酸每日耐受摄入量为5.0 mg/kg体重[11],且花椒仅作为调味料加入到食品中,因此花椒中的苯甲酸钠不会对健康产生负面影响。
[1]Porter D M. Zanthoxylum (Rutaceae) in north America north of Mexico [J]. Brittonia, 1976, 28(4):443-447
[2]郭静.花椒中有效成分的分析测定方法和抗氧化作用研究[D].重庆:西南大学,2008 GUO Jing. Studies on the inspection methods and antioxidaive effect of effective components from Zanthoxylum [D]. Chongqing:Southwest University, 2008
[3]GB 2760-2014,食品安全国家标准食品添加剂使用标准[S]GB 2760-2014, National food safety standard:standard of food additives [S]
[4]苏敏,巩志国,宋姣,等.干制红枣中天然苯甲酸的测定及本底分析[J].中国食品添加剂,2017,3:152-156 SU Min, GONG Zhi-guo, SONG Jiao, et al. The determination of naturai benzoic acid in dried red dates and background anaIysis [J]. China Food Additive, 2017, 3:152-156
[5]孙屏,吕岳文,刘超,等.新疆红枣中天然苯甲酸含量的调查研究[J].新疆农业科学,2014,51(2):235-240 SUN Ping, LV Yue-wen, LIU Chao, et al. Research of naturally occurring benzoic acid in Chinese dates [J].Xinjiang Agriculture Science, 2014, 51(2):235-240
[6]马景友,吴九重,李洪波,等.牛乳中苯甲酸的来源及含量研究[J].中国乳业,2012,125:64-66 MA Jing-you, WU Jiu-chong, LI Hong-bo, et al. Researches on the content and origine of benzoic acid in milk [J]. Dairy Industry, 2012, 125:64-66
[7]牟艳莉,宁准梅.蜂蜜中内源性物质苯甲酸的研究进展[J].工业微生物,2017,47(4):61-64 MU Yan-li, NING Zhun-mei. Research on naturally occurring benzoic acid of honey [J]. Industrial Microorganism, 2017, 47(4):61-64
[8]王俊红.食品添加剂苯甲酸检测方法研究进展[J].粮食与油脂,2010,12:37-38 WANG Jun-hong. Research progress on detecting methods of benzoic acid in food additive [J]. Journal of Cereals and Oils,2010, 12:37-38
[9]GB 5009.28-2016,食品安全国家标准食品中苯甲酸、山梨酸和糖精钠的测定[S]GB 5009.28-2016, National food safety standard:Determination of benzoic acid, sorbic acid and saccharin sodium in food [S]
[10]唐文强,刘长海.天然苯甲酸生物合成机制的研究进展[J].中国调味品,2011,36(8):12-15 TANG Wen-qiang, LIU Chang-hai. Natural acid biosynthetic mechanism research [J]. Chinese Condiment, 2011, 36(8):12-15
[11]简明国际化学品评估文件26:苯甲酸和苯甲酸钠[Z]Concise International Chemical Assessment Document 26:Benzoic Acid and Sodium Benzoate [Z]

