苹果模拟胃肠消化后的多酚释放和抗HepG2细胞增殖活性研究
周志航,从彦丽,唐旭蔚,彭梦雪,2
(1.深圳职业技术学院应用化学与生物技术学院,广东深圳 518055)(2.广西师范大学生命科学学院,广西桂林 541004)
苹果是世界上膳食消费量较大的水果之一,其食用方式主要是鲜食,此外还可制成果汁、果酒、果醋和果酱等。流行病学研究表明,饮食结构中富含苹果与肺癌[1]、结肠癌[2]、肾癌[3]等癌症的发病率呈负相关的关系,苹果及其制品能有效改善衰老、糖尿病、心肺功能、胃肠道功能[4]。多酚是苹果的主要生物活性物质之一,苹果多酚主要含羟基肉桂酸、二氢查尔酮、黄酮醇和低聚原花青素等[5]。苹果由于富含多酚类生物活性物质,饮食中消费苹果具有潜在的预防癌症发生的作用。
传统评价多酚生物活性的数据大都基于化学提取,即采用丙酮、甲醇、乙酸乙酯和石油醚等有机溶剂萃取,提取条件与胃肠道的消化环境相差较远,而多酚在胃肠道中的释放取决于许多因素,如消化酶、pH和食物基质等[6]。多酚在食物中以酯、苷和聚合物的形式存在,可通过非共价键(如氢键、疏水作用力、离子键)与蛋白质、多糖形成复合物[7]。在胃酸低pH条件下,黄酮类低聚物降解成更小的结构单元;在小肠中,多酚可能会发生去糖基化、葡萄糖醛酸化、甲基化、磺化以及类黄酮的羟基化等化学变化[8]。多酚物质在胃肠道消化过程中的这些变化有可能对其生物活性产生较大的影响,如黑莓多酚经消化代谢后的产物可以以较低的、接近生理血药的浓度保护神经母细胞,避免其被 H2O2诱导死亡,而其有机溶剂提取物在高于生理提取五倍的浓度下也没有保护作用[9]。评价苹果多酚在机体中的潜在生物活性,应该考虑到其在胃肠道中发生的物理化学变化。相对于有机溶剂提取法,基于模拟胃肠消化的评价结果更合理。在基于体外模拟胃肠消化法评价水果营养的工作中发现,模拟胃肠消化过程可以影响多酚的释放量、稳定性和生物有效性等[10,11]。
目前评价苹果抗肿瘤细胞增殖活性的研究主要基于有机溶剂提取法,尚不清楚苹果模拟胃肠消化后的提取物对肿瘤细胞的抗增殖活性。本研究分别采用80%丙酮提取以及模拟胃肠消化法提取苹果中的多酚,通过高效液相色谱测定提取物的多酚释放量,并基于 HepG2细胞系评价苹果提取物的抗肿瘤细胞增殖活性。研究结果将丰富水果营养健康评价理论知识,有利于开发利用苹果多酚类生物活性物质的研究。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
青苹果和嘎啦果产地为智利,水晶富士产地为山东。苹果全果洗净、擦干水分、去核后,带皮迅速切成小块并混匀备用,苹果实验材料均避光保存在-80 ℃。HepG2肝癌细胞株,购买于美国 ATCC(American Type Culture Collection)。
1.1.2 主要试剂
胃蛋白酶、胰酶、胆汁提取物、荧光素钠盐、熊果苷、没食子酸、原儿茶酸、新绿原酸、对羟基苯甲酸、绿原酸、香草酸、咖啡酸、维采宁-2、阿魏酸、芥子酸、白藜芦醇、槲皮素-3-葡萄糖苷、芦丁、异牧荆黄素、新北美圣草苷、扁蓄苷、槲皮苷、柚皮素、根皮苷、新橙皮甙、桑色素、柚皮甙、根皮素、异鼠李素、Hepes缓冲液、非必需氨基酸(100×)、青链霉素混合液(100×)、甲醇、乙腈,均购自美国Sigma公司;William’s Medium E培养基、胎牛血清(FBS)、Hank’s平衡盐溶液(HBSS,1×)、0.05%胰酶-EDTA,购自美国 Life-Technologies公司;NaCl、NaHCO3、Na2CO3、浓 HCl、NaOH、KH2PO4、K2HPO4均购自天津市大茂化学试剂厂;实验用水为18.2 MΩ超纯水。
1.2 仪器与设备
JYL-C012型组织捣碎机,山东九阳公司;IKA T25 digital Ultra-Turrax型高速匀浆机,德国IKA公司;Avanti J-30I型冷冻离心机,美国BECKMAN公司;5180 R型冷冻离心机,德国Eppendorf公司。Laborota 4001型旋转蒸发仪,德国Heidolph公司;Spectra Max M2型连续光谱密度荧光检测仪,美国 Molecular Devices公司;雷磁PHS-3C型pH计,上海仪电科学仪器公司;SRY-1230型恒温水浴摇床,美国 crystal公司。高效液相色谱(LC-20 A),日本岛津公司;色谱柱:Agilent ZORBAX Eclipse Plus Phenyl-Hexyl(4.6 mm×250 mm,5 μm);Milli-Q 超纯水器,购自美国Millipore公司。HERA cell 240型CO2细胞培养箱,美国 Thermo公司;DMIRB型荧光倒置显微镜,德国Leica仪器公司。
1.3 80%丙酮提取苹果游离酚
参照熊云霞[12]的方法并稍作改进。苹果去籽后取全果(含果肉和果皮),100 g苹果碎片与200 g 80%丙酮(4 ℃)混合,经组织搅碎机捣碎1 min;再经高速匀浆机以转速12000 r/min均质5 min(冰浴),制成匀浆液。设立3个平行组,每组称取50 g均质的果浆,4 ℃,20000 r/min离心20 min,80%丙酮(4 ℃)重复提取3次,合并提取液。提取液用旋转蒸发仪真空浓缩至10 mL以内,蒸馏水重溶浓缩液,定容至25 mL,分装、-80 ℃保存。
1.4 苹果体外模拟胃肠消化
1.4.1 模拟胃消化
参考熊云霞[12]的方法并稍作改进。苹果去核后取全果(含果肉和果皮)切成碎片,1000 g苹果与1000 g 0.9% NaCl混合,经组织搅碎机捣碎1 min,再经高速匀浆机以转速12000 r/min均质5 min(冰浴),制成匀浆液。
模拟胃液组:200 g匀浆液水浴至37 ℃后,1 mol/L HCl调节pH=2,再加入5 mL模拟胃液(0.5 g胃蛋白酶溶于5 mL 0.01 mol/L HCl)。胃酸对照组:200 g匀浆液水浴至37 ℃后,1 mol/L HCl调节pH=2,再加入5 mL 0.01 mol/L HCl。胃空白对照组:200 g匀浆液水浴至37 ℃后,加入与模拟胃液组调节pH=2所需盐酸等体积的0.9% NaCl,再加入5 mL 0.9% NaCl,pH为苹果匀浆液原始pH。
实验设立3个平行组。用锡箔纸将锥形瓶包好避光,在氮气流下,于37 ℃、转速100 r/min的恒温水浴摇床消化,于消化的0,0.5,1,2,3 h取样,每次取样20 g,并将所取样品马上置于碎冰冷却,经20000 r/min离心20 min后,取上清液于-80 ℃保存备用。
1.4.2 模拟肠消化
基于模拟胃消化样品的分析结果,模拟胃消化2 h后,样品的总多酚、总黄酮释放量趋于平稳(p>0.05),因此苹果匀浆液经胃消化2 h后结束胃消化阶段,作为肠消化0 h。
模拟肠液消化组:200 g苹果匀浆液经过模拟胃消化2 h后,1 mol/L NaHCO3调节pH至7.0,加入20 mL模拟肠液(0.3 g胰酶和1.9 g胆汁溶于60 mL 0.1 mol/L pH 7.0的NaHCO3-Na2CO3缓冲溶液);肠空白对照组:200 g苹果匀浆液经过模拟胃消化 2 h后,1 mol/L NaHCO3调节 pH=7,加入 20 mL的 0.1 mol/L的NaHCO3-Na2CO3缓冲溶液。
用锡箔纸将锥形瓶包好避光,继续在氮气流下置于37 ℃、转速100 r/min的恒温水浴摇床中,持续消化4 h,于模拟肠消化0,0.5,1,2,3,4 h取样,每次取样20 g,并将所取样品置于碎冰冷却,离心后上清液于-80 ℃保存备用。
1.5 高效液相色谱条件
高效液相色谱条件在李艳等[13]的方法上稍作改进。柱温35 ℃;流速1.0 mL/min;进样量10 μL;检测波长为280、320、350、370 nm;流动相为乙腈(A)和含0.1%甲酸的超纯水(B)。梯度洗脱:0~5 min,3% A;5~10 min,3%~7% A;10~25 min,7%~10% A;25~35 min,10%~12% A;35~45 min,12%~14% A;45~55 min,14%~15% A;55~65 min,15%~22% A;65~80 min,22%~25% A;80~90 min,25%~30% A;90~110 min,30%~35% A;110~115 min,35%~3% A;115~120 min,3% A。多酚单体含量测定的结果表示为mg/kg鲜重(Fresh weight,FW),即mg/kg FW。
1.6 HepG2细胞培养
HepG2细胞接种在完全培养基中生长,培养基中含有5%胎牛血清(FBS)、10 mM Hepes缓冲液、5 μg/mL胰岛素、0.05 μg/mL氢化可的松、100 U/mL青霉素和100 μg/mL链霉素。细胞在5% CO2,37 ℃条件下培养。待细胞进入对数生长期后用 0.05%胰酶-EDTA消化传代。实验所用的细胞在第10~30代之间。
1.7 苹果提取物对HepG2细胞的毒性作用
细胞毒性实验参考 Felice等[14]的方法并稍作改进,实验操作过程如下:100 μL HepG2单细胞悬液接种到96微孔透明板中(4×104个/孔),于含5% CO2、37 ℃的细胞培养箱培养 24 h;吸出生长培养基,用1×PBS清洗贴壁细胞;加入100 μL不同浓度的苹果提取物(苹果提取物用0.22 μm孔径的滤膜过滤除菌后,用生长培养基稀释系列浓度),设空白对照组(只加入生长培养基);于含 5% CO2、37 ℃细胞培养箱培养24 h;吸出含苹果提取物的培养基,1×PBS清洗贴壁细胞;每孔加入50 μL亚甲基蓝溶液(含1×HBSS、1.25%戊二醛和0.6%亚甲基蓝),于含5% CO2、37 ℃细胞培养箱培养60 min;吸出亚甲基蓝溶液,将微孔板轻轻浸入去离子水中清洗三次至洗净细胞表面吸附的染料。将96孔板倒置在纸巾上晾干水分后,每孔加入100 μL洗脱液(含体积分数49% 1×PBS、50%无水乙醇、1%冰醋酸)。将96孔板室温旋转震荡20 min,置于Spectra Max M5e多功能酶标仪中测定570 nm处的 OD值。若样品组比对照组的 OD值显著性减少(p<0.05),即判断为苹果提取物有细胞毒性。
1.8 苹果提取物抗HepG2细胞增殖活性
抗 HepG2细胞增殖活性实验所用的苹果提取物浓度设在没有细胞毒性的浓度范围内。抗增殖实验参考Felice等[14]的方法并稍作改进,实验操作过程如下:100 μL HepG2单细胞悬液接种到 96微孔透明板中(2.5×104个/孔),于含 5% CO2、37 ℃细胞培养箱培养4 h;吸出细胞生长培养基,加入100 μL不同浓度的苹果提取物(不同浓度提取物用生长培养基稀释制备),设空白对照组(只加入生长培养基)。于含 5%CO2、37 ℃细胞培养箱培养72 h;吸出含苹果提取物的培养基,1×PBS清洗贴壁细胞;亚甲基蓝染色法测定 OD值,并计算细胞存活率,细胞存活率(%)=样品组OD值/空白对照组OD值×100%。
1.9 统计分析
采用IBM SPSS V20.0软件分析实验数据,平均值的差异性用单因素方差分析(one-way ANOVA)中的LSD检验,p<0.05为有统计学差异。数值用平均值±标准偏差表示,实验设立3个平行组。
2 结果与讨论
2.1 苹果在模拟胃肠消化过程中多酚释放量
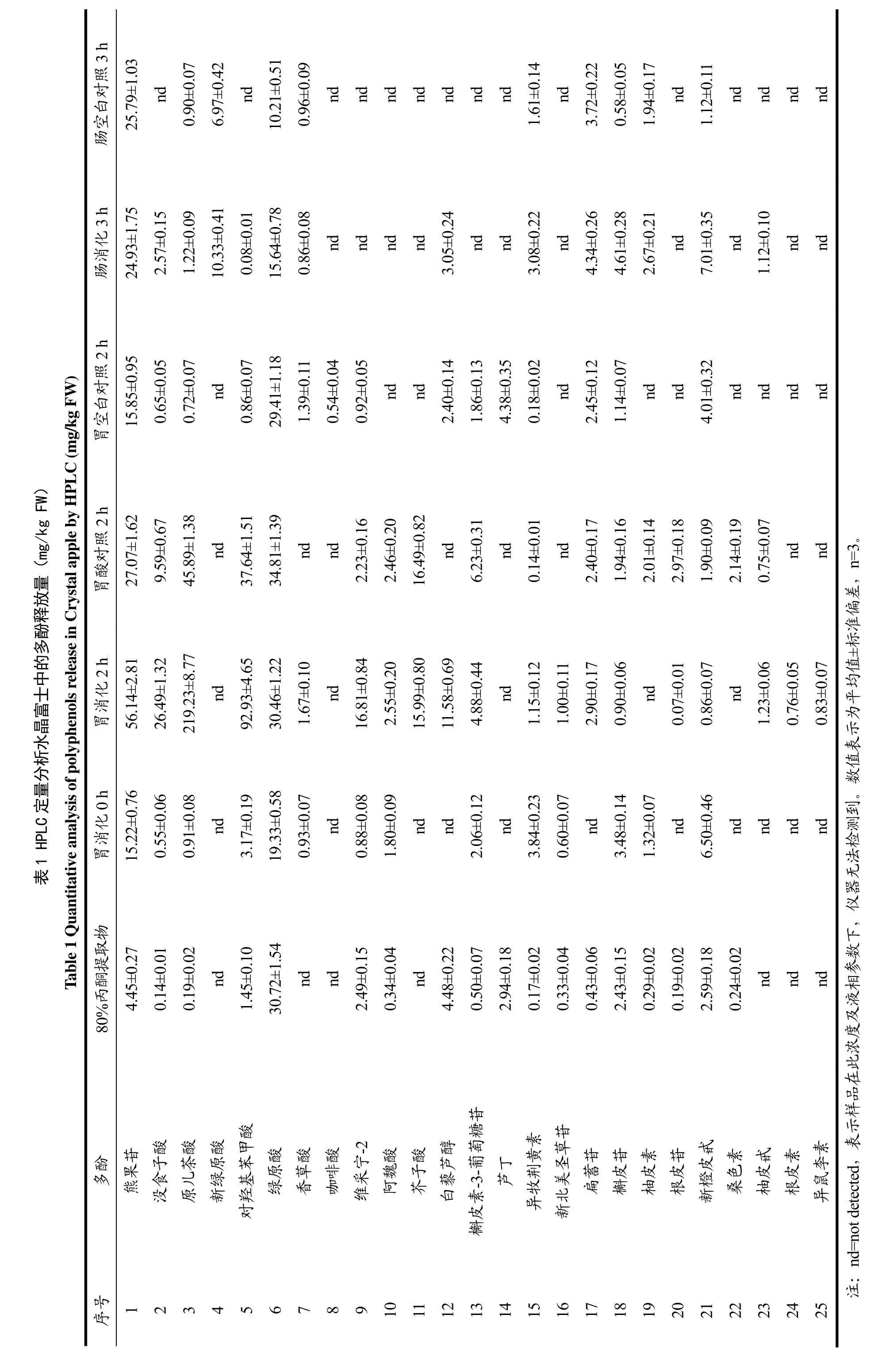
苹果分别经过模拟胃肠消化和80%丙酮提取后,采用高效液相色谱方法测定其提取液中的多酚单体组分的释放量。水晶富士、嘎啦果和青苹果的多酚组分在不同提取条件下的释放量分别见表1、2和3。
最大释放量高于20 mg/kg FW的多酚组分分别为原儿茶酸(287.95±20.16 mg/kg FW)、对羟基苯甲酸(194.75±11.68 mg/kg FW)、熊果苷(102.78±6.17 mg/kg FW)、绿原酸(43.25±2.16 mg/kg FW)、没食子酸(34.30±2.74 mg/kg FW)、维采宁-2(24.25±1.94 mg/kg FW)、芥子酸(23.70±1.42 mg/kg FW)、槲皮苷(22.86±1.37 mg/kg FW)、白藜芦醇(20.74±1.45 mg/kg FW)。这些释放量较大的多酚主要是羟基苯甲酸(原儿茶酸、对羟基苯甲酸、没食子酸)和羟基肉桂酸(绿原酸和芥子酸)等酚酸,此外还有黄酮醇(槲皮苷、槲皮素-3-葡萄糖苷、扁蓄苷)、黄酮(维采宁-2)、芪(白藜芦醇)和熊果苷等。在水晶富士、嘎啦果和青苹果的80%丙酮提取物中,绿原酸的释放量最高,分别为30.72±1.54、22.37±1.12、8.70±0.44 mg/kg FW。
水晶富士、嘎啦果和青苹果模拟胃消化2 h后,所测定的酚酸类物质的释放量显著升高(p<0.05),原儿 茶 酸 释 放 量 ( 219.23±8.77 、 287.95±20.16 、247.28±9.89 mg/kg FW)分别为 80%丙酮提取物(0.19±0.02、0.58±0.05、0.65±0.07 mg/kg FW)的 1154、496、380倍,为模拟胃消化0 h(0.91±0.08、0.96±0.09、2.11±0.15 mg/kg FW)的241、300、117倍;对羟基苯甲酸释放量(92.93±4.65、194.75±11.68、108.52±4.34 mg/kg FW)分别为 80%丙酮提取物(1.45±0.10、1.85±0.13、0.27±0.03 mg/kg FW)的64、105、402倍,为模拟胃消化 0 h(3.17±0.19、3.16±0.22、3.92±0.24 mg/kg FW)的 29、62、28倍;熊果苷释放量(56.14±2.81、102.78±6.17、79.01±4.74 mg/kg FW)分别为 80%丙酮提取物(4.45±0.27、6.19±0.31、4.20±0.29 mg/kg FW)的13、17、19倍,为模拟胃消化 0 h(15.22±0.76、28.17±2.25、19.93±1.00 mg/kg FW)的4、4、4倍;绿原酸释放量(30.46±1.22、43.25±2.16、22.43±1.57 mg/kg FW)分别为 80%丙酮提取物(30.72±1.5、22.37±1.12、8.70±0.44 mg/kg FW)的 1、2、3 倍,为模拟胃消化0 h(19.33±0.58、3.04±0.18、4.05±0.16 mg/kg FW)的2、14、6倍。测定的其它酚酸(没食子酸、芥子酸)经过模拟胃消化后,释放量也显著升高(p<0.05)。这表明模拟胃消化的过程可以影响酚酸的释放量,胃酸及胃蛋白酶的消化作用可以促进酚酸的释放,酚酸在酸性(pH≈2)条件下可稳定存在。
水晶富士、嘎啦果和青苹果模拟肠消化3 h后,酚酸在模拟肠消化环境下显著降解(p<0.05)。与模拟胃消化2 h相比,水晶富士、嘎啦果和青苹果模拟肠消化3 h后,原儿茶酸、对羟基苯甲酸释放量均降低了 99%以上;熊果苷的降解率分别为 56%、76%和27%;绿原酸的降解率分别为49%、63%和78%;没食子酸的降解率分别为 90%、97%和 100%;芥子酸降解率均为100%;白藜芦醇降解率分别为74%、86%和 100%,这表明所测定的酚酸在模拟肠消化条件(pH≈7)下不稳定,易发生降解。模拟肠消化过程也可以促进部分多酚的释放,水晶富士、嘎啦果和青苹果模拟肠消化后释放的槲皮苷分别是肠空白对照组的8、17和6倍;新绿原酸释放量分别为肠空白对照组的1.5、1.9和1.0倍。在模拟肠消化过程中,释放量显著增加(p<0.05)的其它多酚有:水晶富士中的异牧荆黄素、扁蓄苷、槲皮苷、柚皮素、新橙皮甙;嘎啦果中的槲皮素-3-葡萄糖苷、异牧荆黄素、柚皮甙;青苹果中的柚皮甙。这表明,模拟肠消化的过程可以影响多酚的释放量及其稳定性,胰酶和胆汁可以促进多酚的释放,测定的大部分多酚在模拟肠消化条件(pH≈7.0)下不稳定。
在80%丙酮提取物中测定的多酚,释放量最大的是绿原酸。绿原酸是植物体在有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物,属于羟基肉桂酸,由咖啡酸与奎尼酸缩合形成,其分子结构含酯键、双键、酚羟基等不稳定化学键[15]。绿原酸(3-咖啡酰奎尼酸)结构不稳定,容易异构化为其它同分异构体,如隐绿原酸(4-咖啡酰奎尼酸)和新绿原酸(5-咖啡酰奎尼酸)。
绿原酸在模拟胃消化过程中释放量上升,在模拟肠消化过程中释放量下降,与此同时仅在模拟肠消化过程检测到新绿原酸。Bouayed等在苹果的研究中也得到了相似的结果,41~77%的绿原酸在模拟肠消化过程中降解了,并在肠消化提取物中检测到隐绿原酸和新绿原酸[16]。因此,绿原酸在模拟肠消化条件下降解,可能异构化为新绿原酸等同分异构体。
在80%丙酮提取物中测定的多酚,释放量最大的是绿原酸。绿原酸是植物体在有氧呼吸过程中经莽草酸途径产生的一种苯丙素类化合物,属于羟基肉桂酸,由咖啡酸与奎尼酸缩合形成,其分子结构含酯键、双键、酚羟基等不稳定化学键[15]。
?
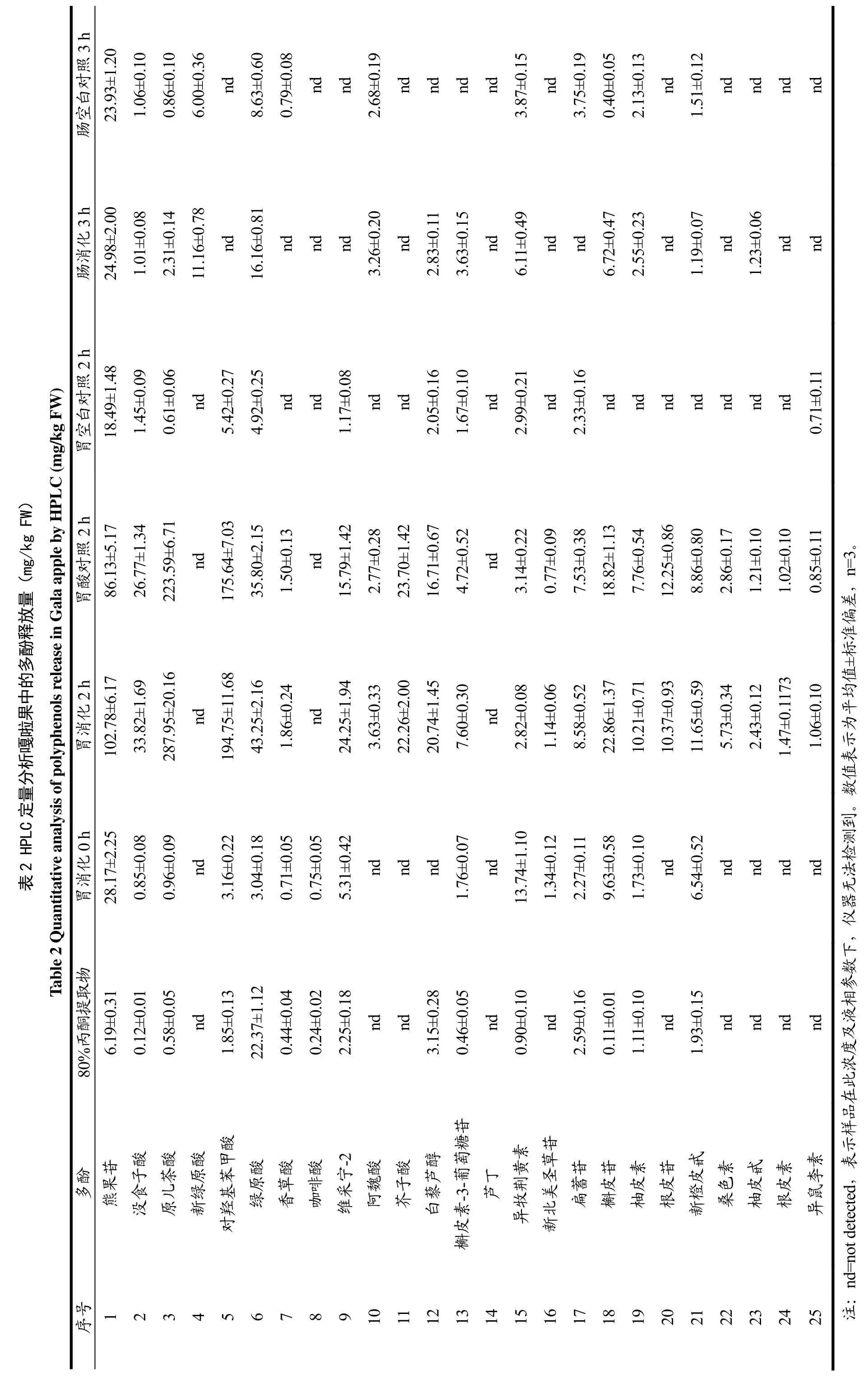
表2 H P L C 定量分析嘎啦果中的多酚释放量(m g/k g F W)T a b l e 2 Q u a n t i t a t i v e a n a l y s i s o f p o l y p h e n o l s r e l e a s e i n G a l a a p p l e b y H P L C (m g/k g F W)序号多酚8 0%酮提取物胃消化0 h胃消化2 h胃酸对照5.1 7 2 h胃空白对照2 h肠消化3 h肠空1熊果苷丙6.1 9±0.3 1 2 8.1 7±2.2 5 1 0 2.7 8±6.1 7 8 6.1 3±1 8.4 9±1.4 8 2 4.9 8±2.0 0 2 3.2没食子酸0.1 2±0.0 1 0.8 5±0.0 8 3 3.8 2±1.6 9 2 6.7 7±1.3 4 1.4 5±0.0 9 1.0 1±0.0 8 1.0 3原儿茶酸0.5 8±0.0 5 0.9 6±0.0 9 2 8 7.9 5±2 0.1 6 2 2 3.5 9±6.7 1 0.6 1±0.0 6 2.3 1±0.1 4 0.8 4新绿原酸n d n d n d n d n d 1 1.1 6±0.7 8 6.0 5对羟基苯甲酸1.8 5±0.1 3 3.1 6±0.2 2 1 9 4.7 5±1 1.6 8 1 7 5.6 4±7.0 3 5.4 2±0.2 7 n d 6绿原酸2 2.3 7±1.1 2 3.0 4±0.1 8 4 3.2 5±2.1 6 3 5.8 0±2.1 5 4.9 2±0.2 5 1 6.1 6±0.8 1 8.6 7香草酸0.4 4±0.0 4 0.7 1±0.0 5 1.8 6±0.2 4 1.5 0±0.1 3 n d n d 0.7 8咖啡酸0.2 4±0.0 2 0.7 5±0.0 5 n d n d n d n d 9维采宁-2 2.2 5±0.1 8 5.3 1±0.4 2 2 4.2 5±1.9 4 1 5.7 9±1.4 2 1.1 7±0.0 8 n d 1 0阿魏酸n d n d 3.6 3±0.3 3 2.7 7±0.2 8 n d 3.2 6±0.2 0 2.6 1 1芥子酸n d n d 2 2.2 6±2.0 0 2 3.7 0±1.4 2 n d n d 1 2白藜芦醇3.1 5±0.2 8 n d 2 0.7 4±1.4 5 1 6.7 1±0.6 7 2.0 5±0.1 6 2.8 3±0.1 1 1 3槲皮素-3-葡萄糖苷0.4 6±0.0 5 1.7 6±0.0 7 7.6 0±0.3 0 4.7 2±0.5 2 1.6 7±0.1 0 3.6 3±0.1 5 1 4芦丁n d n d n d n d n d n d 1 5异牧荆黄素0.9 0±0.1 0 1 3.7 4±1.1 0 2.8 2±0.0 8 3.1 4±0.2 2 2.9 9±0.2 1 6.1 1±0.4 9 3.8 1 6新北美圣草苷n d 1.3 4±0.1 2 1.1 4±0.0 6 0.7 7±0.0 9 n d n d 1 7扁蓄苷2.5 9±0.1 6 2.2 7±0.1 1 8.5 8±0.5 2 7.5 3±0.3 8 2.3 3±0.1 6 n d 3.7 1 8槲皮苷0.1 1±0.0 1 9.6 3±0.5 8 2 2.8 6±1.3 7 1 8.8 2±1.1 3 n d 6.7 2±0.4 7 0.4 1 9柚皮素1.1 1±0.1 0 1.7 3±0.1 0 1 0.2 1±0.7 1 7.7 6±0.5 4 n d 2.5 5±0.2 3 2.1 2 0根皮苷n d n d 1 0.3 7±0.9 3 1 2.2 5±0.8 6 n d n d 2 1新橙皮甙1.9 3±0.1 5 6.5 4±0.5 2 1 1.6 5±0.5 9 8.8 6±0.8 0 n d 1.1 9±0.0 7 1.5 2 2桑色素n d n d 5.7 3±0.3 4 2.8 6±0.1 7 n d n d 2 3柚皮甙n d n d 2.4 3±0.1 2 1.2 1±0.1 0 n d 1.2 3±0.0 6 2 4根皮素n d n d 1.4 7±0.1 1 7 3 1.0 2±0.1 0 n d n d 2 5异鼠李素n d n d 1.0 6±0.1 0 0.8 5±0.1 1 0.7 1±0.1 1 n d注:n d=n o t d e t e c t e d,表示样品在此浓度及液相参数下,仪器无法检测到。数值表示为平均值±标准偏差,n=3。
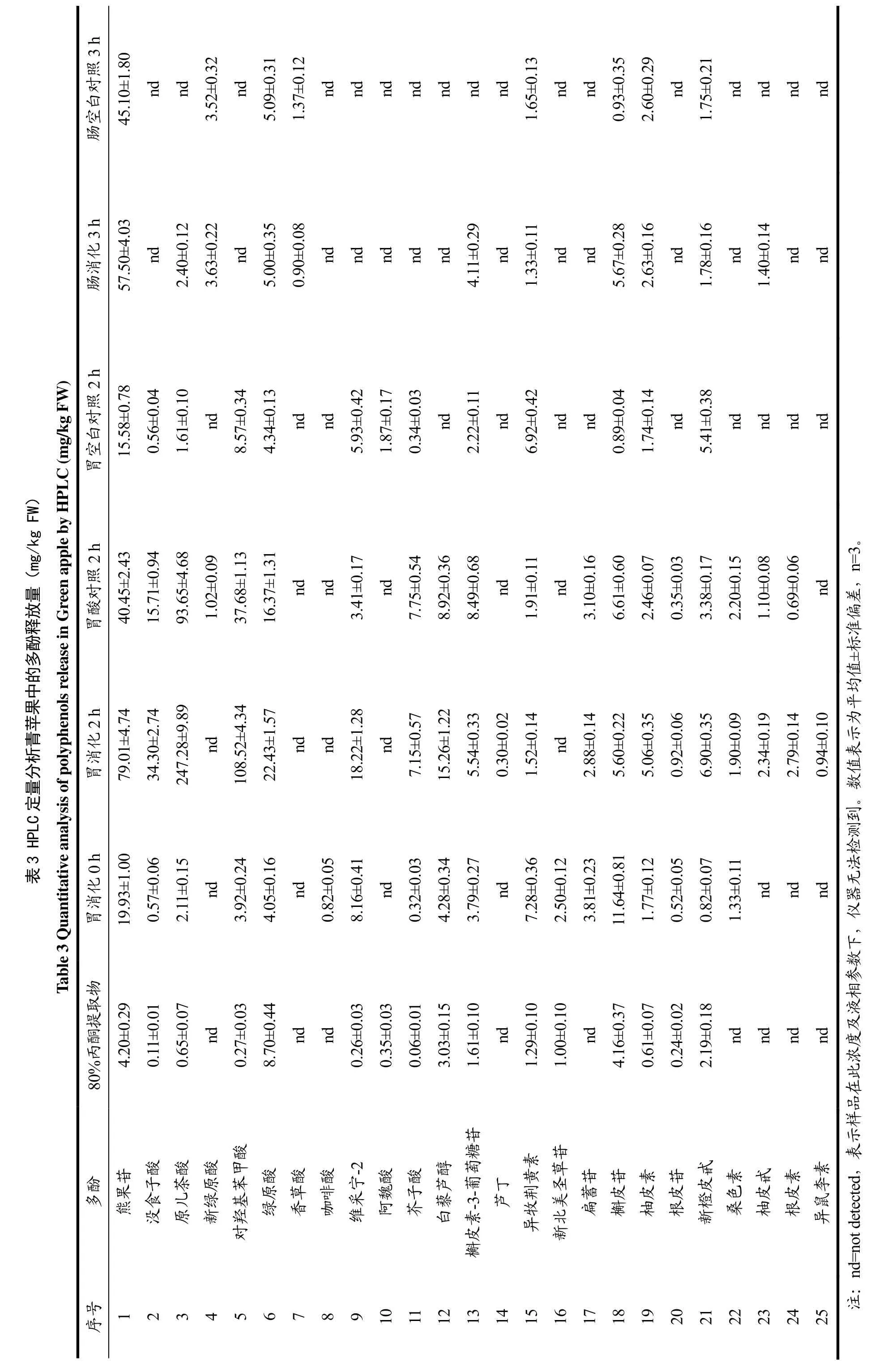
表3 H P L C 定量分析青苹果中的多酚释放量(m g/k g F W)T a b l e 3 Q u a n t i t a t i v e a n a l y s i s o f p o l y p h e n o l s r e l e a s e i n G r e e n a p p l e b y H P L C (m g/k g F W)序号多酚8 0%丙酮提取物胃消化0 h胃消化2 h胃酸对照2 h胃空白对照2 h肠消化3 h肠空白1熊果苷4.2 0±0.2 9 1 9.9 3±1.0 0 7 9.0 1±4.7 4 4 0.4 5±2.4 3 1 5.5 8±0.7 8 5 7.5 0±4.0 3 4 5.1 2没食子酸0.1 1±0.0 1 0.5 7±0.0 6 3 4.3 0±2.7 4 1 5.7 1±0.9 4 0.5 6±0.0 4 n d 3原儿茶酸0.6 5±0.0 7 2.1 1±0.1 5 2 4 7.2 8±9.8 9 9 3.6 5±4.6 8 1.6 1±0.1 0 2.4 0±0.1 2 4新绿原酸n d n d n d 1.0 2±0.0 9 n d 3.6 3±0.2 2 3.5 5对羟基苯甲酸0.2 7±0.0 3 3.9 2±0.2 4 1 0 8.5 2±4.3 4 3 7.6 8±1.1 3 8.5 7±0.3 4 n d 6绿原酸8.7 0±0.4 4 4.0 5±0.1 6 2 2.4 3±1.5 7 1 6.3 7±1.3 1 4.3 4±0.1 3 5.0 0±0.3 5 5.0 7香草酸n d n d n d n d n d 0.9 0±0.0 8 1.3 8咖啡酸n d 0.8 2±0.0 5 n d n d n d n d 9维采宁-2 0.2 6±0.0 3 8.1 6±0.4 1 1 8.2 2±1.2 8 3.4 1±0.1 7 5.9 3±0.4 2 n d 1 0阿魏酸0.3 5±0.0 3 n d n d n d 1.8 7±0.1 7 n d 1 1芥子酸0.0 6±0.0 1 0.3 2±0.0 3 7.1 5±0.5 7 7.7 5±0.5 4 0.3 4±0.0 3 n d 1 2白藜芦醇3.0 3±0.1 5 4.2 8±0.3 4 1 5.2 6±1.2 2 8.9 2±0.3 6 n d n d 1 3槲皮素-3-葡萄糖苷1.6 1±0.1 0 3.7 9±0.2 7 5.5 4±0.3 3 8.4 9±0.6 8 2.2 2±0.1 1 4.1 1±0.2 9 1 4芦丁n d n d 0.3 0±0.0 2 n d n d n d 1 5异牧荆黄素1.2 9±0.1 0 7.2 8±0.3 6 1.5 2±0.1 4 1.9 1±0.1 1 6.9 2±0.4 2 1.3 3±0.1 1 1.6 1 6新北美圣草苷1.0 0±0.1 0 2.5 0±0.1 2 n d n d n d n d 1 7扁蓄苷n d 3.8 1±0.2 3 2.8 8±0.1 4 3.1 0±0.1 6 n d n d 1 8槲皮苷4.1 6±0.3 7 1 1.6 4±0.8 1 5.6 0±0.2 2 6.6 1±0.6 0 0.8 9±0.0 4 5.6 7±0.2 8 0.9 1 9柚皮素0.6 1±0.0 7 1.7 7±0.1 2 5.0 6±0.3 5 2.4 6±0.0 7 1.7 4±0.1 4 2.6 3±0.1 6 2.6 2 0根皮苷0.2 4±0.0 2 0.5 2±0.0 5 0.9 2±0.0 6 0.3 5±0.0 3 n d n d 2 1新橙皮甙2.1 9±0.1 8 0.8 2±0.0 7 6.9 0±0.3 5 3.3 8±0.1 7 5.4 1±0.3 8 1.7 8±0.1 6 1.7 2 2桑色素n d 1.3 3±0.1 1 1.9 0±0.0 9 2.2 0±0.1 5 n d n d 2 3柚皮甙n d n d 2.3 4±0.1 9 1.1 0±0.0 8 n d 1.4 0±0.1 4 2 4根皮素n d n d 2.7 9±0.1 4 0.6 9±0.0 6 n d n d 2 5异鼠李素n d n d 0.9 4±0.1 0 n d n d n d注:n d=n o t d e t e c t e d,表示样品在此浓度及液相参数下,仪器无法检测到。数值表示为平均值±标准偏差,n=3。
绿原酸(3-咖啡酰奎尼酸)结构不稳定,容易异构化为其它同分异构体,如隐绿原酸(4-咖啡酰奎尼酸)和新绿原酸(5-咖啡酰奎尼酸)。绿原酸在模拟胃消化过程中释放量上升,在模拟肠消化过程中释放量下降,与此同时仅在模拟肠消化过程检测到新绿原酸。Bouayed等在苹果的研究中也得到了相似的结果,41~77%的绿原酸在模拟肠消化过程中降解了,并在肠消化提取物中检测到隐绿原酸和新绿原酸[16]。因此,绿原酸在模拟肠消化条件下降解,可能异构化为新绿原酸等同分异构体。
模拟胃肠消化过程可以促进多酚类物质的释放。模拟胃消化过程释放量较大(大于20 mg/kg FW)的多酚为羟基苯甲酸(原儿茶酸、对羟基苯甲酸、没食子酸)和羟基肉桂酸(绿原酸和芥子酸)等酚酸,此外还有黄酮(维采宁-2)、芪(白藜芦醇)、熊果苷等。模拟肠消化过程释放量较大的为槲皮苷、槲皮素-3-葡萄糖苷、扁蓄苷(槲皮素3-α-L-阿拉伯呋喃糖苷)等黄酮醇以及新绿原酸。多酚、蛋白质和多糖可通过非共价键(如疏水作用力、氢键和离子键)形成“多酚-蛋白质-多糖”复合物,其中多酚的芳香环和蛋白质的疏水基团(如脯氨酸残基的吡咯环)可引起疏水相互作用,蛋白质的氢原子受体基团和多酚的羟基之间可形成氢键,而离子键主要在蛋白质带正电的基团(如精氨酸、组氨酸及赖氨酸的ε-氨基基团)和多酚带负电的羟基基团上产生[17]。在胃消化过程中,较低的pH(≈2.0)可以破坏疏水作用力以及氢键的形成,不利于多酚-蛋白质-多糖复合物的形成,从而使得多酚从复合物中释放出来。多酚(如绿原酸)在较高pH(≈7.0)条件下不稳定,易被多酚氧化酶氧化形成自由基或醌类化合物[18]。
此外,消化酶(胃蛋白酶和胰酶)可以使多酚从不溶性纤维素中释放出来[19]。已有研究发现模拟胃肠消化过程可以促进多酚类物质的释放。Tagliazucchi等在葡萄的研究中发现,模拟胃肠消化环境可以促进多酚的释放,在胃消化过程中总多酚、总黄酮和花青素类的释放量增加,在肠道环境中酚酸和白藜芦醇降解,儿茶素、槲皮素则相对较稳定[20]。Rodríguez-Roque等发现,橙、菠萝和猕猴桃模拟胃消化后绿原酸、对香豆酸、柚皮素和芦丁的浓度升高了,阿魏酸、芥子酸、橙皮苷、槲皮素和儿茶素浓度降低,而在模拟肠条件下,大部分分析的多酚浓度降低[21]。Frontela等发现,菠萝、葡萄和黑莓在模拟胃消化后,绿原酸和阿魏酸释放量显著增加,经过胃肠消化后黄烷醇或原花青素可能被释放[22]。本研究中酚酸类物质在模拟胃消化过程中的大量释放,可能源于较低pH条件破坏了多酚与其它物质形成的非共价键以及胃蛋白酶对多酚和蛋白质之间形成的共价键的消化作用,使得酚酸从“多酚-蛋白质-多糖”复合物中释放出来。而在肠消化过程中,黄酮醇等多酚的释放,可能源于胰酶和胆汁的消化作用,破坏了多酚与蛋白质之间的共价键(如酯键),从而释放多酚。
2.2 苹果模拟消化提取物抗 HepG2细胞增殖活性
2.2.1 苹果提取物对HepG2细胞的毒性作用
水晶富士、嘎啦果和青苹果分别经过80%丙酮萃取以及模拟胃肠消化提取,得到的苹果提取物配制成系列浓度,作用于人肝癌细胞HepG2,培养24 h后测定苹果提取物对细胞的毒性。若样品组比对照组的OD 值显著性减少(p<0.05)即判断为苹果提取物有细胞毒性。
苹果提取物对HepG2细胞的毒性见表4。由表4可知,苹果不同处理条件下的提取物对HepG2细胞生长产生毒性的浓度各不相同,模拟胃消化和肠消化后的苹果提取物产生细胞毒性的浓度较低,说明苹果模拟胃肠消化后,其提取液对HepG2细胞的毒性增强。我们的前期研究结果[23]表明,模拟胃肠消化后,总多酚的释放量增高,多酚在体外条件(pH≈4)下不稳定,会发生降解。苹果模拟胃肠消化后,其提取物的细胞毒性增强,可能源于其多酚类物质的释放。胃空白对照组消化2 h后与胃消化0 h相比,其产生细胞毒性的浓度增大(即细胞毒性减弱),可能是多酚在体外条件下不稳定发生降解引起的,这与我们前期的结果[23]相符合。

表4 苹果提取物对HepG2细胞的毒性浓度(mg/mL)Table 4 The toxic concentration of apple extract on HepG2 cell (mg/mL)
2.2.2 苹果提取物对HepG2细胞抗增殖活性

图1 HepG2细胞在不同浓度的水晶富士模拟胃肠消化提取物作用下的存活率Fig.1 The survival rate of HepG2 cell intervened in different concentrations of Crystal apple simulated gastrointestinal digestion extracts
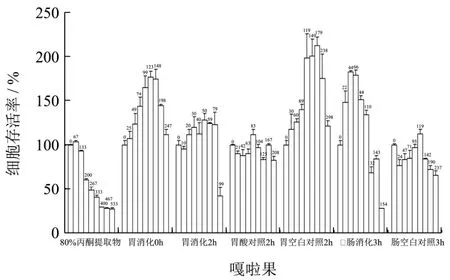
图2 HepG2细胞在不同浓度的嘎啦果模拟胃肠消化提取物作用下的存活率Fig.2 The survival rate of HepG2 cell intervened in different concentrations of Gala apple simulated gastrointestinal digestion extracts
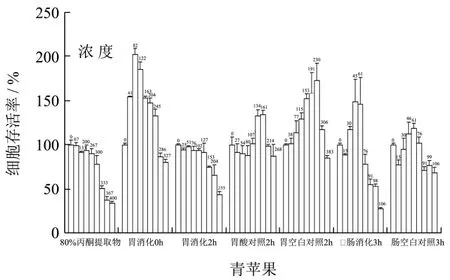
图3 HepG2细胞在不同浓度的青苹果模拟胃肠消化提取物作用下的存活率Fig.3 The survival rate of HepG2 cell intervened in different concentrations of Green apple simulated gastrointestinal digestion extracts
将系列质量浓度的苹果多酚提取物作用于人肝癌细胞HepG2,72 h后检测其抗增殖活性。试验所用的苹果提取物浓度均设置在没有细胞毒性的浓度范围内,这样可以确保苹果提取物的抗HepG2细胞增殖作用不是由其本身的细胞毒性作用引起。水晶富士、嘎啦果和青苹果不同处理条件下提取物作用于 HepG2细胞,细胞存活率分别如图1、图2及图3所示。
不同品种、不同提取条件下,苹果提取物对HepG2细胞的作用效果不同。大部分苹果提取物在低浓度下对细胞生长有促进作用,高浓度下抑制细胞生长。苹果模拟胃消化2 h及模拟肠消化3 h后的提取物在试验的最高浓度(分别为297、99、255 mg/mL和198、154、106 mg/mL)下可以降低HepG2细胞的存活率。在最大试验浓度下,水晶富士、嘎啦果及青苹果胃消化2 h后的提取物作用于HepG2细胞,HepG2细胞的存活率分别为26%、42%和44%;肠消化3 h后的提取物作用于HepG2细胞,HepG2细胞的存活率分别为23%、28%和28%。这表明,水晶富士、嘎啦果和青苹果模拟胃肠消化后,在最大试验浓度下,其提取物对HepG2细胞的增殖有较强的抑制作用,且模拟肠消化3 h后的提取物对HepG2细胞增殖的抑制率高于模拟胃消化2 h后的提取物。在试验的浓度范围内,苹果模拟胃消化前(胃消化0 h)、胃酸对照组消化2 h、胃空白对照组消化2 h、肠空白组消化3 h后的提取物作用于HepG2细胞后,未降低细胞存活率(细胞生长存活率>80%),相反大部分提取物可以促进HepG2细胞的生长。
水晶富士、嘎啦果和青苹果模拟胃肠消化后,在最大试验浓度下,其提取物对HepG2细胞的增殖有较强的抑制作用,且模拟肠消化 3 h后的提取物对HepG2细胞增殖的抑制率高于模拟胃消化2 h后的提取物。大部分苹果提取物在低浓度下对细胞生长有促进作用,高浓度下抑制细胞生长。模拟胃肠消化后引起的抗增殖活性增强可能源于模拟消化可促进多酚类物质的释放。有研究表明,肿瘤细胞中存在较高的活性氧(Reactive oxygen species,ROS)水平,ROS在低浓度下可作为信号分子,促进细胞的生长代谢,但较高的 ROS水平可以攻击细胞的大分子物质(如DNA、蛋白质、脂质),诱导细胞凋亡[24]。酚类物质在金属离子(如Cu2+、Fe2+)催化下可通过Fenton反应产生ROS(如·OH),引发癌细胞内更高的氧化应激水平,促使癌细胞DNA损伤,诱导细胞凋亡[25]。苹果提取物作用于HepG2细胞后,可能是通过调节ROS的水平来调节细胞的增殖或凋亡,低浓度的苹果提取物所含多酚的量相对较低,其产生的ROS水平尚不能造成细胞损伤,反而可作为信号分子促进细胞的生长代谢,而高浓度的苹果提取物所释放多酚的量较高,可产生较高水平的ROS,最终损伤细胞内的大分子,诱导细胞凋亡。许多酚类物质可通过调节肿瘤细胞内的ROS的水平来抑制肿瘤细胞增殖,如槲皮素可通过增强ROS介导的凋亡信号通路,诱导卵巢癌细胞凋亡[26]。此外其它多酚类物质如白藜芦醇[27,28]、鼠尾草酚[29]也可通过改变细胞内 ROS水平诱导癌细胞凋亡。在一定浓度范围内,苹果提取物对HepG2细胞的抗增殖活性增强,原因可能在于多酚类物质破坏了HepG2细胞内氧化-还原反应平衡,引起细胞内ROS水平局域波动,从而诱导其凋亡。多酚对肿瘤细胞的抗增殖作用机制有待于进一步探究。
3 结论
3.1 本研究评价了水晶富士、嘎啦果和青苹果在模拟胃肠消化前后,多酚组分的释放量以及其抗人肝癌HepG2细胞增殖的活性。结果发现,80%丙酮萃取的游离酚中,绿原酸的释放量最高。模拟胃消化过程释放量较大(大于20 mg/kg FW)的多酚为羟基苯甲酸(原儿茶酸、对羟基苯甲酸、没食子酸)和羟基肉桂酸(绿原酸和芥子酸)等酚酸,此外还有熊果苷、白藜芦醇和维采宁-2等。
3.2 模拟肠消化过程释放量较大的为槲皮苷、槲皮素-3-葡萄糖苷、扁蓄苷等黄酮醇以及新绿原酸。酚酸类物质在模拟胃消化过程中的释放,可能源于较低 pH条件破坏了多酚与其它物质形成的非共价键以及胃蛋白酶水解了多酚和蛋白质之间形成的共价键,使得酚酸从“多酚-蛋白质-多糖”复合物中释放出来。而在肠消化过程中,黄酮醇等多酚的释放,可能源于胰酶和胆汁破坏了多酚与其它物质之间的共价键(如酯键),使得多酚释放出来。
3.3 苹果提取物在低浓度下对HepG2细胞生长有促进作用,高浓度下抑制其生长;在一定浓度下,对HepG2细胞的增殖有较强的抑制作用,且模拟肠消化3 h后的提取物对HepG2细胞的抗增殖活性最强。苹果模拟胃肠消化后引起的抗增殖活性增强可能归因于模拟消化促进多酚类物质的释放,多酚类物质可能破坏了HepG2细胞内的氧化-还原反应平衡,引起细胞ROS水平局域波动,从而诱导细胞凋亡,具体的作用机制有待深入探讨。
[1]Feskanich D, Ziegler R G, Michaud D S, et al. Prospective study of fruit and vegetable consumption and risk of lung cancer among men and women [J]. Journal of the National Cancer Institute, 2000, 92(22):1812-1823
[2]Michels K B, Giovannucci E, CHAN A T, et al. Fruit and vegetable consumption and colorectal adenomas in the Nurses' Health Study [J]. Cancer Research, 2006, 66(7):3942-3953
[3]LindblAD P, Wolk A, Bergström R, et al. Diet and risk of renal cell cancer:a population-based case-control study [J].Cancer epidemiology, biomarkers & prevention:a publication of the American Association for Cancer Research,cosponsored by the American Society of Preventive Oncology, 1997, 6(4):215-223
[4]Hyson D A. A comprehensive review of apples and apple components and their relationship to human health [J].Advances in Nutrition, 2011, 2(5):408-420
[5]Boyer J, Liu R H. Apple phytochemicals and their health benefits [J]. Nutrition Journal, 2004, 3(1):1-15
[6]Bohn T. Dietary factors affecting polyphenol bioavailability[J]. Nutrition Reviews, 2014, 72(7):429-452
[7]Czubinski J, Dwiecki K. A review of methods used for investigation of protein-phenolic compound interactions [J].International Journal of Food Science & Technology, 2017,52(3):573-585
[8]Tarko T, Duda-chodak A, Zając N. Digestion and absorption of phenolic compounds assessed by in vitro simulation methods. A revied [J]. Rocz Panstw Zakl Hig, 2013, 64(2):79-84
[9]Tavares L, Figueira I, Macedo D, et al. Neuroprotective effect of blackberry (Rubus sp.) polyphenols is potentiated after simulated gastrointestinal digestion [J]. Food Chemistry,2012, 131(4):1443-1452
[10]Lucas-gonzalez R, Navarro-coves S, Perez-alvarez J A, et al.Assessment of polyphenolic profile stability and changes in the antioxidant potential of maqui berry (Aristotelia chilensis(Molina) Stuntz) during in vitro gastrointestinal digestion [J].Industrial Crops and Products, 2016, 94:774-782
[11]Oliveira A, Pintado M E. Stability of polyphenols and carotenoids in strawberry and peach yoghurt throughout in vitro gastrointestinal digestion [J]. Food & Function, 2015,6(5):1611-1619
[12]熊云霞.体外模拟消化对苹果和梨的抗氧化活性及抗癌细胞增殖活性影响的研究[D].广州:华南理工大学,2013 XIONG Yun-xia. Study on influence of in vitro digestion on antioxidant and antiproliferative activity of apple and pear[D]. Guangzhou:South China University of Technology,2013
[13]李艳,刘梅森,万红霞,等.高效液相色谱法测定玉米中的游离酚和结合酚[J].中国粮油学报,2015,30(9):108-111 LI Yan, LIU Mei-sen, WAN Hong-xia, et al. Determination of soluble phenolics and bound phenolics in corn by high performance liquid chromatography [J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(9):108-111
[14]Felice D L, Sun J, Liu R H. A modified methylene blue assay for accurate cell counting [J]. Journal of Functional Foods,2009, 1(1):109-118
[15]Santanagálvez J, Cisneroszevallos L, Jacobovelázquez D A.Chlorogenic acid:recent advances on its dual role as a food additive and a nutraceutical against metabolic syndrome [J].Molecules, 2017, 22(3):358
[16]Bouayed J, Deuer H, Hoffmann L, et al. Bioaccessible and dialysable polyphenols in selected apple varieties following in vitro digestion vs. their native patterns [J]. Food Chemistry,2012, 131(4):1466-1472
[17]Le B C, Renard C M. Interactions between polyphenols and macromolecules:quantification methods and mechanisms [J].Critical Reviews in Food Science and Nutrition, 2012, 52(3):213-248
[18]Stéphanieve P, Alfonsgj V, Antoniejwg V, et al. Covalent interactions between proteins and oxidation products of caffeoylquinic acid (Chlorogenic acid) [J]. Journal of the Science of Food & Agriculture, 2007, 87(13):2502-2510
[19]Chandrasekara A, Shahidi F. Bioaccessibility and antioxidant potential of millet grain phenolics as affected by simulated in vitro, digestion and microbial fermentation [J]. Journal of Functional Foods, 2012, 4(1):226-237
[20]Tagliazucchi D, Verzelloni E, Bertolini D, et al. In vitro bio-accessibility and antioxidant activity of grape polyphenols [J]. Food Chemistry, 2010, 120(2):599-606
[21]Rodríguez-roque M J, Rojas-graü M A, Elez-martínez P, et al.Changes in vitamin C, phenolic, and carotenoid profiles throughout in vitro gastrointestinal digestion of a blended fruit juice [J]. Journal of Agricultural and Food Chemistry,2013, 61(8):1859-1867
[22]Frontela C, Ros G, Martnez C, et al. Stability of Pycnogenol as an ingredient in fruit juices subjected to in vitro gastrointestinal digestion [J]. Journal of the Science of Food and Agriculture, 2011, 91(2):286-292
[23]彭梦雪,从彦丽,刘冬.模拟胃肠消化评价苹果多酚、黄酮及抗氧化活性的相关性[J].现代食品科技,2016,32(1):122-128 PENG Meng-xue, CONG Yan-li, LIU Dong. Determination of antioxidant activity and the contents of polyphenols and flavonoids of apples by simulated gastrointestinal digestion[J]. Modern Food Science and Technology, 2016, 32(1):122-128
[24]Tong L, Chuang C C, Wu S, et al. Reactive oxygen species in redox cancer therapy [J]. Cancer letters, 2015, 367(1):18-25
[25]Gupte A, Mumper R J. Elevated copper and oxidative stress in cancer cells as a target for cancer treatment [J]. Cancer Treatment Reviews, 2009, 35(1):32-46
[26]Yi L, Zongyuan Y, Cheng G, et al. Quercetin enhances apoptotic effect of tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) in ovarian cancer cells through reactive oxygen species (ROS) mediated CCAAT enhancer-binding protein homologous protein (CHOP)-death receptor 5 pathway [J]. Cancer Science, 2014, 105(5):520-527
[27]Hotnog D, Mihãilà M, Lancu I V, et al. Resveratrol modulates apoptosis in 5-fluorouracyl treated colon cancer cell lines [J]. Roumanian Archives of Microbiology and Immunology, 2013, 72(4):255-264
[28]Kma L. Synergistic effect of resveratrol and radiotherapy in control of cancers [J]. Asian Pacific Journal of Cancer Prevention, 2013, 14(11):6197-6208
[29]Dhaheri Y A, Attoub S, Ramadan G, et al. Carnosol induces ROS-mediated beclin1-independent autophagy and apoptosis in triple negative breast cancer [J]. PloS One, 2013, 9(10):e109630-e109630

