骨形成蛋白4诱导大鼠H9c2心肌细胞肥大的作用机制
刘亚坤,吕风华,司澳洋,王 卓,吴 林
(1.新乡医学院第一附属医院心内科,河南 卫辉 453100;2.河南大学淮河医院心内科,河南 开封 475000)
心肌肥大是心肌对各种刺激产生的一种适应性反应,其主要病理改变是心肌细胞表型变化、体积增大及蛋白质合成增加。早期肥大有一定的代偿意义,长期肥大则是引发多种心血管疾病和患者死亡的危险因素。目前,心肌肥大的机制尚未完全明确。骨形成蛋白4(bone morphogenetic protein 4,BMP4)是一种分泌性多功能蛋白,是转化生长因子-β(transforming growth factor-β,TGF-β) 超家族的成员之一,在细胞的增殖、分化、迁移、凋亡方面发挥多种作用[1-2]。研究表明,BMP4可诱导病理性心肌肥大[3],其具体机制仍在研究中。磷脂酰肌醇3激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)是膜受体信号向细胞内转导的途径之一,参与细胞的生长代谢、增殖、分化、凋亡等多种生物过程。有研究报道,心脏过表达PI3K的小鼠表现为心肌细胞肥大,Akt可能是重要的下游效应分子[4-5]。自噬是通过包裹待降解物形成自噬体,并与溶酶体融合形成自噬溶酶体,降解所包裹的内容物,以实现细胞本身的代谢需要。研究发现,自噬与心肌肥大关系密切[6-8],但具体作用机制说法不一,故探讨自噬在心肌细胞中的作用对于阐明心肌肥大的分子机制具有一定指导意义。有研究证实,BMP4可能通过激活细胞外信号调节激酶(extracellular regulated kinases,ERK1/2)而诱导大鼠H9c2心肌细胞肥大[9]。本研究以大鼠H9c2细胞为对象,通过BMP4刺激,观察心肌细胞中PI3K、Akt、自噬微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)、脑钠尿肽(brain natriuretic peptide,BNP)及α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达,并探讨PI3K-Akt通路和自噬在心肌细胞中的作用。
1 材料与方法
1.1细胞、试剂与仪器大鼠H9c2心肌细胞株(中国科学院上海细胞库),BMP4、PI3K-Akt抑制剂LY294002(美国PeproTech公司),自噬抑制剂3MA(美国Selleckchem公司),达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胎牛血清(fetal bovine serum,FBS)(美国Gibco公司),2.5 g·L-1胰蛋白酶、青链霉素混合液(北京索莱宝公司),蛋白磷酸酶抑制剂混合物、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium doecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶制备试剂盒、高灵敏度化学发光试剂盒、抗甘油醛3磷酸脱氢酶(glyceraldehyde 3 phosphate dehydrogenase,GAPDH)兔多克隆抗体(北京康为世纪生物技术有限公司),α-SMA抗体(美国Abcam公司)、脑钠尿肽(brain natriuretic peptide,BNP)抗体(南京恩晶生物公司),PI3K-Akt及磷酸化PI3K-Akt信号通路抗体、LC3抗体(美国Cell Signaling Technology公司),山羊抗鼠IgG、羊抗兔-IgG二抗(美国Jackson Immuno Research公司);电转移仪(北京君意东方电泳设备有限公司),Amersham Imager凝胶成像系统(美国通用电器公司)。
1.2方法
1.2.1细胞培养及分组取H9c2细胞接种于含体积分数10% FBS的高糖培养基中常规培养,待细胞生长至约70%融合后用含体积分数1%FBS的培养基培养24 h,使细胞同步化。实验分2部分,第1部分不进行分组,取同步化细胞加50 μg·L-1BMP4 60 μL进行干预,分别在干预后0、1、4、8、12、24 h 测P-Akt蛋白表达;第2部分将同步化的心肌细胞随机分为对照组、BMP4组、BMP4+LY294002组及BMP4+3MA组。对照组细胞应用体积分数1%FBS培养基培养;BMP4组细胞应用含50 μg·L-1BMP4的体积分数1%FBS培养基培养;BMP4+LY294002组细胞先应用含25 μmol·L-1的LY294002预处理120 min,再以含50 μg·L-1BMP4的体积分数1%FBS培养基培养;BMP4+3MA组细胞先用含10 mmol·L-1的自噬抑制剂3MA预处理120 min,再以含50 μg·L-1BMP4的体积分数1%FBS培养基培养。各组细胞在给予BMP4 1 h后检测P-PI3K、P-Akt、LC3蛋白的表达,给予BMP4 48 h后检测BNP、α-SMA蛋白的表达。
1.2.2Westernblot法检测各组大鼠心肌细胞内P-PI3K、P-Akt、LC3、α-SMA及BNP蛋白的表达提取各组细胞总蛋白,按体积比41加入缓冲液,于100 ℃下变性5 min;电泳(浓缩胶90 V,分离胶120 V)。电泳后转至聚偏二氟乙烯膜膜上(250 mA,80 min),三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline tween,TBST)室温封闭2 h;分别加入一抗α-SMA(15 000)、BNP(1100)、LC3(15 000)、PI3K(11 000)、P-PI3K(11 000)、P-Akt(11 000)、Akt(11 000)及GAPDH(110 000),4 ℃过夜。TBST 洗膜3次,每次15 min,加入对应二抗(15 000),室温孵育1 h。加入高灵敏化学发光剂,置入Amersham Imager凝胶成像系统,曝光。应用Image J软件分析目的蛋白条带的灰度值。α-SMA、BNP以GAPDH为标准化,LC3Ⅱ与LC3Ⅰ条带的比值代表LC3蛋白表达水平,P-PI3K、P-Akt以PI3K、Akt进行标准化。
1.2.3细胞表面积测量各组大鼠心肌细胞干预48 h后,倒置显微镜下拍照(×200),每组观察5个视野,每个视野随机选取15个细胞,用Image J软件测量细胞表面积,取均值。
1.2.4BCA法检测各组大鼠心肌细胞总蛋白含量各组细胞干预至预定时间后,4 ℃下2 000 r·min-1离心5 min,弃上清液,磷酸盐缓冲液漂洗3次。将放射免疫沉淀分析蛋白裂解液与蛋白酶抑制剂按991混匀后加入细胞中,轻轻吹打数次,冰上裂解1 h,4 ℃下12 000 r·min-1离心 20 min 取上清液,计算各组体积。以牛血清白蛋白(2 g·L-1)为标准品绘制标准曲线,测定蛋白浓度。根据各组蛋白浓度、体积、细胞计数计算各组细胞中每个细胞的平均蛋白含量。
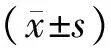
2 结果
2.1各组大鼠心肌细胞表面积及总蛋白含量比较结果见表1。BMP4组大鼠心肌细胞表面积及总蛋白含量高于对照组,差异有统计学意义(P<0.01);BMP4+LY294002组与对照组大鼠心肌细胞表面积及总蛋白含量比较差异无统计学意义(P>0.05);BMP4+3MA组大鼠心肌细胞表面积大于对照组,差异有统计学意义(P<0.01),BMP4+3MA组与对照组大鼠心肌细胞总蛋白含量比较差异无统计学意义(P>0.05);BMP4+LY294002、BMP4+3MA组大鼠心肌细胞表面积及总蛋白含量均低于BMP4组,差异有统计学意义(P<0.05);BMP4+LY294002组与BMP4+3MA组大鼠心肌细胞表面积及总蛋白含量比较差异无统计学意义(P>0.05)。
表1各组大鼠心肌细胞表面积、蛋白含量比较
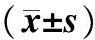

组别n细胞表面积/μm2总蛋白含量/pg对照组3274.27±52.56142.91±14.97BMP4组3593.73±53.72a214.21±19.22aBMP4+3MA组3356.33±47.73ab157.06±11.12bBMP4+LY294002组3256.41±51.31b134.73±13.83b
注:与对照组比较aP<0.01;与BMP4组比较bP<0.05。
2.2BMP4干预后不同时间大鼠心肌细胞内P-Akt蛋白表达结果见图1。BMP4作用于大鼠心肌细胞0、1、4、8、12、24 h后P-Akt蛋白相对表达量分别为0.56±0.02、0.92±0.12、0.42±0.10、0.63±0.11、0.64±0.23、0.29±0.08。BMP4作用于心肌细胞后P-Akt蛋白相对表达量随时间出现先增高后降低的趋势,1 h时达高峰,各时间点P-Akt蛋白相对表达量总体上比较差异有统计学意义(F=10.465,P<0.05);BMP4作用于大鼠心肌细胞1 h时P-Akt蛋白相对表达量均高于其他时间点(P<0.05)。
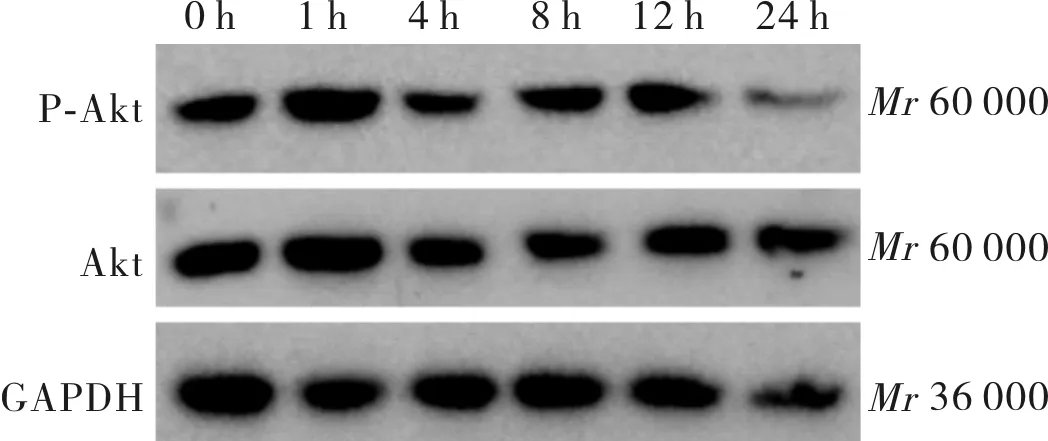
图1BMP4作用不同时间时大鼠心肌细胞内P-Akt蛋白表达(Westernblot)
Fig.1ExpressionoftheP-AktproteinintheratscardiomyocyteatdifferenttimesofBMP4intervention(Westernblot)
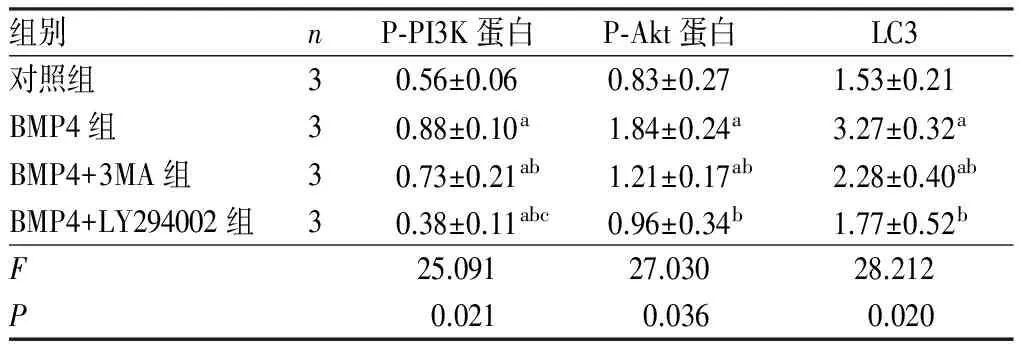
2.3BMP4干预1h后各组大鼠心肌细胞内P-PI3K、P-Akt及LC3蛋白表达结果见图2、图3、图4和表2。BMP4组、BMP4+3MA组大鼠心肌细胞内P-PI3K蛋白表达水平高于对照组,BMP4+LY294002组大鼠心肌细胞内P-PI3K蛋白表达水平低于对照组,差异均有统计学意义(P<0.01);BMP4+3MA组、BMP4+LY294002组大鼠心肌细胞内P-PI3K蛋白表达水平低于BMP4组,差异有统计学意义(P<0.05),BMP4+LY294002组大鼠心肌细胞内P-PI3K蛋白表达水平低于BMP4+3MA组,差异有统计学意义(P<0.05)。BMP4、BMP4+3MA组大鼠心肌细胞内P-Akt蛋白及自噬相关蛋白LC3表达水平高于对照组(P<0.01),BMP4+LY294002组与对照组大鼠心肌细胞内P-Akt蛋白及自噬相关蛋白LC3表达水平比较差异无统计学意义(P>0.05);BMP4+3MA、BMP4+LY294002组大鼠心肌细胞内P-Akt蛋白及自噬相关蛋白LC3表达水平低于BMP4组,差异有统计学意义(P<0.05);BMP4+3MA组与BMP4+LY294002组大鼠心肌细胞P-Akt蛋白及自噬相关蛋白LC3表达水平比较差异无统计学意义(P>0.05)。
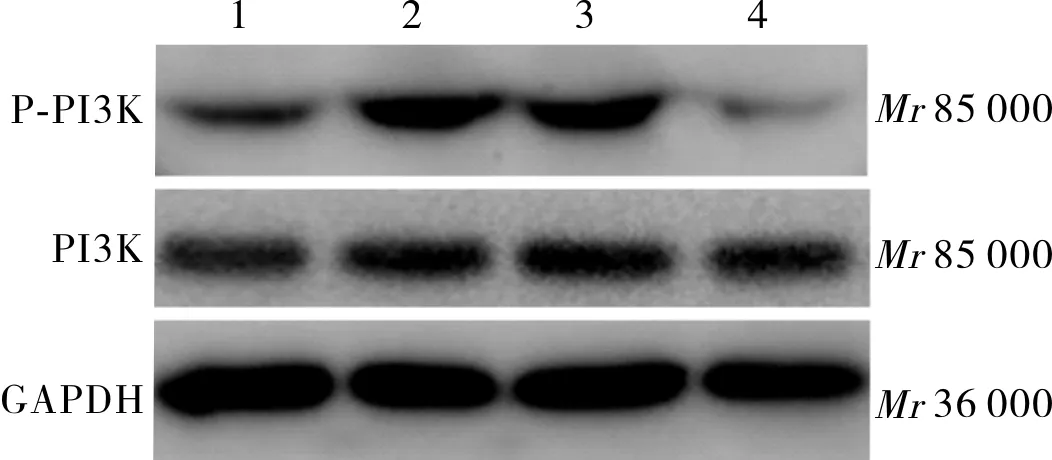
1:对照组;2:BMP4组;3:BMP4+3MA组;4:BMP4+LY294002组。
图2BMP4干预大鼠心肌细胞1h后P-PI3K蛋白表达(Westernblot)
Fig.2ExpressionofP-PI3KproteinafterBMP4interventioninratscardiomyocytesfor1h(Westernblot)
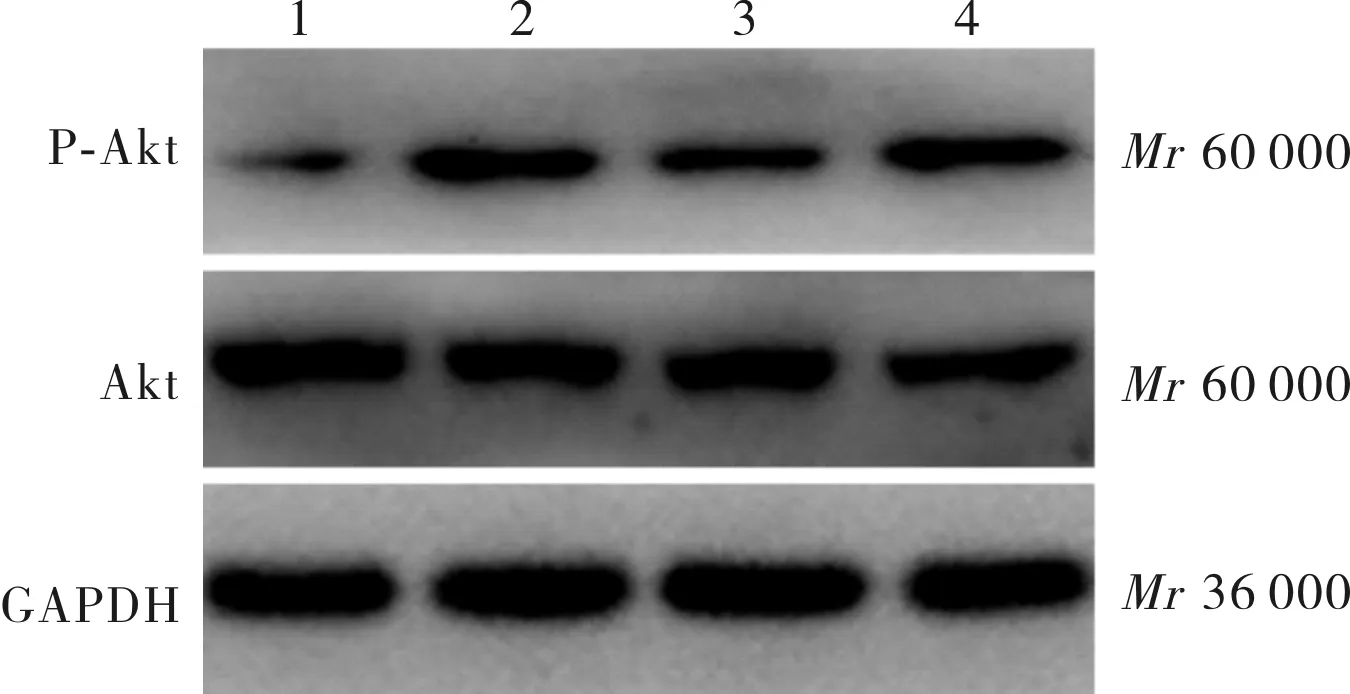
1:对照组;2:BMP4组;3:BMP4+LY294002组;4:BMP4+3MA组。
图3BMP4干预大鼠心肌细胞1h后P-Akt蛋白表达(Westernblot)
Fig.3ExpressionofP-AktproteinafterBMP4interventioninrtascardiomyocytesfor1h(Westernblot)
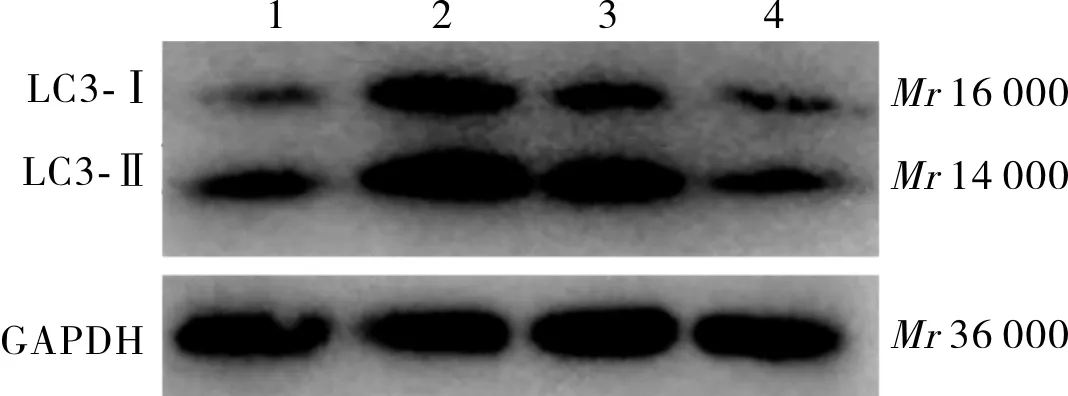
1:对照组;2:BMP4组;3:BMP4+3MA组;4:BMP4+LY294002组。
图4各组大鼠心肌细胞自噬相关蛋白LC3表达(Westernblot)
Fig.4ExpressionofautophagyrelatedproteinLC3inratscardiomyocytesineachgroup(Westernblot)
表2BMP4干预1h后各组大鼠心肌细胞内P-PI3K及P-Akt蛋白表达比较
组别nP⁃PI3K蛋白P⁃Akt蛋白LC3对照组30.56±0.060.83±0.271.53±0.21BMP4组30.88±0.10a1.84±0.24a3.27±0.32aBMP4+3MA组30.73±0.21ab1.21±0.17ab2.28±0.40abBMP4+LY294002组30.38±0.11abc0.96±0.34b1.77±0.52bF25.09127.03028.212P0.0210.0360.020
注:与对照组比较aP<0.01;与BMP4组比较bP<0.05;与BMP4+3MA组比较cP<0.05。
2.4BMP4作用48h后各组大鼠心肌细胞内α-SMA和BNP蛋白表达结果见图5和表3。BMP4组大鼠心肌细胞内α-SMA蛋白表达水平高于对照组,差异有统计学意义(P<0.01);BMP4+3MA、BMP4+LY294002组大鼠心肌细胞内α-SMA蛋白表达水平与对照组比较差异无统计学意义(P>0.05);BMP4+3MA组、BMP4+LY294002组大鼠心肌细胞内α-SMA蛋白表达水平低于BMP4组,差异有统计学意义(P<0.05),BMP4+3MA组大鼠心肌细胞内α-SMA蛋白表达水平高于BMP4+LY294002组,差异有统计学意义(P<0.05)。BMP4、BMP4+3MA组大鼠心肌细胞内BNP蛋白表达水平高于对照组(P<0.01),BMP4+LY294002组大鼠心肌细胞内BNP蛋白表达水平与对照组比较差异无统计学意义(P>0.05);BMP4+3MA、BMP4+LY294002组大鼠心肌细胞内BNP蛋白表达水平低于BMP4组,差异有统计学意义(P<0.05)。
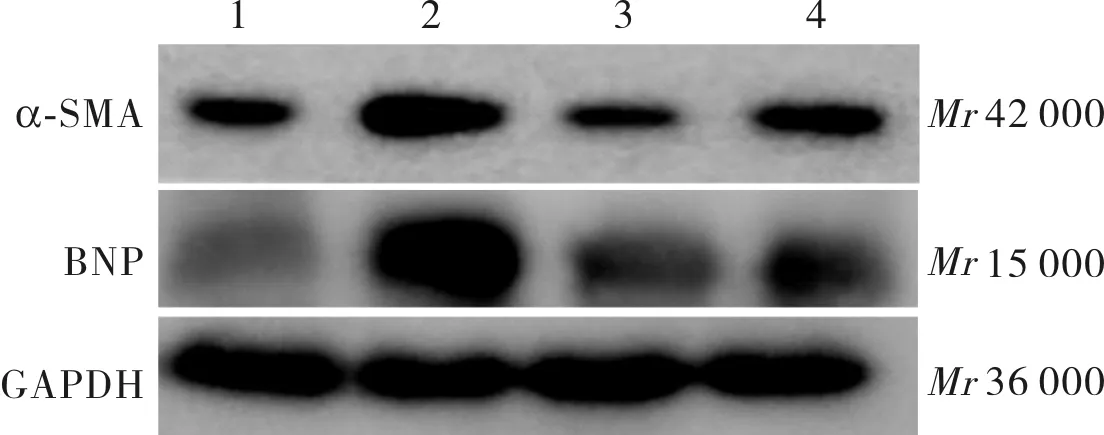
1:对照组;2:BMP4组;3:BMP4+LY294002组;4:BMP4+3MA组。
图5各组大鼠心肌细胞内α-SMA和BNP蛋白表达(Westernblot)
Fig.5Expressionofα-SMAandBNPproteininratscardiomyocytesineachgroup(Westernblot)
表3BMP4作用48h后各组大鼠心肌细胞内α-SMA及BNP蛋白表达比较
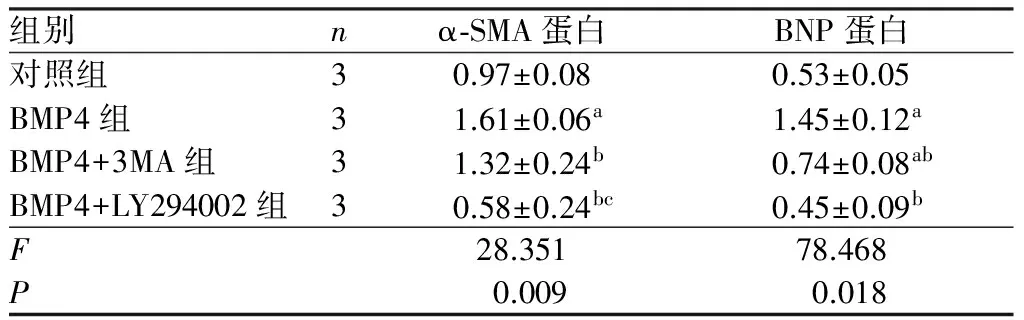
组别nα⁃SMA蛋白BNP蛋白对照组30.97±0.080.53±0.05BMP4组31.61±0.06a1.45±0.12aBMP4+3MA组31.32±0.24b0.74±0.08abBMP4+LY294002组30.58±0.24bc0.45±0.09bF28.35178.468P0.0090.018
注:与对照组比较aP<0.01;与BMP4组比较bP<0.05;与BMP4+3MA组比较cP<0.05。
3 讨论
心肌肥大是多种心血管疾病发展到一定阶段的病理过程,已被公认为是猝死、心律失常等心血管事件的独立危险因素。心肌肥大的本质是核内基因表达改变,如β-肌球蛋白重链、SMA、心房利钠肽(atrial natriuretic peptide,ANP)等基因的表达上调。因此,探讨其发生的病理生理机制,寻找心肌肥大的潜在靶点,对于改善心肌功能及心血管疾病的治疗有重要意义。多种因素均可诱导心肌肥大的发生,如机械应激和神经体液因子、容量及压力负荷的增加、炎症刺激等[10]。BMP4是TGF-β超家族中的一员,最早由OZKAYNAK等[11]从牛成骨蛋白提取物中分离出来,在软骨、骨的形成和修复过程中有独特的诱导活性。SUN等[3]研究发现,BMP4能诱发病理性心肌肥大,在压力负荷构建的病理性心肌肥大模型中BMP4及心肌肥大标志物ANP、BNP表达增加,而在游泳训练导致的生理性肥大小鼠模型中BMP4、ANP及BNP的表达未见明显改变。本研究发现,用50 μg·L-1BMP4刺激大鼠心肌细胞后,BMP4组心肌细胞的细胞表面积明显大于不给予BMP4刺激的对照组,总蛋白含量也高于对照组;同时,BNP、α-SMA表达也高于对照组。而BMP4+LY294002、BMP4+3MA组心肌细胞的细胞表面积、总蛋白含量、BNP表达少于BMP4组。说明LY294002、3MA在一定程度上抑制了心肌肥大的发生。
PI3K-Akt通路是膜受体信号向细胞内转导的重要途径,可介导细胞的生长、增殖和分化。PI3K是一种细胞内蛋白激酶,其是由1个催化亚基p110和1个调节亚基p85构成的异源二聚体。Akt属于丝氨酸-苏氨酸蛋白激酶家族成员,是一种相对分子量为60 000的蛋白质。无活性的调节亚基p85和催化亚基p110复合物存在于细胞质,当受到某些刺激激活后在细胞膜上生成第2信使PIP3,PIP3可使下游分子Akt磷酸化,进一步发挥生物学功能[12-13]。有研究发现,转基因小鼠心脏过表达活性PI3K可引起心肌细胞体积增大,Akt可能是重要的下游效应分子[4]。PI3K-Akt通路的激活及P-PI3K、P-Akt蛋白表达的增高可能是心肌肥厚发生的机制[5]。WU等[14]研究发现,BMP4可通过激活PI3K-Akt通路而减少肺动脉平滑肌细胞凋亡。本研究以50 μg·L-1BMP4刺激大鼠心肌细胞不同时间后发现,P-Akt蛋白表达在1 h达到高峰,随后呈下降趋势。同时还发现,BMP4作用于大鼠心肌细胞1 h时,BMP4组大鼠心肌细胞内P-PI3K、P-Akt蛋白表达水平明显高于对照组,而BMP4+LY294002组大鼠心肌细胞内P-PI3K、P-Akt蛋白表达变化不明显,提示BMP4可能是在早期通过激活PI3K-Akt通路而诱导心肌细胞肥大。
自噬的主要生理功能是将胞质中的大分子物质和一些细胞内源性底物在单位膜包裹的囊泡中大量降解,实现再循环,以维持内环境自身的稳定。自噬在维持心肌细胞大小、结构和功能等方面发挥重要作用[15-16]。有研究表明,心肌肥大和心脏衰竭中自噬增加[17]。NAKAI等[6]研究表明,自噬基因Atg7敲除后大鼠心肌细胞进一步肥大,提示抑制自噬可能诱导心肌细胞肥大。而ZHU等[7]采用主动脉缩窄法建立了心力衰竭小鼠模型,结果显示,病理状态下心肌细胞自噬能诱导细胞肥大,在心肌缺血再灌注时能够诱导心肌细胞自噬,从而增加对心肌的保护作用,因此,在不同诱导因素及心肌肥大的不同阶段,自噬发挥的作用可能不同,具体机制仍待进一步研究。本研究发现,在BMP4诱导大鼠心肌细胞肥大的过程中自噬活性增加,自噬相关蛋白LC3表达水平明显增高。BMP4+3MA组大鼠心肌细胞内LC3蛋白表达降低,自噬活性降低,该组大鼠心肌细胞表面积及BNP表达较BMP4组少,提示BMP4可能通过激活自噬而诱导心肌肥大。
BMP4诱导大鼠心肌细胞肥大可能与激活PI3K-Akt信号通路有关,而特异性抑制剂LY294002可减弱BMP4诱导的心肌肥大。同时,心肌肥大中的自噬受到激活,而抑制自噬可以减少心肌肥大的发展,提示自噬可能也是BMP4诱导心肌肥大的一个因素。本研究在一定程度上丰富了心肌肥大的分子机制,为临床提供一定的理论基础,也为心肌肥大的预防及治疗提供新的方向。
参考文献:
[1] 王涛,康涛,雷琦,等.重组人骨形成蛋白成熟肽4对急性放射损伤小鼠造血系统的修复作用[J].新乡医学院学报,2017,34(12):1043-1047.
[2] RIDER C C,MULLOY B.Bone morphogenetic protein and growth differentiation factor cytokine families and their protein antagonists[J].BiochemJ,2010,429(1):1-12.
[3] SUN B,HUO R,SHENG Y,etal.Bonemorphogenetic protein-4 mediates cardiac hypertrophy,apoptosis,and fibrosis in experimentally pathological cardiac hypertrophy[J].Hypertension,2013,61(2):352-360.
[4] SHIOI T,KANG P M,DOUGLAS P S,etal.The conserved phosphoinositide 3-kinase pathway determines heart size in mice[J].EMBOJ,2000,19(11):2537-2548.
[5] 穆灵敏,王文锋,郭志坤,等.PI3K和Akt蛋白在异丙肾上腺素所致大鼠心肌肥厚中的表达[J].四川动物,2010,29(4):560-562.
[6] NAKAI A,YAMAGUCHI O,TAKEDA T,etal.The role of autophagy in cardiomyocytes in the basal state and in response to hemodynamic stress[J].NatMed,2007,13(5):619-624.
[7] ZHU H,ROTHERMEL B A,HILL J A.Autophagy in load-induced heart disease[J].MethodsEnzymol,2009,453:343-363.
[8] MEI Y,THOMPSON M D,COHEN R A,etal.Autophagy and oxidative stress in cardiovascular diseases[J].BiochimBiophysActa,2015,1852(2):243-251.
[9] 陶业珍,李华旭,袁宇.骨形成蛋白4通过激活ERK1/2信号通路诱导大鼠H9C2心肌细胞肥大的机制[J].医学研究生学报,2016,29(2):153-158.
[10] 姜志胜.心肌肥大过程中的信号转导[J].中国动脉硬化杂志,2005,13(2):125-128.
[11] OZKAYNAK E,RUEGER D C,DRIER E A,etal.OP-1 cDNA encodes an osteogenic protein in the TGF-β family[J].EMBOJ,1990,9(7):2085-2093.
[12] XIAO L,GONG L L,YUAN D,etal.Protein phosphatase-1 regulates Akt1 signal transduction pathway to control gene expression,cell survival and differentiation[J].CellDeathDiffer,2010,17(9):1448-1462.
[13] COSTA C,HIRSCH E.More than just kinases:the scaffolding function of PI3K[J].CurrTopMicrobiolImmunol,2010,346:171-181.
[14] WU J,YU Z,SU D.BMP4 protects rat pulmonary arterial smooth muscle cells from apoptosis by PI3K/AKT/Smad1/5/8 signaling[J].IntJMolSci,2014,15(8):13738-13754.
[15] PRZYKLENK K,UNDYALA V V,WIDER J,etal.Acute induction of autophagy as a novel strategy for cardioprotection:getting to the heart of the matter[J].Autophagy,2011,7(4):432-433.
[16] 池瑞芳,田晶,李保,等.心肌细胞自噬在心室重构中的作用[J].中华心血管病杂志,2015,43(3):285-288.
[17] GUO R,HU N,KANDADI M R,etal.Facilitated ethanol metabolism promotes cardiomyocyte contractile dysfunction through autophagy in murine hearts[J].Autophagy,2012,8(4):593-608.

