AMPK蛋白对骨肉瘤MG-63细胞的影响
王江波,王春生
(沈阳军区总医院附属北方医院,辽宁 沈阳110031)
腺苷酸活化蛋白激酶(AMPK) 作为细胞能量代谢的调控因子,有望成为肿瘤治疗的新靶点[1]。AMPK是一个由α、β、γ三个亚基构成的异源三聚体蛋白,每个亚基又分别由不同基因编码的α1,α2,β1,β2,γ1-γ3亚型[2]。AMPK的主要上游激酶分别是钙调激酶K(CaMKK)和抑癌激酶(LKB1),LKB1/AMPK 途径在杀伤肿瘤细胞方面发挥作用,包括肺癌、前列腺癌、乳腺癌等[3-5]。本研究应用AMPK激动剂AICAR和AMPK抑制剂Compound C考察AMPK对人骨肉瘤细胞株MG-63凋亡的影响,探讨AMPK激活诱导骨肉瘤细胞株MG-63凋亡的机制。
1 材料与方法
1.1 主要试剂与仪器
四甲基偶氮唑蓝(MTT)、AICAR、 Compound C均购自美国Sigma公司,Annexin V /PI双染试剂盒购于天津三箭生物技术有限公司。RPMI 1640、胎牛血清、胰酶购自美国Gibco公司。细胞培养箱、酶标仪购于日本三洋公司,倒置显微镜购于日本OLYMPUS公司,电泳和转膜装置购于美国伯乐,流式细胞仪购于美国BD公司。
1.2 细胞株与细胞培养
骨肉瘤MG-63细胞株购于中国科学院细胞库。培养于RPMI1640培养基中,内含10%胎牛血清、青霉素(100 U/ml)和庆大霉素(40 U/ml),于恒温培养箱中培养(37℃、5%CO2),当细胞生长至80%-90%融合时,0.25%胰酶消化传代。当细胞生长至对数生长期时进行实验。
1.3 MTT法检测细胞活性
将MG-63细胞种于96孔板,密度5×103/ml,每孔加200 μl培养基,孵育24 h后,加入不同浓度药物,作用24小时后,去上清,加入90 μl新鲜培养液及10 μl MTT溶液,培养4小时,去上清后,每孔加入二甲基亚砜100 μl,低速振荡10 min,充分溶解结晶物。490 nm波长测定吸光度值。实验重复 3次。
1.4 Western blotting检测蛋白表达
经药物作用后的MG-63细胞,加入RIPA裂解,收集细胞裂解液,进行SDS-PAGE电泳。浓缩胶浓度5%,分离胶浓度15%,电压设置为浓缩胶80V分离胶220V,100V恒压转至PVDF膜上,以5%脱脂奶粉封闭2 h,TBST洗膜3次,每次15 min,一抗低温孵育过夜(Cleaved Caspase-3抗体,Cell Signaling公司,稀释比例1∶800),TBST洗膜3次,每次15 min,二抗室温孵育2 h(Cell Signaling公司,稀释比例1∶5 000),TBST洗膜3次,每次15 min,ECL显影。
1.5 流式细胞仪检测细胞凋亡
按照Annexin V-FITC细胞凋亡检测试剂盒说明书简要步骤如下,胰酶消化收集细胞,PBS洗涤细胞2次,加入500 μl的Binding Buffer悬浮细胞,加入5 μl Annexin V-FITC混匀后,加入5 μl Propidium Iodide,混匀。室温、避光、反应15 min加入200 μl结合缓冲液后通过流式细胞仪检测进行定量评价细胞凋亡。FITC-/PI-代表正常的细胞,FITC+/ PI-代表早期凋亡细胞,FITC+/ PI+代表晚期凋亡细胞,FITC-/PI+代表坏死细胞。
1.6 统计学方法
数据分析利用SPSS16.0软件。数据以均值±标准差表示 ,实验数据采用ANOVA进行分析,多组均数间比较采用最小显著差数法(LSD),P<0.05认为具有统计学意义。
2 结果
2.1 AICAR对MG-63细胞活性的影响
当用不同浓度AICAR(200、500、1 000、2 000 μM) 处理MG-63细胞24 h后,MTT法检测细胞活性,结果如图1所示,MG-63细胞活性呈浓度依赖性地显著下降,当AICAR浓度到2 000 μM时,细胞活性下降到50%左右,结果表明,AICAR可降低MG-63细胞生存率。
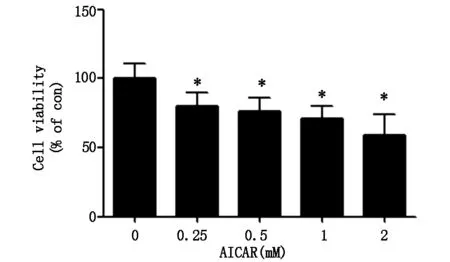
*代表与对照组相比较有统计学差异
2.2 Compound C对MG-63细胞活性的影响
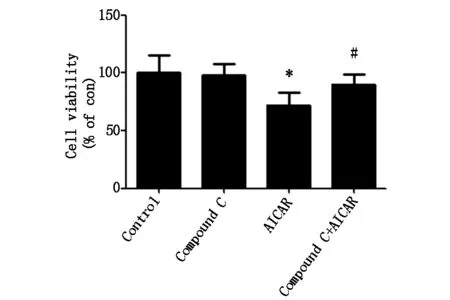
当用不同浓度Compound C(2、4、8、16 μM) 处理MG-63细胞24 h后,MTT法检测细胞活性,结果如图2A所示,细胞活性无显著变化,因此我们选择4 μM 作为Compound C安全给药浓度。当用4 μM 的Compound C预先处理MG-63细胞2 h后,再加入1 mM的AICAR共同作用24 h后,MTT结果如图2B所示,二者联用组与AICAR单独处理组相比,细胞活性明显增加。结果提示,AMPK活性被Compound C抑制后可以改善MG-63的细胞活性。
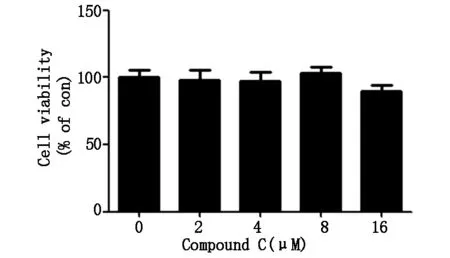
*代表与对照组相比较有统计学差异
2.3 AMPK激动剂和抑制剂对MG-63细胞凋亡相关蛋白的影响
上述结果表明AICAR具有降低MG-63细胞生存率的作用,Compound C可以扭转AICAR的作用。为了检测AMPK活性的改变是否会诱导MG-63细胞凋亡,我们检测了凋亡蛋白caspase-3及PARP蛋白表达。western blotting检测结果如图3A和3B所示,Compound C组(4 μM) cleaved caspase-3及cleaved PARP蛋白表达水平无明显改变,AICAR组(1 mM)明显上调了二者的表达,而当预先用Compound C处理后,二者联用组的蛋白表达水平与AICAR组比较显著降低。结果表明,AMPK活性增加诱导MG-63细胞凋亡。
*代表与对照组相比较有统计学差异,#代表与AICAR组相比有统计学差异(下同)
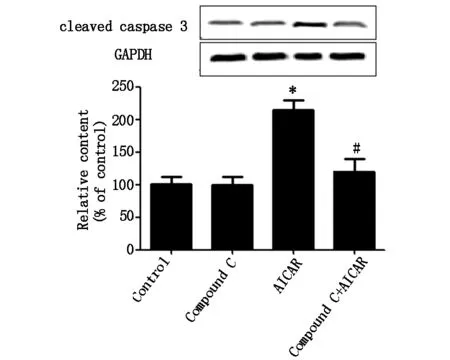
图3A AICAR和(或)Compound C对MG-63细胞cleavedcaspase-3蛋白表达的影响
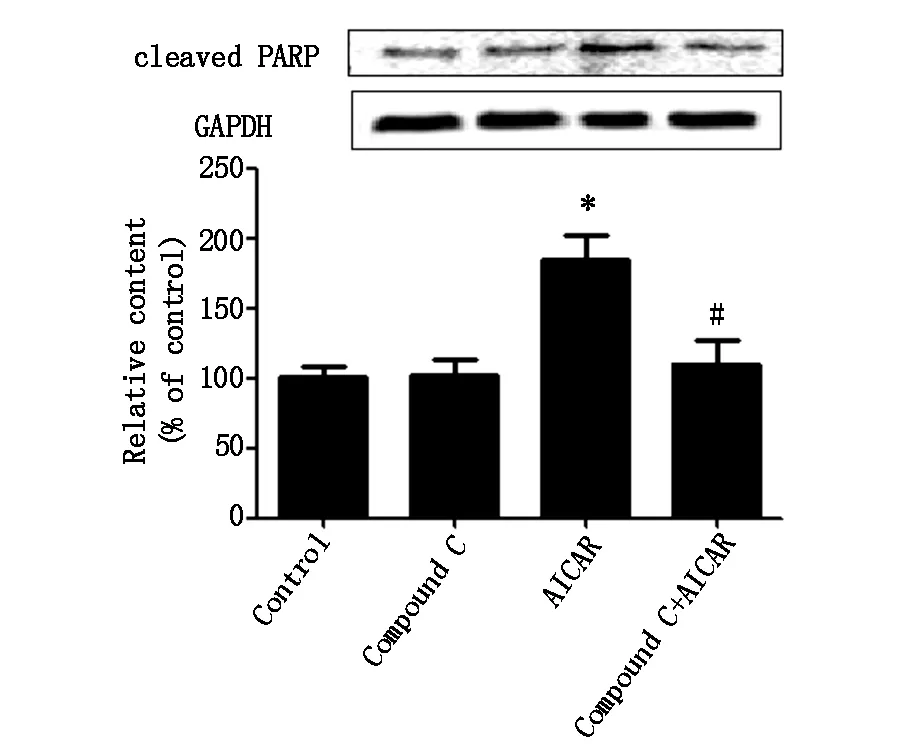
图3B AICAR和(或)Compound C对MG-63细胞cleavedPARP蛋白表达的影响
2.4 AMPK激动剂和抑制剂对MG-63细胞凋亡率的影响
为进一步考察AMPK活性改变对MG-63细胞凋亡的影响,我们将MG-63细胞经过Annexin V-FITC和PI染料双染后,进行流式细胞仪检测。结果如图4柱状图所示,Compound C组(4 μM)对MG-63细胞早期凋亡率未产生显著影响,AICAR组(1 mM) 早期凋亡细胞占50%左右,二者联用组的细胞早期凋亡率与AICAR组比较显著降低。结果进一步表明AMPK活性增加可以诱导MG-63细胞凋亡。
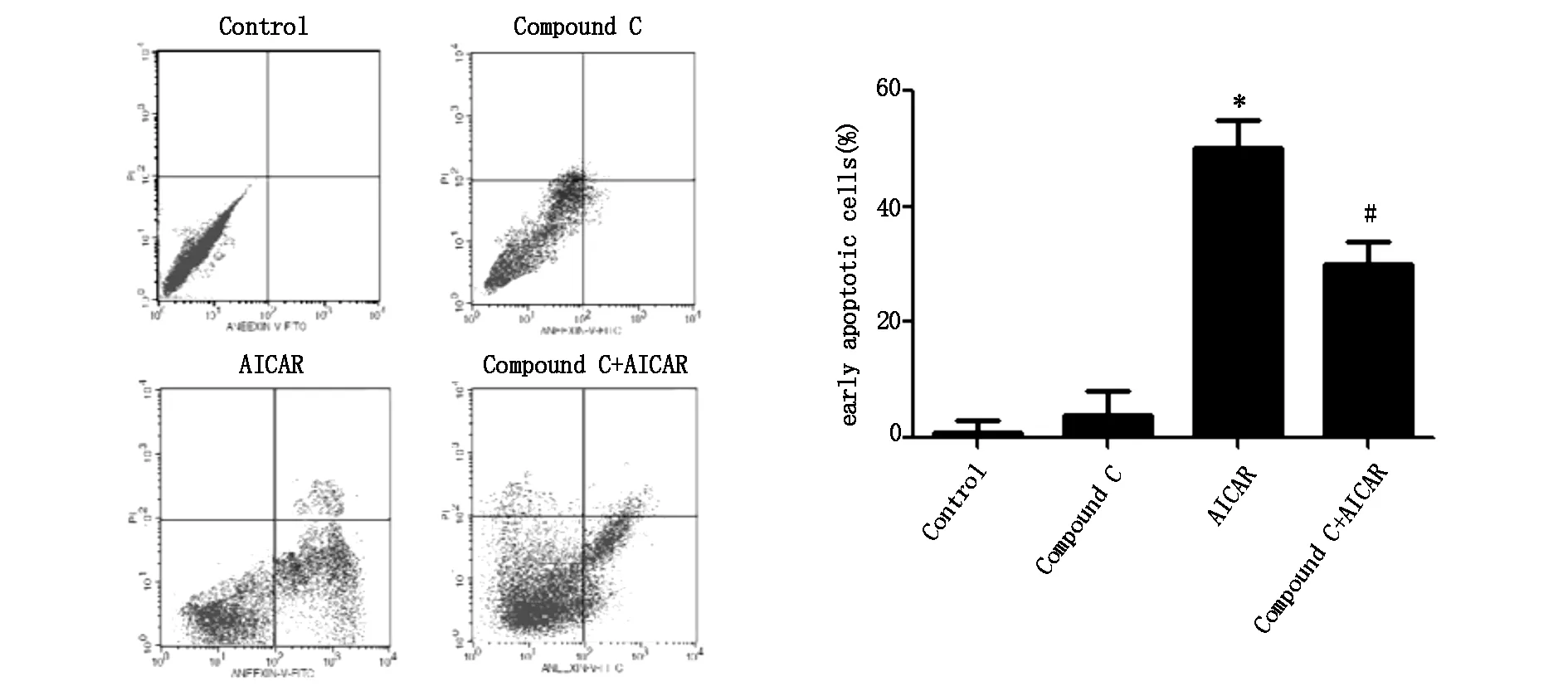
图4 AICAR和(或)Compound C对MG-63细胞凋亡率的影响
3 讨论
骨肉瘤是常见的起源于间叶组织的恶性肿瘤。目前主要的治疗手段为手术、放化疗等多种治疗手段,但肿瘤细胞的耐药性,以及化疗药物的毒副作用限制了化疗药物的应用。因此开发新的化疗药物可为骨肉瘤以及其他癌症治疗开辟新的道路。研究发现,AMPK激动剂AICAR可能成为一种潜在的治疗癌症的化疗药物。它是一种腺苷类似物,目前被广泛应用于对 AMPK 的研究领域。AICAR不仅可以抑制多种肿瘤细胞的生长,使细胞停滞于Gl期[6],而且可能通过激活AMPK、调控P27蛋白磷酸化诱导细胞凋亡[7]。
本实验旨在考察AMPK蛋白对骨肉瘤细胞株MG-63凋亡影响,结果表明当给与AMPK激动剂AICAR处理后,MG-63细胞细胞活性显著降低,凋亡明显增加。为进一步验证AMPK是可能引起凋亡的靶蛋白,AMPK抑制剂Compound C与AMPK激动剂AICAR共同处理后, AICAR的效应被逆转,这些结果表明,激活AMPK是导致MG-63细胞凋亡的靶蛋白之一。这与AMPK诱导肿瘤细胞凋亡的其它研究结果相吻合,AMPK导致MG-63细胞凋亡的具体机制仍有待进一步研究。
综上所述,激活AMPK能够诱导骨肉瘤MG-63细胞株凋亡,AMPK可能作为化疗药物的潜在作用靶点,因此AMPK激动剂有希望成为新一代骨肉瘤治疗药物。
参考文献:
[1]牛耿明,楼文晖.蛋白激酶AMPK家族与肿瘤的关系[J].外科理论与实践,2009(4):462.
[2]Stapleton D,Mitchelhill KI,Gao G,et al.Mammalian Amp-activated Protein Kinase Subfamily[J].Journal of Biological Chemistry,1996,271(2):611.
[3]Jun Li,Ping Jiang,Megan Robinson,et al.Ampk-β1 Subunit Is a P53-independent Stress Responsive Protein That Inhibits Tumor Cell Growth Upon Forced Expression[J].Carcinogenesis,2003,24(5):827.
[4]Xiaoqin Xiang,Asish K Saha,Rong Wen,et al.Amp-activated Protein Kinase Activators Can Inhibit the Growth of Prostate Cancer Cells By Multiple Mechanisms[J].Biochemical and Biophysical Research Communications,2004,321(1):161.
[5]Johannes V Swinnen,Annelies Beckers,Koen Brusselmans,et al.Mimicry of a Cellular Low Energy Status Blocks Tumor Cell Anabolism and Suppresses the Malignant Phenotype[J].Cancer Research,2005,65(6):2441.
[6]Ramandeep Rattan,Shailendra Giri,Avtar K Singh,et al.5-aminoimidazole-4-carboxamide-1-β-d-ribofuranoside Inhibits Cancer Cell Proliferation in Vitro and in Vivo Via Amp-activated Protein Kinase[J].Journal of Biological Chemistry,2005,280(47):39582.
[7]Arnaud Besson,Mark Gurian-west,Xueyan Chen,et al.A Pathway in Quiescent Cells That Controls P27kip1 Stability,Subcellular Localization,and Tumor Suppression[J].Genes & Development,2006,20(1):47.

