人参皂苷Rg5通过下调Bcl-2蛋白促进食管癌Eca-109细胞凋亡
张道明,张 奇,刘林林,任 辉
(吉林大学第二医院,吉林 长春130041)
食管癌是世界上最常见的恶性肿瘤之一,具有较高的致死率,每年导致超过40万人死亡,是消化系统中仅次于胰腺癌的难治性恶性肿瘤[1]。目前的主要治疗方法包括手术治疗,放疗,化疗和靶向治疗。手术切除仍是其主要治疗方法,但5年总生存率仅为30%左右,其中约20%-50%归因于鳞状细胞癌[2]。传统的化疗药物对于食管癌的治疗作用不理想,近几十年随着顺铂和氟尿嘧啶类衍生物、奈达铂、希罗达、伊立替康等新药的应用,为食管癌的化疗提供了更多的可选择方案,在临床应用中起到了一定积极作用。
近年来中药在恶性肿瘤防治方面的价值得到认可。有学者根据不同症型配置个体的中药汤剂应用于患者的辅助治疗中,起到了增加疗效、减轻副作用、改善生存质量等作用[3,4]。目前已经上市的中药有参一胶囊、康莱特注射液、消癌平、鸦胆子油等,在临床应用中也取得了可喜的疗效。人参皂苷Rg5是从人参中分离出来的新型人参皂苷,在肿瘤治疗中具有巨大潜力。本研究通过体外实验观察其对于食管癌细胞的影响并研究相关机制。
1 材料与方法
1.1细胞和药物选取食管癌高分化鳞状细胞Eca-109进行实验。人参皂苷Rg5购至上海源叶生物科技有限公司,分子式为C42H70O12,经纯度验证为99.3%。
1.2主要试剂和仪器RPMI 1640培养基购于Hyclone 公司,胎牛血清购至NQBB公司。CCK8 试剂盒来自日本同仁化学研究所,Annexin V/FITC凋亡试剂盒购于康润生物试剂有限公司。彩色预染蛋白质marker和RIPA裂解液使用全式金生物试剂有限公司,BCA蛋白定量试剂盒购至索莱宝生物科技有限公司产品。兔抗人C-caspase 3,9、C-parp多克隆抗体以及Bax、Bcl-2多克隆抗体来自美国Cell Signaling Technology公司。酶标抗兔二抗来自武汉伊莱瑞特生物科技有限公司。
1.3细胞培养在100 mm的培养皿中用含有1%的青霉素链霉素双抗和10%胎牛血清的RPMI-1640培养基进行细胞的培养,在37℃含5%二氧化碳的恒温箱中培育。传代时首先弃去培养基,用磷酸缓冲盐溶液(PBS)清洗2次,加入2 ml 0.25%的胰酶,在37℃恒温箱中消化3-5分钟,待可观察到细胞与细胞之间有针孔样缝隙时弃去胰酶,加入4 ml培养基,用枪头吹打重悬细胞。收集细胞于离心管中,离心后弃去上清,重新加入6 ml培养基,按照1∶2—1∶4 比例传代于新培养皿中。
1.4CCK8检测细胞抑制率将Eca-109细胞重悬后将浓度调节至4×104/ml,以每孔100 μl的量接种于96孔板中,恒温孵育箱中孵育24小时。设置人参皂苷Rg5药物浓度为:16 μmol/L、8 μmol/L、4 μmol/L、2 μmol/L、1 μmol/L、0.5 μmol/L;每个浓度设置5个副孔并且设置不加药物的对照组和不含细胞的空白组。恒温孵育24小时后在每孔加入10 μl CCK8试剂,孵育2-4小时。之后在酶标仪上450 nm处读取吸光度OD值。细胞抑制率计算公式:细胞抑制率=(对照组OD-加药组OD)/(对照组OD-空白组OD)×100%。并利用SPSS软件计算人参皂苷Rg5的半数抑制浓度(IC50)。
1.5AnnexinV/FITC双染检测细胞凋亡设置以下分组:对照组(不加药)、低浓度组(5 μmol/L Rg5)、中浓度组(10 μmol/L Rg5)和高浓度组(20 μmol/L Rg5)。药物作用24小时后收集细胞,用已稀释的1×缓冲液将细胞浓度调节大约(1-5)×106/ml,并取100 μl置入流式管中,加入5 μl Annexin V/FITC充分混合,避光孵育5分钟之后加入10 μl 20 μg/ml的PI和400 μl的PBS,立刻通过流式细胞仪进行检测。
1.6Westernblot法检测蛋白变化按照同上分组处理细胞,24小时后收集细胞,进行总蛋白提取并使用BCA法确定蛋白浓度进行定量。进行SDS-PAGE凝胶电泳,之后通过湿转的方法将蛋白转移至PVDF膜,使用5%脱脂奶粉封闭2小时。加入C-caspase3、C-caspase9、C-parp、Bcl-2、Bax对应的稀释多克隆抗体,4℃过夜孵育。洗膜后加入二抗摇床孵育1小时。再次洗膜后通过显色仪器进行ECL显影。Imagine J软件测量条带灰度值,并以目的蛋白和β-actin积分光密度比值作为蛋白相对量进行比较。
1.7统计分析数据用平均值±标准偏差进行表示。 统计处理使用SPSS 22.0软件。单因素方差分析比较组间差异,两组比较运用t检验。检验结果P<0.05即有统计学差异。
2 结果
2.1人参皂苷Rg5抑制Eca-109细胞增殖结果得出人参皂苷Rg5抑制Eca-109细胞增殖,并呈剂量依赖性。通过SPSS软件计算,人参皂苷Rg5的IC50为8.74 μmol/L,如图1。
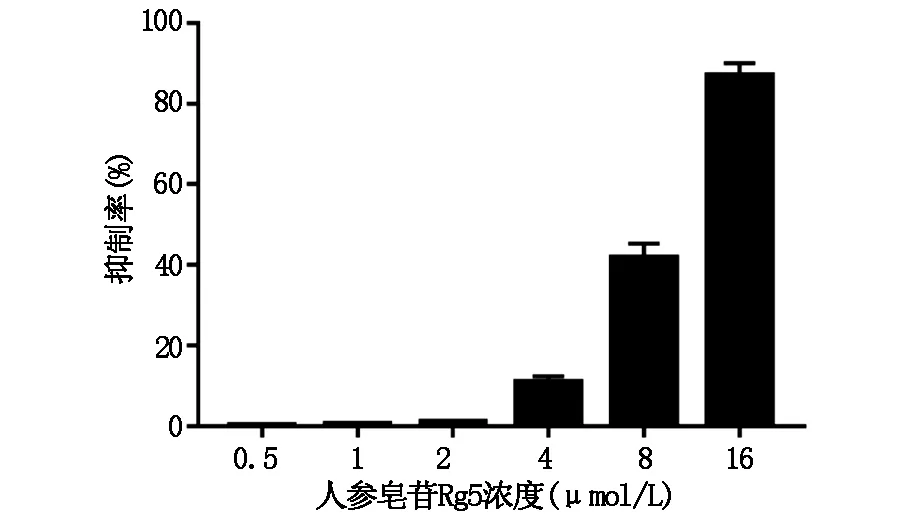
图1 人参皂苷Rg5对食管癌细胞生长的影响
2.2人参皂苷Rg5促进Eca-109细胞凋亡通过流式细胞仪检测细胞凋亡得出:空白组细胞凋亡率为(3.87±2.24)%,且Rg5低浓度组为(11.37±3.52)%,中浓度组为(23.68±3.18)%,高浓度组为(32.17±4.54)%,均高于对照组(P<0.05)。可得出人参皂苷Rg5可促进Eca-109细胞凋亡,并与药物剂量正向相关,如图2和表1。
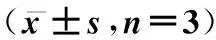
表1 各组细胞凋亡率
注:*表示与对照组相比,P<0.05;
2.3人参皂苷Rg5导致caspase家族蛋白变化通过蛋白印迹法分析结果提示处理后细胞中剪切活化的caspase 3、9表达量随着药物浓度升高而升高,同时caspase家族的下游效应蛋白C-parp也明显增多,如图3。
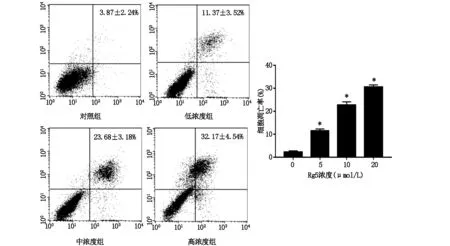
图2 各组细胞凋亡流式图
注:*表示与对照组相比,P<0.05;
2.4人参皂苷Rg5导致细胞Bcl-2蛋白表达下降Western blot法检测蛋白结果提示,Bcl-2家族中的促凋亡蛋白Bax没有明显变化,抑制凋亡蛋白Bcl-2降低,因此人参皂苷Rg5导致 Bcl-2/Bax比值下降,且统计学有差异(P<0.05),如图4。

注:*表示与对照组相比,P<0.05;
3 讨论
人参是中国珍贵的中草药,人参皂苷是其发挥药理作用主要的成分。相关研究已经证实人参皂苷通过促进细胞凋亡途径发挥抗肿瘤作用。据报道,人参提取物JRS-15可通过线粒体途径促进宫颈癌细胞的凋亡[5]。人参皂苷Rg3诱导人胶质细胞瘤细胞凋亡作用和MEK信号通路调控有关[6]。本实验通过体外细胞实验发现人参皂苷Rg5对于食管癌细胞有较强的抑制生长的作用,同时对于食管癌细胞有明显的促凋亡作用。
Bcl-2家族蛋白在调节细胞生长及凋亡等生物学行为有重要作用,根据功能和结构的不同主要分为促凋亡蛋白Bax、Bad、Bid等和抗凋亡蛋白Bcl-2、Bcl-x等,其中Bcl-2和Bax的相对含量决定着细胞凋亡和生长与否。正常情况下,两者结合为异源二聚体,Bax抑制细胞凋亡进程。当细胞接受到凋亡信号刺激后,Bax表达量增高,Bcl-2表达量受到抑制,同时Bax聚集到线粒体膜上形成同源二聚体,导致氧化磷酸化破坏、线粒体膜通透性降低和DNA合成障碍等生化行为,同时参与caspase家族生物学活动[7]。到本实验中,我们将被不同浓度的人参皂苷Rg5处理过的细胞进行蛋白提取并进行Western blot方法检测蛋白,结果提示人参皂苷Rg5处理后细胞中剪切活化的caspase 9、3和C-parp表达量明显升高,同时Bcl-2家族中的促凋亡蛋白Bax没有明显变化而Bcl-2表达量明显降低。这说明人参皂苷Rg5对于食管癌细胞的促凋亡作用和Bcl-2家族蛋白中抑制凋亡蛋白Bcl-2的下调有关。
综上所述,人参皂苷Rg5处理食管癌细胞Eca-109后可导致细胞凋亡,并且凋亡相关蛋白C-caspase 9、C-caspase3和C-parp表达升高,进一步证实了凋亡行为的发生。同时凋亡的发生和下调抗凋亡蛋白Bcl-2有关。后续将进行其他类型肿瘤的作用以及相关机理的研究,为人参皂苷Rg5作为新型抗肿瘤药物的可行性提供更多理论依据。
参考文献:
[1]李 克,于 萍,朱远锋,等.中国南方沿海食管癌高发区危险因素研究:吸烟作用[J].肿瘤,2002,22(2):96.
[2]Zhang SW,Zheng RS,Zuo TT,et al.Mortality and survival analysis of esophageal cancer in China [J].Chin J Oncol,2016,38 (9):709.
[3]宋国平,李雯燕,郭平华,等.自拟滋阴解毒方治疗食管癌放射损伤58例[J].中国中医药信息杂志,2008,15(3):74.
[4]赵 军,陈桂珍,蒙家祥,等.艾迪注射液联合同步放化疗治疗食管癌[J].现代肿瘤医学,2011,19(11):2211.
[5]Sun C,Guo XX,Zhu D,et al.Apoptosis is induced in cancer cells via the mitochondrial pathway by the novel xylocydine-derived compound JRS-15[J].International Journal of Molecular Sciences,2013,14(1):850.
[6]Choi YJ,Lee HJ,Kang DW et al.Ginsenoside Rg3 induces apoptosis in the U87MG human glioblastoma cell line through the MEK signaling pathway and reactive oxygen species[J].Oncology Reports,2013,30(3):1362.
[7]Schafer B,Quispe J,Choudhary V,et al.Mitochondrial outer membrane proteins assist Bid in Bax-mediated lipidic pore formation [J].Mol Biol Cell,2009,20 (8):2276.

