Xpert MTB/RIF和荧光定量PCR在痰液标本中快速检测结核分支杆菌的比较
杜 鹏,郑文斌,卢留珠,吴健虹,张 琦,吕纯芳,张 涛
(深圳市南山区慢性病防治院,广东 深圳518054)
结核病作为全球最严重的公共卫生威胁,世界卫生组织发布的2015年全球结核病报告显示结核菌的感染率首次逼近艾滋病,2014年共有960万新发结核病病例,150万人死于结核病,其中40万人同时感染了艾滋病毒。我国2014年新发结核病病例93万,仅次于印度与印度尼西亚而位居全球第三[1]。结核病防控的一个重要方面是快速、有效诊断。2010年12月,WHO推荐Xpert MTB/RIF(Xpert)作为结核病的快速诊断及对利福平的耐药性检测,它不仅具有高敏感性与特异性,并且能在2小时内完成检测。Xpert以半巢式实时定量PCR扩增技术为基础,根据rpoB的利福平耐药决定区(RRDR)设计引物与探针,所以能同步检测是否为利福平耐药菌株。荧光定量PCR作为另一种在全球结核病诊断中广泛应用的核酸扩增检测(NAAT)技术,国产荧光定量PCR检测方法与Xpert的比较评估不多,本研究旨在以MGIT960结核菌培养为金标准,比较Xpert和国产荧光定量PCR在结核病快速检测方面的应用,为基层实验室在结核病快速核酸检测方法的选择提供参考。
1 材料与方法
1.1标本收集收集2014年7-2015年8月在深圳市南山区慢性病防治院肺科门诊就诊患者的痰标本183份。年龄范围16-81岁,男121份,女62份;初诊170份,复诊13份。
1.2主要试剂和仪器Xpert MTB/RIF检测系统与试剂(美国 Cepheid),抗酸染色试剂(珠海贝索),显微镜(奥林巴斯),BACTEC MGIT 960系统及试剂(美国 BD),荧光定量PCR仪(Lightcycler 480Ⅱ,罗氏),结核分枝杆菌核酸检测试剂盒(湖南圣湘)。
1.3方法
1.3.1标本留取 每个患者要求送早、晚、随机痰液标本三份,挑取痰液质量好的部分用于涂片镜检,余下的痰液混匀,一份用于Xpert检测,一份用于BACTEC MGIT 960的培养,一份用于结核杆菌荧光定量PCR的检测。
1.3.2Xpert检测方法 取1 ml痰标本加入有螺旋盖的50 ml离心管中,加入两倍痰标本体积的样本处理液(Sample Reagent),涡旋振荡20 s左右,直至无肉眼可见块状痰。室温放置15 min,使痰液充分消化,用无菌吸管吸取2 ml处理后痰液,缓慢加入Cartridge 反应盒中;将反应盒放入Xpert仪器中,按操作规程进行操作,2h后仪器自动判读结果。按照仪器说明书,5个探针中至少有2个探针Ct值≤38 即为检测到结核杆菌,Ct值<16为高含量,Ct 值16-22 为中等含量,Ct 值22-28 为低含量,Ct 值>28 为极低含量。
1.3.3MGIT 960培养方法 取适量痰标本加入50 ml离心管,视痰性状加入1-2倍体积4% NaOH-NALC,涡漩振荡混匀2-3 min,室温放置15-20 min后加入0.1M无菌pH 6.8磷酸盐缓冲液至50 ml;3 000 rpm/min低温离心15 min,弃上清,加入1-2 ml 0.1 M无菌pH6.8磷酸盐缓冲液,混匀;将营养添加剂 GrowthSupplement倒入杂菌抑制剂 PANTA试剂瓶中,充分溶解混匀后吸取0.8 ml加入到 MGIT7 ml液体培养管中,然后再加入0.5 ml 标本;将培养管移入MGIT 960仪器中,按操作规程进行操作。
1.3.4荧光定量PCR检测 取适量痰标本加入50 ml离心管,视痰性状加入2-3倍体积4%的NaOH溶液,震荡混匀后静置30 min;取液化后的样本500 μl加入无菌离心管中,10 000 rpm离心3 min,弃上清,加入1 ml生理盐水重悬;再次12 000 rpm离心3 min,弃上清,加入50 μl核酸释放剂,100℃恒温加热10 min,然后12 000 rpm/min离心3 min,取上清作为待测样本。于PCR管中分别加入前处理的样本、阴性对照、阳性对照各5 μl,每管加入PCR-Mix(反应液38 μl+酶混合液2 μl+内标1 μl)40 μl,盖上管盖,2 000 rpm离心30 s,移入荧光定量PCR仪中;扩增程序如下:50℃ 2min;94℃ 2 min;94℃ 5 sec、57℃ 30 sec(45 cyclers);40℃ 10 sec。
1.4统计分析采用SPSS13.0统计软件进行数据分析,Xpert和荧光定量PCR法检测结果比较用配对χ2检验,P<0.05为显著性差异,有统计学意义。
2 结果
2.1比较Xpert和荧光定量PCR的灵敏度和特异性
收集的183份痰标本进行了上述三种方法的检测,有10份痰标本MGIT960培养为污染,有效样本为173份。在173份样本中,有93份样本MGIT960培养阳性,阳性率为53.8%(93/173);86份样本Xpert检测为阳性,灵敏度为84.95%(79/93),特异性为91.25%(73/80);82份样本荧光定量PCR检测为阳性,灵敏度为80.6%(75/93),特异性为91.25%(73/80)。Xpert与荧光定量PCR两种方法比较,差异无统计学意义(P=0.747,P>0.05)(详见表1)。
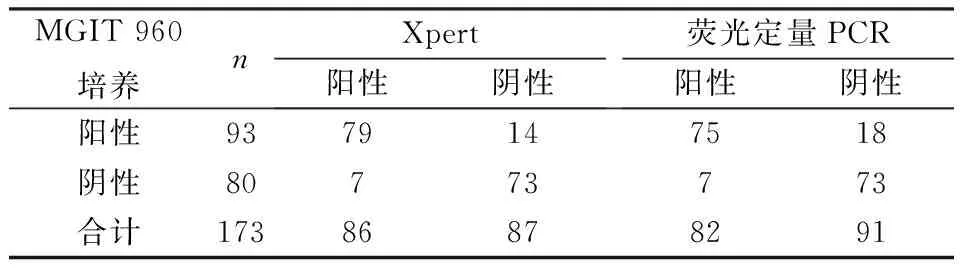
表1 痰液中结核杆菌Xpert、荧光定量PCR以及MGIT960法检测结果的比较
2.2Xpert与荧光定量PCR检测阳性而MGIT960培养阴性的结果
在173份痰样本中,有7份样本是MGIT 960培养结果为阴性,但Xpert和荧光定量PCR 检测结果为阳性。这7份样本中有3份为复诊样本,4份为初诊样本。初诊样本Xpert检测结果等级为低含量的有3份,极低含量的有1份。
2.3Xpert与荧光定量PCR检测结果不一致的结果
在173份痰样本中,有8份样本Xpert与荧光定量PCR检测不一致,其中7份样本为Xpert阳性而荧光定量PCR阴性,1份样本为Xpert阴性而荧光定量PCR阳性,具体结果见表2。

表2 结核杆菌Xpert与荧光定量PCR检测结果不一致标本分析
注:※MGIT 960培养液抗酸染色镜检时发现杆菌不规则排列,疑似有非结核分枝杆菌的混合感染
3 讨论
结核病作为一种人间传播疾病,有效快速的诊断是结核病防控的关键[2]。现有的结核病诊断方法中,抗酸染色虽然简便,但灵敏性太差;液体培养的灵敏性虽然高,但耗时长,延误疾病的诊断与治疗。随着核酸检测技术的进步,荧光定量PCR得以广泛应用,它的主要优点在于缩短了检测周期,全自动操作程序既减少了手工操作,同时还降低了交叉污染的风险[3]。
本研究共有183份样本,有10份样本MGIT 960培养为污染,污染率为5.5%,基本符合临床TB实验室污染控制要求。余下的173份样本, Xpert检测无效的有8份,无效率为4.37%,低于Elisa Ardizzoni[4]所报道的6.3%的无效率,无效检测不仅提高了检测费用,还造成了样本的浪费。对于检测结果无效的样本,我们取原样再次检测,检测结果为有效。无效检测产生的原因可能有:(1)痰液液化不充分,有颗粒的存在;(2)消化液中有气泡;(3)消化后样本中残留PCR抑制物;(4)试剂质量问题。173份样本,MGIT 960培养阳性的有93份,其中Xpert检测阳性的有79份,荧光定量PCR检测阳性的有75份。以培养结果为金标准,Xpert检测灵敏度为84.9%(79/93),特异性为91.25%(73/80);荧光定量PCR检测灵敏度为80.6%(75/93),特异性为91.25%(73/80),两种方法的灵敏度与特异性都较好,Xpert的灵敏度比荧光定量PCR稍微高些,但差异无统计学意义(P=0.747,P>0.05)。
目前国内对Xpert检测方法和荧光定量PCR在结核病快速检测方面的比较研究很少,高漫[5]等人的研究发现Xpert的灵敏度为65.9%,特异性为100%;刘慧梅[6]等人的研究发现Xpert的灵敏度是75.8%,特异性是79.7%;国外有研究发现,Xpert的灵敏度为50%-95%,特异性为94%-98%,荧光定量PCR的灵敏度为46%-78%,特异性为98%-100%。两种检测方法的灵敏度差异太大主要在于检测样本种类与来源、以及荧光定量检测试剂的不同[2,7-9]。本研究中,Xpert的灵敏度高于荧光定量PCR的原因可能有:(1)样本都为痰液,没有肺外结核的样本;(2)痰涂片阴性样本占71.6%,阳性比例较高。但我们也发现Xpert并没有达到理论上的高灵敏度,可能的原因有:(1)本实验中Xper针对的是直接的样本,没有如国外对非痰液样本进行浓缩[10-13];(2)Xpert系统没有去污染步骤,存在PCR抑制因子,在低菌量时影响较大[9];(3)菌量太低,超出Xpert的检测下限[14]。
核酸扩增检测(NAAT)针对的是核酸上的靶序列,这决定了它的高特异性,我们发现了7份样本MGIT 960培养为阴性,而Xpert和荧光定量PCR为阳性,我们推测最大的可能是由于死菌的存在,它们无法在液体培养系统中生长。出现这种培阴现象一方面可能为复诊化疗药物的杀菌作用,这7份样本中有3份为复诊样本;另一方面可能是去污染过程中NaOH影响了结核杆菌的活性,有研究发现它可以杀死高达60%的结核分枝杆菌[15],这在低菌量时影响较大。培阴中的4份初诊样本3份Xpert报阳等级为低含量,1份为极低含量,皆为低菌量报阳样本。为了比较Xpert和荧光定量PCR两者的检测差异,我们对检测结果不一致的样本进行分析,73份样本中有8例样本Xpert与荧光定量PCR检测不一致,包括7例Xpert阳性而荧光定量PCR阴性,1例Xpert阴性而荧光定量PCR阳性。7例Xpert检测阳性的标本,其等级基本都为极低含量,除SZ80外,培阳时间都高于13天;同时该7例样本采用涂片镜检进行等级分类,只有一个为1+,其余都为阴性,Xpert的报阳等级和涂片镜检结果都提示为低菌量样本。另外 1例Xpert阴性而荧光定量PCR阳性的标本培养报阳时间为20天,荧光定量Ct值为35.78,同样表明样本的含菌量很低。综上所述,我们推测,在检测低菌量样本时,Xpert的表现优于国产荧光PCR。在研究中,我们还发现了一例特殊样本SZ80,该样本经Xpert检测为阳性,MGIT 960培养后取培养液抗酸染色镜检,发现分散排列,怀疑是结核杆菌和非结核分枝杆菌的共同感染,我们将进一步进行确认。
Xpert系统和国产荧光定量PCR系统都在结核病检测诊断方面具有良好的灵敏度和特异性,考虑到荧光定量系统需要进行样本的前处理和核酸的提取,不仅增加了试验时间,还提高了污染的风险,生物安全等级要求也较高,同时荧光定量检测易受不同品牌检测试剂质量的影响;而Xpert检测需时短、自动化程度高、试剂封闭稳定,当然我们也不能忽视Xpert检测昂贵的费用。综上所述,我们应继续优化国产荧光定量PCR检测系统,从而为基层实验室在结核病核酸检测方法的选择提供参考。
参考文献:
[1]Global tuberculosis report 2015[R].World Health Organization,Geneva,Switzerland.
[2]Causse M,Ruiz P,Gutierrez-Aroca JB,et al.Comparison of two molecular methods for rapid diagnosis of extrapulmonary tuberculosis[J].J Clin Microbiol,2011,49(8):3065.
[3]EspyMJ,Uhl JR,Sloan LM,et al.Real-time PCR in clinical microbiology:applications for routine laboratory testing[J].ClinMicrobiol,2006,19(1):165.
[4]Ardizzoni1 E,Fajardo E,Saranchuk P,et al.Implementing the Xpert MTB/RIF diagnostic test for tuberculosis and rifampicin resistance:outcomes and lessons learned in 18 countries[J].PLoS One,2015,10(12):.
[5]高 漫,邹远妩,白广红,等.Xpert MTB/RIF Assay在结核病诊断中的应用[J].国际检验医学杂志,2015,36(3):413.
[6]刘慧梅,颜学兵.Xpert MTB/RIF试验检测结核分枝杆菌及其耐药性研究[J].成都医学院学报,2015,10(4):428.
[7]Patel VB,Connolly C,Singh R,et al.Comparison of amplicor and GeneXpert MTB/RIF tests for diagnosis of tuberculous meningitis[J].Journal of Clinical Microbiology,2014,52(10):3777.
[8]Antonenka U,Hofmann-Thiel S,Turaev L,et al.Comparison of Xpert MTB/RIF with ProbeTec ETDTB and COBAS TaqMan MTB for direct detectionof M.tuberculosis complex in respiratory specimens[J].BMC Infectious Diseases,2013,13:280.
[9]Kyung Sun Park,Ji-Youn Kim,Jung Wha Lee,et al.Comparison of the Xpert MTB/RIF and Cobas TaqMan MTB assays for detection of Mycobacterium tuberculosis in respiratory specimens[J].Journal of Clinical Microbiology,2013,51(10):3225.
[10]Scott LE,McCarthy K,Gous N,et al.Comparison of Xpert MTB/RIF with other nucleic acid technologies for diagnosing pulmonary tuberculosis in a highHIV prevalence setting:a prospective study[J].PLoS Med,2011,8(7):e1001061.
[11]Teo J,Jureen R,Chiang D,et al.Comparison of two nucleic acid amplification assays,the Xpert MTB/RIF assay and the amplified Mycobacterium tuberculosisdirect assay,for detection of Mycobacterium tuberculosis in respiratory and nonrespiratory specimens[J].Clin Microbiol,2011,49(10):3659.
[12]Miller MB,Popowitch EB,Backlund MG,et al.Performance of Xpert MTB/RIF RUO assay and IS6110 real-time PCR for Mycobacterium tuberculosis detection in clinical samples[J].Clin Microbiol,2011,49(10):3458.
[13]Armand S,Vanhuls P,Delcroix G,et al.Comparison of the XpertMTB/RIF test with an IS6110-TaqManreal-timePCRassay for direct detection of Mycobacterium tuberculosis inrespiratory and nonrespiratory specimens[J].Clin Microbiol,2011,49(5):177.
[14]Patel VB,Theron G,Lenders L,et al.Diagnostic accuracy of quantitative PCR (Xpert MTB/RIF) for tuberculous meningitis in a high burden setting:a prospective study[J].PLoS Med,2013,10:e1001536.
[15]Coulter P.Sputum Digestion/Decontamination for Mycobacteriology Culture Guidelines[R].2009.

