中晚期孕妇血清25-羟维生素D与骨代谢标志物水平及关系
孙红 陈士华 王良平 郑晓群
妊娠是一个复杂的生理过程,妊娠期间由于胎儿和母体的骨骼同时面临成熟和矿化过程,可能会导致母体骨代谢异常,甚至发生骨质疏松,孕妇体内激素、维生素D以及骨代谢标志物等缺乏可影响胎儿生长发育[1]。国外有关研究显示,妊娠妇女维生素D缺乏现象非常普遍[2-3]。据报道,日本的孕妇维生素D缺乏发病率则高达89.5%[4]。孕妇的骨质疏松常发生于妊娠中晚期,N端-骨钙素(N-MID)和β-胶原特殊序列(β-CTX)是骨形成和骨吸收的两种标志物。而国内对孕妇25-羟维生素D[25(OH)D]、N-MID和β-CTX的水平及相关性研究较少,因此,笔者通过测定中晚期孕妇血清中25(OH)D、N-MID、β-CTX水平,探讨其在妊娠妇女的代谢特点及临床意义。
1 对象和方法
1.1 对象 选择平湖市第一人民医院2016年1至12月定期产检孕妇1090例,年龄19~42岁,孕周13~40周。纳入标准:无急慢性疾病及先天性心、肺、肝、肾等疾病;妊娠前及妊娠期无甲状腺疾病,无明显妊娠合并症及并发症,未补充纯维生素D制剂。同时选取同期平湖市第一人民医院体检同年龄段健康非妊娠妇女120例作为正常对照组。每5岁为一个年龄段,每个年龄段入选30例。同一对象第2次检测资料不纳入研究。
1.2 方法
1.2.1 血清25(OH)D、N-MID、β-CTX水平的测定 抽取孕妇静脉血2~3ml,置于含分离胶的真空管送检,分离血清后进行25(OH)D、N-MID、β-CTX检测。检测仪器为罗氏E601电化学发光免疫分析仪,并用原装配套试剂,检测方法为电化学发光免疫分析法。
1.2.2 诊断标准 根据2011年美国内分泌学会《维生素D缺乏治疗和预防临床指南》[5]将25(OH)D营养状况分为 3组:维生素 D 缺乏组[25(OH)D<20ng/ml]、维生素 D 不足组 [20ng/ml≤25(OH)D<30ng/ml]、维生素D 正常组 [25(OH)D≥30ng/ml]。
1.3 观察指标 观察并比较妊娠中晚期孕妇和正常对照组的血清25(OH)D水平;根据妊娠中晚期孕妇产检采血时间,分别纳入不同月份组和季节组,分析和比较组间孕妇的血清25(OH)D水平;比较不同年龄组间孕妇血清25(OH)D、N-MID、β-CTX水平的差异及关系。
1.4 统计学处理 应用SPSS 20.0统计软件,正态分布的计量资料以表示,两组间比较采用t检验,多组间比较采用方差分析,两两比较采用SNK-q检验;偏态分布的计量资料用中位数和四分位数间距表示,多组间及组间两两比较用Kruskal-wallis H检验,相同年龄组之间比较采用Mann-Whitney U检验。计数资料组间比较采用χ2检验,分析相关性采用Pearson直线相关。P<0.05为差异有统计学意义。
2 结果
2.1 妊娠中晚期妇女组和正常对照组血清25(OH)D水平及营养状况分析 妊娠中晚期妇女组血清25(OH)D水平明显低于正常对照组(P<0.05),维生素D缺乏、不足和正常者所占比较明显高于正常对照组(均P<0.05),详见表 1。

表1 妊娠中晚期妇女组和正常对照组血清25(OH)D水平及营养状况分析
2.2 不同月份妊娠中晚期妇女血清25(OH)D水平分析 1月份 75例,血清 25(OH)D 水平(9.31±5.36)ng/ml;2 月份 83 例,血清25(OH)D 水平(9.03±4.67)ng/ml;3 月份89 例,血清 25(OH)D 水平(9.45±5.17)ng/ml;4 月份 77例,血清 25(OH)D 水平(9.77±4.95)ng/ml;5 月份 80 例,血清 25(OH)D 水平(11.35±5.95)ng/ml;6 月份 98 例,血清 25(OH)D 水平(11.08±5.75)ng/ml;7 月份 105 例,血清 25(OH)D 水平(12.30±5.89)ng/ml;8 月份 103 例,血清 25(OH)D 水平(13.89±5.97)ng/ml;9 月份 86例,血清25(OH)D 水平(13.36±5.65)ng/ml;10 月份 92 例,血清25(OH)D 水平(12.59±5.50)ng/ml;11 月份 95 例,血清25(OH)D 水平(10.93±5.47)ng/ml;12 月份 107 例,血清25(OH)D水平(10.67±4.45)ng/ml;波动范围(4.20~35.57)ng/ml,其中2月份最低,8月份最高,血清25(OH)D水平从夏初开始逐渐升高,在夏末秋初达到高峰,之后逐渐降低至冬末春初。见图1。

图1 不同月份妊娠中晚期妇女25(OH)D水平(ng/ml)
2.3 不同季节妊娠中晚期妇女血清25(OH)D水平分析冬春季组血清25(OH)D水平明显低于夏秋季组(P<0.05)。维生素D缺乏所占比例高于夏秋季组,不足和正常者所占比例均低于夏秋季组,但差异均有统计学意义(均P<0.05),详见表 2。
2.4 不同年龄孕妇组与正常对照组血清25(OH)D、N-MID、β-CTX水平分析 各年龄段孕妇组与对照组之间血清25(OH)D水平差异均有统计学意义(均P<0.05),不同年龄孕妇组间血清25(OH)D水平差异有统计学意义(P<0.05),其中>36岁孕妇组 25(OH)D 水平最低。除了>36岁孕妇组与对照组N-MID差异无统计学意义(P>0.05),其它3个年龄段孕妇组血清N-MID水平分别与对照组比较差异均有统计学意义(均P<0.05),不同年龄孕妇组间血清N-MID水平差异有统计学意义(P<0.05),N-MID水平在<26岁孕妇组最高,与其它3组比较差异有统计学意义(P<0.05),26~30岁孕妇组与31~35岁孕妇组比较差异有统计学意义(P<0.05),>36岁孕妇组与 26~30岁孕妇组、31~35岁孕妇组比较差异无统计学意义(P>0.05)。各年龄段孕妇组分别与对照组之间血清β-CTX水平差异均有统计学意义(均P<0.05),不同年龄孕妇组间血清β-CTX水平差异有统计学意义(P<0.05),除了31~35岁孕妇组与>36岁孕妇组比较差异无统计学意义(P>0.05)外,其它两两比较差异均有统计学意义(均P<0.05)。而N-MID与β-CTX水平都在<26岁组最高,在31~35岁组最低。见表3。

表2 不同季节妊娠中晚期妇女25(OH)D水平和维生素D营养状况分析
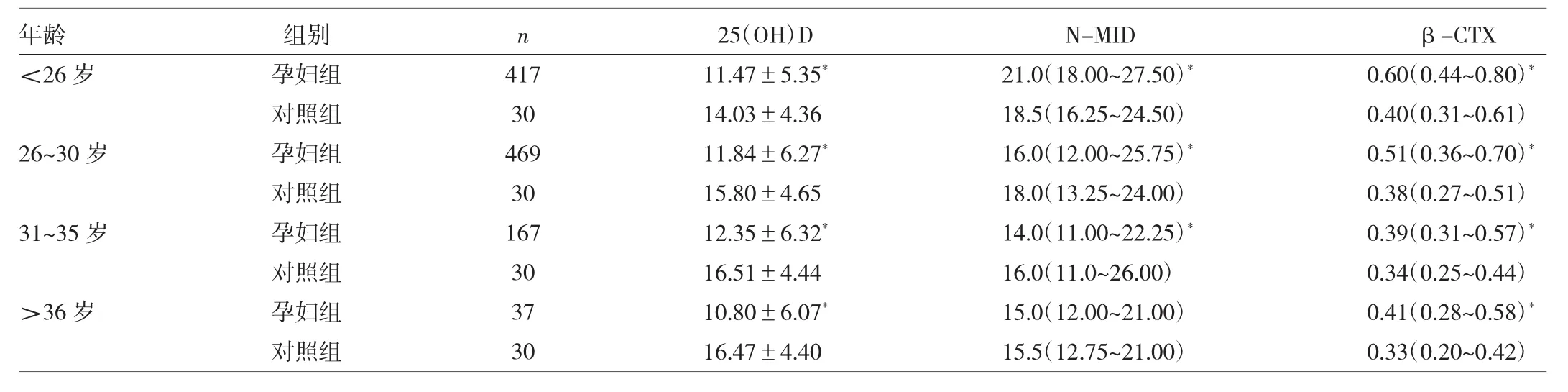
表3 不同年龄孕妇组与对照组25(OH)D、N-MID、β-CTX水平分析(ng/ml)
2.5 25(OH)D水平与骨代谢标志物的关系 血清25(OH)D 水平与 N-MID 指标无相关性(r=-0.017,P>0.05),与 β-CTX 指标呈负相关(r=-0.090,P<0.05),NMID 与 β-CTX 间的呈正相关性(r=0.586,P<0.05)。
3 讨论
妊娠过程中机体发生了一系列的适应性变化,25(OH)D是体内重要的类同醇激素,涉及经典钙磷代谢,发挥免疫调节作用[6]。妊娠期妇女体内维生素D水平对自身、胎儿、新生儿及婴幼儿都有着重要的影响[7]。全球妊娠中晚期妇女维生素D水平不足或缺乏现象普遍。向菲等[8]对贵阳地区孕妇的25(OH)D进行研究,结果孕中晚期妇女25(OH)D水平缺乏占66.7%,不足占23.3%,正常占10%。本研究显示,妊娠中晚期孕妇 25(OH)D 平均(11.23±5.82)ng/ml,明显低于正常范围,其中25(OH)D水平缺乏、不足、正常分别为84.13%、13.94%和1.93%。25(OH)D水平在8月份最高,2月份最低,各年龄组之间31~35岁孕妇组最高,在>36岁孕妇组最低,夏秋季维生素D水平明显高于冬春季,原因可能是现在的女性怀孕后保胎的很多,减少了户外活动,光照不够,因此出现普遍维生素D不足。夏秋季阳光充足,紫外线强度大于冬春季,而且冬春季节孕妇户外活动缺乏、紫外线暴露更加减少以及高龄孕妇本身就处于维生素D和钙缺乏状态,使得出现季节性和年龄性的改变。
骨钙素是一种由成骨细胞合成和分泌的钙离子结合谷氨酸胶原蛋白,能直接反映成骨细胞活性,是成骨细胞功能和骨质矿化的特殊标志物。在室温中迅速解裂成稳定的具有43个氨基酸的N端片段(N-MID)[9]。β-CTX反映骨吸收,它是I型胶原蛋白的羧基端降解产物,是反应骨吸收与分解的标志物[10]。本研究结果显示,<26岁段妊娠中晚期孕妇血清N-MID与β-CTX升高,因该年龄组孕妇处于骨量增长期,骨形成加速,由于胎儿和母体的双重需要,通过正常饮食不能满足母体骨钙储备及胎儿骨骼发育需要,而在31~35岁段降低,母体有足够的骨钙储备量,正常饮食可以满足母体及胎儿骨骼发育需要,骨转换率较低,骨量维持最为稳定,因此该年龄段孕妇骨代谢变化最小。
本研究还显示,血清25(OH)D水平与与N-MID指标无相关性(r=-0.017,P >0.05),与 β-CTX 指标呈负相关(r=-0.090,P<0.05),N-MID 与 β-CTX 指标呈明显正相关(r=0.586,P<0.05)。因此通过骨代谢指标来推断机体维生素D的营养状况还尚待研究。
[1]Yesiltepe Mutlu G,Krmzbekmez H,Ozsu E,et al.Metabolic bone disease of prematurity:report of four cases[J].J Clin Res Pediatr Endocrinol,2014,6(2):111-115.
[2]Catrin W,Peter G,Wolfgang B,et al.Cross-sectional study of factors that influence the 25-hydroxyvitamin D status in pregnant women and in cord blood in Germany[J].British Journalof Nutrition,2013,110(10):895-902.
[3]Rodda CP,Benson JE,Vincent AJ,et al.Maternal vitamin D supplementation during pregnancy prevents vitamin D deficiency in the newborn:an open belrandomized controlled trial[J].Clinical Endocrinology,2015,83(3):363-368.
[4]Shibata M,Suzuki A,Sekiya T,et al.High prevalence of hypovitaminosis D in pregnant Japanese women with threatened premature delivery[J].J Bone and Mine Metab,2011,29(5):615-620.
[5]Holik MF,Neil C,Binkley,et al.Evaluation,Treatment,and Prevention of Vitamin D Deficiency:an Endocrine Society Clinical Practice Guideline[J].J Clin EndocrinolMetab,2011,96:1-20.
[6]Hossein-nezhad A,Holick MF.Vitamin D for health:a global perspective[J].Mayo Clin Proc,2013,88(7):720-755.
[7]陈方方,吴瑛婷,王怡,等.妊娠早中期妇女维生素D营养现状分析[J].检验医学,2016,31(12):1026-1030.
[8]向菲,蒋佳,欧亚萍,等.贵阳市妊娠中晚期妇女维生素D现状研究[J].中华内分泌代谢杂志,2014,30(6):486-489.
[9]席向红,郭小龙,张建荣,等.骨代谢等生化指标在不同孕期的代谢特点及相关性研究[J].中华医学杂志,2017,97(13):1015-1017.
[10]侯海青,夏雪琴.不同年龄妊娠晚期孕妇血清骨钙素、Ⅰ型胶原羧基端肽β特殊序列的表达及意义[J].临床检验杂志,2015,33(4):274-276.

