乌药提取物对酒精性肝损伤大鼠门静脉内毒素及小肠组织形态学的干预研究
季梦漂 楼招欢 谭明明 丁慧珍 胡志希 王军伟
酒精性肝损伤(alcoholic liver disease,ALD)是常见的肝脏早期损伤形式之一。目前,短期内过量饮酒的现象与酗酒成瘾造成的慢性酒精摄入均呈上升趋势,若不及早防治,约8%~20%可发展为肝硬化。关于酒精诱导肝损伤的辅助因素及介导途径的连锁反应研究是ALD的热点,其中包括肠道内毒素和肠渗漏[1]。本课题组前期研究表明,乌药可通过减轻炎症反应[2]、抑制抗氧化损伤[3]等作用直接保护肝组织。因此,本研究以“肠-肝轴”为切入点,进一步探讨乌药不同提取物对ALD大鼠肠道内毒素及组织形态学的影响,现将结果报道如下。
1 材料和方法
1.1 材料 健康SD大鼠88只,雄性,体重180~220g,购自浙江省实验动物中心,动物质量合格证号:0016074。乌药:由浙江省天台山乌药生物工程有限公司提供,2013年8月采自浙江省天台县三州乡,经该公司陈方标药师鉴定为樟科山胡椒属植物乌药Lindera aggregata(Sims)Kosterm的干燥块根。阳性对照组采用思密达[博福-益普生(天津)制药有限公司],规格3g×10袋,用蒸馏水配制成浓度为0.09g/ml的混悬液备用。白酒:红星二锅头酒(酒精浓度52%),2.0L/瓶,北京红星股份有限公司;与双蒸水按一定体积比例稀释,乙醇体积分数为50%。仪器:TBA-40FR全自动生化仪(日本东芝医疗系统株式会社);Powerwave340酶标仪(美国Bio-TEK公司);LEICA RM2245切片机(德国LEICA公司);VIP-5-Jr-J2组织全自动脱水机(日本 Sakura公司);EC360组织自动包埋机(南京美康科技有限公司);YR-21全自动染色机(湖北亚光医用电子技术有限公司);BA410生物显微镜、Adavance3.2图象分析系统(香港Motic公司);Hitachi-7650透射电镜(日本Hitachi公司)。
1.2 乌药提取物的制备 水提取物制备:取乌药500g,加入12倍量水100℃回流提取1.5h,滤取药液,药渣继用10倍量水以相同条件提取1h,滤取药液,合并两次药液,减压回收并适当浓缩,即得乌药水提取物(WYSTW)。醇提取物制备:取乌药500g,加入12倍量75%乙醇100℃回流提取1.5h,滤取药液,药渣继用10倍量75%乙醇以相同条件提取1h,滤取药液,合并2次药液,减压回收乙醇并适当浓缩,即得乌药醇提取物(WYCTW)。醇提取物各萃取物:取WYCTW适量依次用石油醚、乙酸乙酯、水饱和正丁醇分次萃取至色淡,分取并合并各萃取层,减压回收溶剂,分别得乌药醇提取物石油醚萃取物(WYCTC1)、乌药醇提取物乙酸乙酯萃取物(WYCTC2)、乌药醇提取物正丁醇萃取物(WYCTC3)。取WYCTW各萃取物,用适量吐温80研磨后,加水置磁力搅拌器混匀,加蒸馏水稀释,使每毫升药液相当于1g生药,即得各萃取物溶液。上述各溶液,临用前用适量蒸馏水稀释,使每毫升药液相当于0.4g生药。
1.3 动物分组与造模 选取健康雄性SD大鼠88只随机分为8组,每组11只,即正常对照组、模型对照组、阳性对照组(思密达 0.9g/kg)、WYSTW(4g/kg)组、WYCTW(4g/kg)组 、WYCTC1(4g/kg)组 、WYCTC2(4g/kg)组 、WYCTC3(4g/kg)组,所有大鼠均给予基础饲料,自由采食饮水。除正常对照组(以等体积的蒸馏水灌胃)外,其余各组大鼠均给予乙醇体积分数50%的白酒灌胃造模,1次/d,灌胃容积1.2ml/100g,连续33d造模结束。自造模第1天起,除正常对照组和模型对照组灌服蒸馏水外,其余各给药组分别给予相应的药物灌胃,1次/d,灌胃容积为1ml/100g(即相当于每100g体重灌入0.4g生药),连续 33d。
1.4 观察指标 (1)门静脉血内毒素(ET)、TNF-α检测:所有大鼠末次给药后禁食12h,一次性灌胃给予10mg/kg脂多糖(LPS,美国Sigma公司),3.5h后处死大鼠分别于肝门静脉和腹主动脉取血,离心制备血清,采用酶联免疫法测定血清中ET、TNF-α含量(试剂批号20140801A,上海源叶生物科技有限公司)。(2)组织病理学检查:取回盲部上方15 cm处小肠相同部位,用10% 中性甲醛固定,石蜡包埋,苏木精-伊红(HE)染色后于光学显微镜(×100)下观察肠道组织病理学改变。(3)肠黏膜电镜观察:透射电镜下观察末段回肠黏膜上皮通透性。
1.5 统计学处理 应用SPSS 22.0统计软件。计量资料以表示,两组间比较采用t检验;多组间比较采用方差分析,两两比较方差齐时采用LSD-t法,方差不齐时采用Tamhane’s T2法。P<0.05为差异有统计学意义。
2 结果
2.1 乌药不同提取物对ALD模型大鼠门静脉血ET、TNF-α含量的影响 与正常对照组相比,模型对照组大鼠门静脉血ET、TNF-α含量明显升高(P<0.01)。与模型对照组相比,各给药组大鼠上述指标含量明显降低(P<0.05或0.01)。与阳性对照组相比,WYSTW降低指标程度与其相当,而WYCTW降低程度更明显(P<0.01)。WYCTW的3个萃取物中,又以WYCTC1和WYCTC3效果较优。见表1。
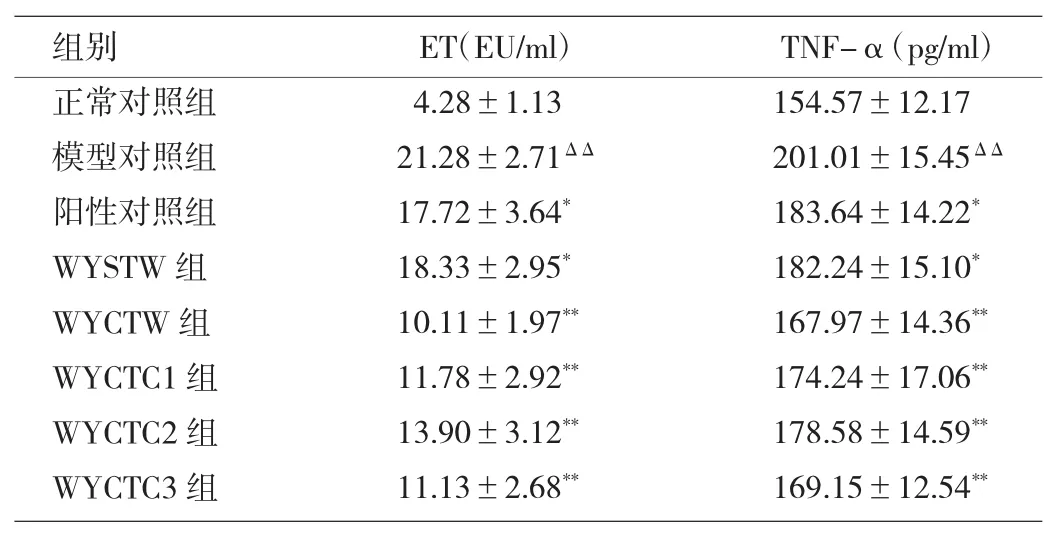
表1 乌药不同提取物对ALD模型大鼠门静脉血ET、TNF-α含量的影响
2.2 对ALD模型大鼠小肠组织形态学的影响 光镜下可见正常对照组大鼠小肠黏膜上皮细胞形态及结构基本正常,微绒毛整齐、密集,无缺损;模型对照组大鼠小肠黏膜呈部分肠上皮细胞变性、坏死、脱落,间质轻度水肿,少量炎细胞浸润,绒毛横径增宽。与模型对照组相比,阳性对照组及乌药各给药组大鼠小肠组织病理变化程度明显减轻。见图1(插页)。
2.3 对ALD模型大鼠小肠黏膜微结构的影响 透射电镜下可见正常对照组大鼠小肠上皮细胞微绒毛排列整齐、紧密连接,线粒体无明显损伤(图2a);模型对照组大鼠小肠上皮可见不规则、稀疏的微绒毛及肿胀、空泡变性的线粒体(图2b);与模型对照组相比,阳性对照组(图 2c)与乌药各给药组(图 2d、e、f、g、h)大鼠小肠黏膜呈紧密连接的簇状微绒毛明显增多,同时线粒体形态较之正常,结构完整。见图2(插页)。
3 讨论
《诸病源候论》云:“酒者,水谷之精也。其气焊而有大毒,入于肝胆……。”酒为湿热二性,多饮则蕴积化毒,戕伐脏腑。长期大量酒精摄入引发氧化应激和脂质过氧化使肝细胞遭遇初次打击形成脂肪肝,而肠黏膜受损,由内毒素介导的低水平肠源性内毒素血症,又刺激肝脏发生炎症、坏死和纤维化形成“二次打击”[4]。肝脏对来自体内外的非营养性物质如药物、毒物、代谢产物具有生物转化作用,这一生理特性也决定了肝脏是最易受侵害和需自我保护的组织,因此以往抗氧化、抗炎、降脂、保护肝细胞的单一治疗模式已不适用。
乌药为理气药,具有行气止痛,温肾散寒之效。以往作为经典方剂的重要组成,在中医历史上为支气管哮喘、肺气肿、胃肠紊乱、痛经、疝气、睾丸炎等众多患者解除病痛。药理学研究也显示乌药对免疫系统、消化系统、心血管系统、中枢神经系统以及抗病毒等方面均具有广泛的药理活性[5]。中药多靶点、多环节、多途径整合调节的治疗模式有着西药不可比拟的优势,为全面探究乌药治疗ALD的作用机制,本研究提取乌药有效成分进行干预,以期为开发治疗酒精肝的药物奠定实验基础。
本实验采用门静脉血ET、TNF-α含量作为反映肝损伤的重要指标。众所周知,酒精作为肝脏毒剂,可削弱正常肝细胞的代谢及结构稳定,损伤线粒体功能,同时又可致小肠黏膜通透性增加,屏障功能减弱,细菌过度滋生,释放大量内毒素[6],最终导致肠源性内毒素渗漏,加重肝损伤。内毒素是肠道革兰阴性菌细胞壁裂解后释放出的脂多糖,其可通过刺激库普弗细胞激活诱导TNF-α的产生[7],本实验也发现大鼠血清TNF-α与门静脉血ET含量呈正相关。现已有大量研究阐明“酒精-内毒素-库普弗细胞-TNF-α等细胞因子-肝脏炎症”这一损伤途径和机制[8]。在本实验中,模型对照组门静脉血ET、TNF-α 含量显著升高(P<0.01),乌药各给药组却对上述指标变化呈现明显的抑制效应,表明乌药提取物抗大鼠ALD作用机制与抑制内毒素——TNF-α通路有关。进一步从病理学角度探究,光镜下,模型对照组小肠黏膜呈部分肠上皮细胞变性、坏死、脱落,间质轻度水肿,各给药组大鼠小肠组织病理变化程度明显减轻;电镜下,各给药组小肠上皮呈紧密连接的簇状微绒毛较模型组明显增多,线粒体形态较之正常,说明乌药提取物抑制内毒素及炎症因子的作用可能是通过保护肠黏膜微绒毛,修复上皮紧密连接结构缺损,改善肠道屏障功能,降低肠道通透性实现的。
药效作用对比,发现WYCTW在调节门静脉血内毒素和炎症因子上的作用优于WYSTW及阳性药物;醇提取物3个萃取物中,WYCTC1和WYCTC3效果较优。已知乌药中化学成分主要有挥发油、异喹啉生物碱类及呋喃倍半萜三大类[9]。其中,异喹啉生物碱类组分为水溶性,易用水提法得到;呋喃倍半萜组分为脂溶性,醇提部位浓度较高[10]。虽然目前无法得知乌药作用的具体有效成分及药效部位,但可大胆推测呋喃倍半萜组分可能是乌药护肝的主要成分。
综上所述,乌药不同提取物抗大鼠ALD的作用机制与抑制内毒素——TNF-α通路有关,具体可能是通过改善酒精引起的肠黏膜损伤、减轻肠源性内毒素血症来实现的。其主要起效成分可能为呋喃倍半萜组分,而科学提取和使用乌药护肝活性成分仍有待更深入的研究。
[1]Chiu WC,Huang YL,Chen YL,et al.Synbiotics reduce ethanolinduced hepatic steatosis and inflammation by improving intestinal permeability and microbiota in rats[J].Food&function,2015,6(5):1692-1700.
[2]王军伟,胡培阳,陈昕昳,等.乌药对急性酒精性肝损伤模型大鼠炎性因子的影响[J].中华灾害救援医学,2014,2(7):373-376.
[3]陈卓亮,王军伟,谭明明,等.乌药水提物与醇提物对急性酒精性肝损伤模型大鼠抗氧化作用的比较研究[J].浙江中医杂志,2015,50(6):414-415.
[4]Schaffert CS,Duryee MJ,Hunter CD,et al.Alcoholmetabolites and lipopolysaccharide:rolesin the development and/or progression of alcoholic liver disease[J].World J Gastroenterol,2009,15(10):1209-1218.
[5]陈方亮,余翠琴.乌药的药理研究概况[J].海峡药学,2011,23(12):44-46.
[6]Tang Y,Forsyth CB,Keshavarzian A.The role ofmiRNAs in alcoholinduced endotoxemia,dysfunction of mucosal immunity,and gut leakiness[J].Alcoholism,clinicaland experimentalresearch,2014,38(9):2331-2334.
[7]李晓非,黄山,汪亚玲,等.中西医结合治疗肝衰竭对TNF-α、IL-6及血清内毒素水平的影响[J].昆明医科大学学报,2016,37(4):76-79.
[8]曹健美,崔剑巍,方志红,等.健脾理气活血方对酒精性肝损伤大鼠血浆内毒素和TNF-α蛋白表达的影响[J].上海中医药大学学报,2008,22(5):44-47.
[9]魏国清,蒋合众,陈惠,等.乌药化学成分研究进展[J].成都中医药大学学报,2013,36(3):103-105.
[10]汤小刚,洪汝涛.水提乌药与醇提乌药对急性酒精性肝损伤模型大鼠的保护作用[J].中国临床药理学杂志,2016,32(8):703-706.

