金针菇中棒曲霉素高效液相色谱检测法的研究
石宝俊,葛 玲,姜洪芳,林群英,朱海亮,张卫明
(1.南京野生植物综合利用研究院,江苏 南京 210042;2.亿利耐雀生物科技有限公司,江苏 南京 210038; 3. 南京大学 生命科学学院, 江苏 南京210093)
金针菇[Flammulinavelutipes(Curt.:Fr.) Sing.]又名冬菇、朴菇、构菌、青杠菌、毛柄金钱菌,隶属担子菌亚门(Basidiomycotina),层菌纲(Hymenomycetes),伞菌目(Agaricales),口蘑科(Tricholomataceae),金钱菌属(Flammulina)[1]。金针菇菌盖滑嫩、菌柄细长脆嫩,形美,味鲜,是世界上著名的食药两用菌和观赏菌[2],具有较高的营养价值和药用价值,有广阔的开发前景。 金针菇在物流运输过程中,极容易受到病原菌的影响,从而感染棒曲霉素的产生菌,产生棒曲霉素,对人体健康造成危害。棒曲霉素(patulin )又名展青霉素,是由曲霉和青霉等常见食源性真菌所产生的一种次级代谢产物[3]。棒曲霉素,分子式为C7H6O4,分子量为154,化学名称4-羟基-4-氢-呋喃(3,2碳)并吡喃-2(6氢)酮(4-hydroxy-4H-furo[3,2C]pyran-2 (6H)-one),是一种杂环内酮结构化合物。毒理学试验表明,棒曲霉素具有致癌、致畸和免疫受损等毒理作用,对人体有一定危害,可导致呼吸、泌尿、神经等系统的损坏甚至衰弱[4]。棒曲霉素广泛存在于各种霉变的水果蔬菜中,甚至部分有霉变趋势的好果中其含量也比较高[5]。因而,西欧各国对苹果及其制品中的棒曲霉素限量有严格规定,最高限量为50 μg/kg[6],而欧盟和日本已经将婴儿食品中的这一标准提高到10 μg/kg。目前水果及其制品中棒曲霉素的检测方法日渐成熟,而蔬菜中棒曲霉素的检测研究还很少,尤其金针菇中棒曲霉素的检测几乎无人研究。随着金针菇在食品药品领域的运用,摸索出一种灵敏度,回收率与重复性都很高的检测方法至关重要。
1 实验材料与方法
1.1 实验材料和仪器
材料:金针菇(镇江田润发生态农业有限公司),棒曲霉素标准品(≥98%,上海沪峥生物科技有限公司),乙酸乙酯(AR,南京化学试剂股份有限公司),冰醋酸(AR国药集团上海化学试剂有限公司,乙腈(HPLC,tedia company),乙醇(AR,南京化学试剂有限公司),乙酸钠(AR,南京化学试剂有限公司),无水碳酸钠(AR南京化学试剂有限公司)。
仪器:组织捣碎机(JJ-2BS,峥嵘仪器有限公司),旋转蒸发仪(RE52-AA,上海亚荣生化仪器厂),高效液相色谱仪(1200,美国安捷伦公司),多用循环水式真空泵(SHZ-DⅢ,巩义市予华仪器有限公司)。
2 实验方法
2.1 青霉菌的培养
PDA培养基的制作:称取200 g马铃薯,洗净去皮切碎,加水1 000 mL煮沸0.5 h,纱布过滤,再加10~20 g葡萄糖和17~20 g琼脂,充分溶解后趁热纱布过滤,分装试管,每试管约5 mL(试管大小为10 mL),15磅蒸气(121 ℃)灭菌20 min左右后取出试管摆斜面,冷却后贮存备用。
PD液体培养基的制作:称取200 g马铃薯,洗净去皮切碎,加水1 000 mL煮沸0.5 h,纱布过滤,再加10~20 g葡萄糖,充分溶解后趁热纱布过滤, 121 ℃灭菌20 min左右后取出,冷却后贮存备用。
青霉菌的固体培养:在无菌环境下,将青霉菌菌种接种在PDA培养基上,待长出菌落后,从菌落边缘挑取少量菌丝,接种在PDA培养基的斜面上,28 ℃下培养7天,使菌丝长满斜面。
青霉菌的液体培养:在无菌环境下,挑取少量上述固体培养基中的青霉菌菌丝,置于含有PDA液体培养基的锥形瓶中,在28 ℃下,摇床转速为160 r/min,培养7天,使液体培养基中布满菌丝。
青霉菌混悬液:取斜面固体培养的青霉菌试管,加入蒸馏水,使用刮条轻轻剥离青霉菌丝,转移至喷瓶内,成青霉菌混悬液。
2.2 棒曲霉素标准溶液的配制
配制醋酸-醋酸钠缓冲液:称取醋酸钠5.1 g,加入冰醋酸20 mL,用纯净水稀释定量到200 mL。
配制棒曲霉素对照品储备液:用移液枪吸取少量醋酸-醋酸钠缓冲液置于棒曲霉素标准品样品瓶中,振荡,溶解,不易溶解情况下可适当超声,溶解完全后,用移液枪移至5 mL容量瓶中,用缓冲液少量多次润洗标准品样品瓶,洗液依次移入容量瓶,用缓冲液定容至刻度,成1 mg/mL的棒曲霉素标准品储备液[7]。
2.3 标准曲线的制备
2.3.1 液相色谱条件的摸索
(1)色谱条件
色谱柱:ODS反相柱(C18柱);检测器:紫外检测器,波长276 nm;柱温:30 ℃。
流动相使用乙腈和水混合。在流速为1 mL/min条件下,观察乙腈与水体积配比分别为 20∶80,15∶85,10∶90对棒曲霉素的分离效果。
在最优体积比下或者各项体积比下,比较不同流速(1.0,0.8,0.6 mL/min)对棒曲霉素的分离效果[8]。
进样量:使用20μL的定量进样环满环进样20μL。
(2)标准工作液的制备
取棒曲霉素对照品储备液(1 mg/mL),用醋酸-醋酸钠缓冲液稀释10倍得到浓度为100μg/mL的溶液,再用醋酸-醋酸钠缓冲液逐级稀释,得到浓度分别为25μg/mL、10μg/mL、5μg/mL、1μg/mL、0.25μg/mL、0.05μg/mL、0.01μg/mL的标准溶液。
(3)标准曲线的绘制
在摸索出的色谱条件下满环进样20 μL,每个浓度进样三次,记录色谱峰保留时间、峰高和峰面积,取峰面积的平均值,以浓度为横坐标,峰面积为纵坐标,使用Excel绘制标准曲线。
2.3.2 金针菇的制备及检测
金针菇的前处理
空白样:分别称取4份约170 g新鲜金针菇,放置在保鲜盒中,密封,分别于于第4天,第8天,第12天进行棒曲霉素的提取。
青霉菌接种样:分别称取3份约170新鲜金针菇,密封,取现配的青霉菌混悬液,均匀喷洒在金针菇表面,分别于第4天、第8天,第12天进行棒曲霉素的提取。
金针菇的提取分离及纯化:将经处理过后的金针菇使用组织捣碎机打成汁,用无纺滤布过滤,取50 mL金针菇汁,加入乙酸乙酯50 mL,分别萃取三次,每次振荡3 min,弃去水相,合并有机相,用20 mL的1.5%碳酸钠溶液快速洗涤有机相,洗涤时间控制在1 min以内,静置分层后,分离水相和有机相,水相再用少量乙酸乙酯洗涤一次,合并有机相。将有机相在38 ℃水浴上,用旋转蒸发仪蒸发至干,并立即用少量乙酸乙酯淋洗瓶壁3~4次,所得溶液在38~40 ℃水浴上挥去溶剂,再用醋酸-醋酸钠缓冲液定容至3 mL,溶液经样品过滤器过滤后,得到供试品溶液。
青霉菌液体培养液处理样:取上述青霉菌液体培养基得到的布满菌丝块的锥形瓶,用玻璃棒搅拌至菌丝块散落,按上述金针菇汁处理方法,制作成供试品溶液。
金针菇样品的检测:在摸索出的色谱条件下,取各供试品溶液满环进样20μL,每个浓度进样三次,记录色谱峰保留时间、峰高,另进一针棒曲霉素对照品溶液记录保留时间和峰高,根据组分在色谱上的出峰时间与标准组分比较定性。每个供试品溶液进样三次,积分得到样品棒曲霉素峰面积,取平均值,通过标准曲线计算供试品中棒曲霉素浓度。
3 结果与分析
3.1 液相条件摸索结果
在1 mL/min流速下,取5μg/mL的棒曲霉素标准溶液满环进样,在乙腈∶水体积配比分别为20∶80,15∶85时的分离效果都比较好,在乙腈∶水体积配比10∶90时分离效果比较差,其中以乙腈∶水体积配比为15∶85时分离效果最好,因此确定流动相为乙腈∶水(15∶85)。
在确定流动相为乙腈∶水(15∶85)条件下,取5μg/mL的棒曲霉素标准溶液满环进样,在流速为1.0 mL/min时,各峰聚集在3~4 min内,分离效果较差;在流速为0.8 mL/min时,各峰分离效果较好,对照品棒曲霉素出峰时间在7.5 min左右;在流速为0.6 mL/min时,各峰分离效果较好,各峰分离充分,但对照品出峰时间在9 min左右。因标准溶液进样10 min后,并无其他峰出现,拟定走样时间为10 min,因此选取流速为0.8 mL/min作为检测流速。
以1μg/mL浓度棒曲霉素标准溶液进样,按高效液相色谱分析条件测定。
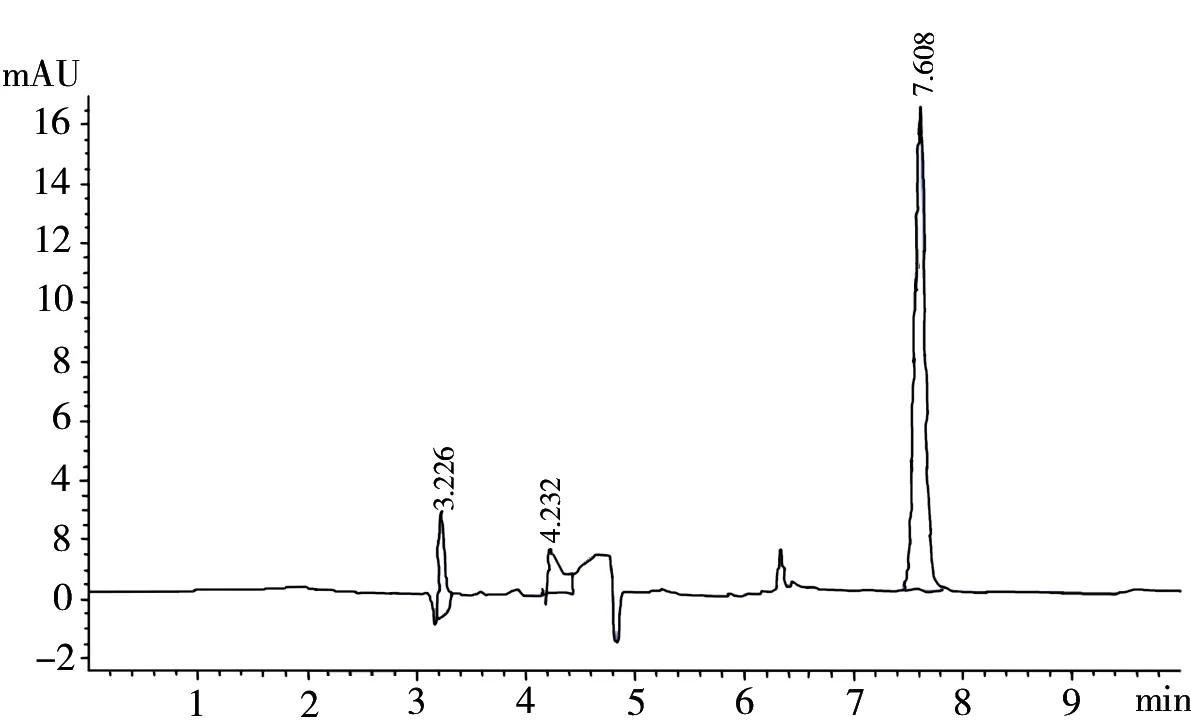
图1 1μg/mL棒曲霉素标准溶液的色谱图
3.2 方法学验证结果
3.2.1 标准品稳定性实验结果

表1 标准品稳定性结果
3.2.2 精密度实验结果

表2 精密度实验结果
3.2.3 检出限和定量限
根据标准工作液的高效液相图谱数据分析,浓度为0.01μg/mL的标准工作液,在以基线平稳的8~10 min为噪声范围,其信噪比为23.7,在检出限和定量限信噪比定义限以上,故标准曲线浓度范围之间的样品浓度均可定量检测。
3.3 标准曲线的绘制
以标准品溶液为横坐标,峰面积为纵坐标,进行线性回归,线性方程为y=112.89x-14.236,R2= 0.998 4。结果表明,棒曲霉素在0.01~25μg/mL浓度范围内线性关系良好。
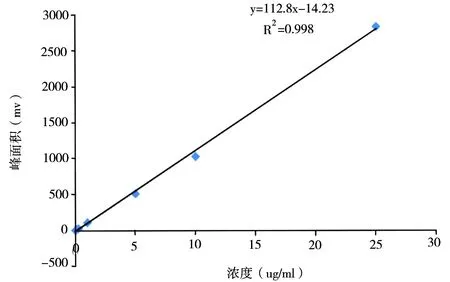
图2 标准曲线
3.4 样品检测结果

图3 空白样4天高效液相色谱图

图4 青霉菌接种样4天高效液相色谱图

图5 空白样8天高效液相色谱图

图6 青霉菌接种样8天高效液相色谱图

图7 空白样12天高效液相色谱图

图8 青霉菌接种样12天高效液相色谱图
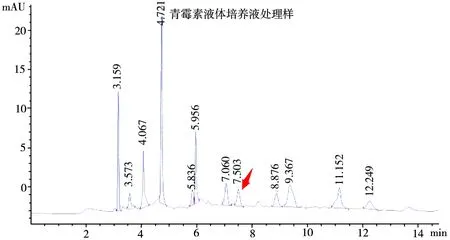
图9 青霉菌液体培养液处理样高效液相色谱图
4 结 论
本试验结果表明,测定棒曲霉素的高效液相法的最佳色谱条件为:乙腈与水体积配比为15∶85;流速为0.8 mL/min。根据检出限和重复性精密度实验结果可知,高效液相法检测棒曲霉素的灵敏度和精密度较高。用液液萃取法提取,碳酸钠净化制备的金针菇供试品,其高效液相谱图杂峰较多,样品净化不充分,棒曲霉素峰面积不稳定。经检测,青霉菌液体培养液处理样中棒曲霉素的含量远远大于其他样品,有明显可见的棒曲霉素峰,其保留时间与工作液中棒曲霉素的保留时间一致,故认为青霉菌感染确会产生棒曲霉素。根据现有数据分析,金针菇供试品中,空白样中棒曲霉素含量在前期要低于青霉菌接种样,但在8天和12天,制备的金针菇样品中,青霉菌接种样中棒曲霉素的含量并未高于空白样,可以认为在8天及以后,棒曲霉素的生成已完成,含量不再增加。或者棒曲霉素在样品处理过程中有所损耗,检测量远远小于实际含量,造成实验结果的差异。
5 讨 论
(1)在决定配制棒曲霉素溶剂方面,本实验曾存在很多疑虑。棒曲霉素具有易溶于水、乙醇、丙酮、乙酸乙醋和氯仿,耐酸,在碱性条件下不稳定;在氯仿、苯、二氯甲烷等溶剂中能较长时期稳定,在水中和甲醇中逐渐分解,溶液蒸干后形成薄膜则不稳定等性质,但目前查阅到的很多文献上,配制棒曲霉素标准液时使用的是甲醇。因不确定棒曲霉素在甲醇中能稳定存在的时间,为了保险起见排除用甲醇配液的方法。GB5009.185—2016上,在配制棒曲霉素标准溶液时,方法为使用乙腈配制棒曲霉素标准储备溶液,在-20 ℃下冷冻保存,有效期长达6个月;用储备液制备标准工作液时,所用溶剂为4 ℃,有效期为3个月。因考虑到乙腈挥发性、棒曲霉素的性质以及实验周期问题,对照所查文献其他样品中棒曲霉素高效液相检测法,本实验直接使用pH 3.6的醋酸-醋酸钠缓冲液制备储备液和标准工作液。在高效液相检测法中,保持PH呈酸性可以避免棒曲霉素的降解。
(2)在比较金针菇空白样和青霉菌接种样放置4天和8天所得的谱图时发现,放置8天的样品谱图中棒曲霉素的峰面积并没有增加,且并没有发现明显的分解峰。考察实验过程,发现两批次的样品过程中,唯一存在较大差异的地方在于38~40 ℃水浴上挥去溶剂过程中,由于高效液相色谱仪使用无空缺,因此溶剂挥干后没有立即配制成供试品溶液进行检测,我们猜测可能是:①由于棒曲霉素在干燥条件下不稳定,易降解;②由于棒曲霉素在生成的环境中,随着时间的延长有可能含量下降,就像植物中某一成分,在某一时间含量达到最高,以后随着时间的延长含量在下降。③实验所采取的提取净化方法效率太低,导致供试品中杂质太多,成分堆积,造成成分分离困难,各峰聚集,造成保留时间延后或者聚集成宽峰,并入其他峰的结果。
参考文献:
[1] 毕志树,郑国扬,李泰辉. 广东大型真菌志[M]. 广州:广东科技出版社,1994.
[2] 刁治民,刘禹宏,田玉华. 青海药用蕈菌[M]. 西宁:青海人民出版社,1994.
[3] 夏红民,岳宁,张鹏.出入境农产品安全卫生检验的重要对象—真菌毒素检验[J].检疫科学,2000(5):56-59.
[4] 蒋雄图,虞左向.棒曲霉素[J].无锡轻工业学院学报,1989,8 (2):73-84.
[5] 朱从会.扩展青霉拮抗放线菌的分离、鉴定及其液体培养研究[D].杨凌:西北农林科技大学,2008:1-2.
[6] ABDORREZA M, ROUYA T, MARZIEH K, et a1.Enzyme-assisted extraction and ionic liquid-based dispersive liquid-liquid microextraction followed by high-performance liquid chromatography for determination of patulin in apple juice and method optimization using central composite design [J].Analytica Chimica Acta,2013,804:104-110.
[7] GOKMEN V,ACAR J,SARIOGLU K.Liquid chromatographic method for the determination of patulin in apple juice using solid-phase extraction[J].Analytica Chimica Acta,2005,543:64-69.
[8] CHO M S,KIM K,SEO E,et a1.Occurrence of patulin in various fruit juices from South Korea:an exposure assessment[J].Food Sei Biotechnol,2010,19(1):1-5.

