解析粗盐中可溶性杂质的去除
郝传梅
(江苏省启东市鹤城初级中学 226241)
复分解反应是化学反应中重要的反应类型之一,是初中化学的重点也是学习的难点,粗盐中可溶性杂质的去除则是复分解反应的很好应用.
活动一:除杂试剂的选择
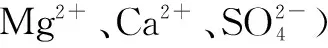
资料:一些物质的溶解性
选择试剂时应注意以下问题:(1)不能引入新的杂质;(2)为了将杂质除尽,所加试剂应过量;(3)过量的试剂在后续实验中必须除去.

OH-Cl-SO2-4CO2-3H+溶、挥溶溶、挥Na+溶溶溶溶Ba2+溶溶不不Ca2+微溶微不Mg2+不溶溶微
活动二:除杂试剂的添加顺序
思考:所选试剂按照怎样的顺序添加?
1.Na2CO3溶液的作用是除去杂质CaCl2和过量的BaCl2,所以Na2CO3溶液要在BaCl2溶液之后加入;
2.稀盐酸的作用是除去过量的NaOH和Na2CO3,所以稀盐酸必须最后加入;
3.过滤操作必须要在加入稀盐酸之前进行.
加入试剂顺序:
①NaOH—BaCl2—Na2CO3—HCl
②BaCl2—NaOH—Na2CO3—HCl
③BaCl2—Na2CO3—NaOH—HCl
注:加入试剂稀盐酸之前应进行过滤.
分析除杂思路:(以NaOH、BaCl2、Na2CO3、HCl为例)
归纳与小结:
除杂的原则:不增、不减、易分离
(不增加新的杂质;不减少要保留的物质;将杂质转化为沉淀、气体或水等易分离的物质)
例粗盐水中含有少量可溶性杂质(MgCl2、CaCl2、Na2SO4),现从中提纯NaCl固体.

(1)操作a的名称是____,该操作需要用到的玻璃仪器有烧杯、____、玻璃棒.
(2)加入NaOH溶液可除去的阳离子是____(填离子符号),其反应的化学方程式是____.
(3)试剂乙的名称____,作用是除去杂质____和过量的____.
(4)加入适量稀盐酸的作用是除去滤液中的 ____、____(填化学式),其中发生中和反应的化学方程式是____.
答案:(1)过滤 漏斗

(3)碳酸钠 CaCl2BaCl2(4)NaOH Na2CO3
练习:
1.粗盐提纯中多次使用到玻璃棒,下列有关玻璃棒作用叙述不正确的是( ).
A.溶解粗盐时,用玻璃棒进行搅拌,加快食盐溶解
B.倾倒液体时,用玻璃棒引流,防止液体飞溅
C.过滤时,用玻璃棒在漏斗内搅拌,加快过滤速度
D.蒸发时,用玻璃棒搅拌,使液体均匀受热
答案:C
2.下列有关说法不正确的是( ).
A.用溶解、过滤的方法能除去粗盐中的泥沙等不溶性杂质
B.除去NaCl溶液中的Na2SO4,可以加入适量的BaCl2溶液
C.除去NaCl溶液中的CaCl2,可以加入适量的K2CO3溶液
D.通过蒸发溶剂的方法除去氯化钠溶液中的水,得到食盐晶体
答案:C
A ②③④⑤① B ②④③⑤①
C ④②③①⑤ D ④③②①⑤
答案:B
4.Na2SO4是制造纸张、药品、染料稀释剂等的重要原料.某Na2SO4样品中含有少量MgCl2和CaCl2,实验室提纯Na2SO4的流程如图所示.

(1)操作a的名称是____,该操作需要用到的玻璃仪器有烧杯、____、漏斗.
(2)加入Na2CO3溶液可除去的阳离子是____(填离子符号),其反应的化学方程式是____.
(3)若添加的NaOH溶液和Na2CO3溶液过量,可加入适量的____(填名称)除去,其中除去过量Na2CO3溶液反应的化学方程式是____.
(4)为了证明步骤②所加的NaOH溶液已过量,某同学取少量②反应后的上层清液,向其中继续加入NaOH溶液,若____(填实验现象),则证明NaOH溶液已过量.
答案:(1)过滤 玻璃棒


(4)无白色沉淀生成
参考文献:
[1]人民教育出版社.化学九年级上册[M].北京:人民教育出版社,2016.
[2]沪教版出版社.化学九年级下册[M].上海:上海教育出版社,2016.
[3]中华人民共和国教育部.义务教育化学课程标准:2011年版[M].北京:人民教育出版社,2011.

