火腿发酵过程理化性质研究
◎ 早春娟
(德宏职业学院,云南 芒市 678400)
火腿是云南省的传统风味发酵肉制品,据宣威县志记载,清朝雍正年间,就有宣威火腿的称呼,已有270 多年的历史,被众多美食爱好者追捧。现阶段云南火腿的生产主要有2 种方式:工厂加工生产和家庭、小作坊生产,两者共同构成了云南本地火腿产业的盛况。虽然云南火腿市场发展得如火如荼,但均存在问题:①随着科学技术的进步,肉制品品种增加,消费者的选择范围增大,大量外国火腿的涌入,强占了本地火腿市场,导致云南本地火腿销售量减少。②云南省是多民族聚居区,受天气、地理环境、饮食喜好等因素的影响,各民族均有制作火腿的习惯。但均属于家庭小作坊生产,工艺落后,质量难控制,其制作过程无正规生产设备、条件差、消毒不严,容易产生各种病菌,存在食品安全隐患。这些问题严重影响了云南火腿产业的发展,使其民族品牌的继承和发展受到了较大冲击[1]。
本试验将汉氏德巴利酵母属酵母菌、克氏微球菌和变异微球菌作为火腿发酵剂,接种于干腌猪肉中,在人工控温条件下发酵,检测火腿发酵过程中的理化指标,并对火腿的品质变化进行分析,为云南火腿的发展提供重要的参考和借鉴意义。
1 材料与方法
1.1 试验材料
新鲜猪后腿肉。
1.2 主要药品和试剂
浓盐酸、无水乙醇、石油醚、营养琼脂、乙醚、孟加拉红、氯化钠、马铃薯葡萄糖琼脂、石英砂、氢氧化钠、亚硝酸钠、白砂糖、食盐以及酚酞。
1.3 仪器与设备
高压蒸汽灭菌锅、无菌操作台、分析天平、索氏抽提仪、pH 计、数显电热恒温培养箱、数显恒温水浴锅、电热鼓风干燥箱、移液枪、培养皿、碱式滴定管、研钵、打浆机、干燥皿、色差仪、移液管、涂布棒、无菌注射器、三角瓶以及容量瓶等。
1.4 试验流程
对健康优质的新鲜猪后腿肉进行处理修整,除去脂肪、结缔组织、筋腱以及肌膜。用腌制剂(食盐、4%白砂糖、1%亚硝酸钠)在4 ℃下腌制24 h,腌制后按4%的接种量用无菌注射器接种汉氏德巴利酵母属酵母菌、克氏微球菌和变异微球菌按1 ∶1 ∶2 配制的发酵剂,悬挂于30 ℃的恒温培养箱中发酵。
1.5 菌落总数的测定方法
本试验参照GB/T 4789.2-2010《食品安全国家标准 食品微生物学检验 菌落总数测定》。在无菌操作台上取10 g 肉样置于研钵中,并加入无菌石英砂将其捣碎,转入盛有90 mL 无菌生理盐水的三角瓶中,进行充分混匀,制成1 ∶10 的均匀稀释液。
取1 mL 1 ∶10 稀释液注入含有9 mL 无菌水的试管中,另换一支1 mL 无菌吸管反复吹吸,得1 ∶102稀释液。重复上述操作,得1 ∶103、1 ∶104、1 ∶105稀释液。
将营养琼脂注入培养皿中,待冷却凝固后,从最高稀释度向前(包含最高稀释度)取3 个稀释度的菌悬液各取2 个0.2 mL。分别用涂布棒将菌液均匀涂布在培养基表面,倒置放入(36±1)℃的培养箱中培养(48±2)h。
选取菌落数在30 ~300 CFU,无蔓延菌落生长的平板计数菌落总数。低于30 CFU 的平板记录具体菌落数,大于300 CFU 的可记录为多不可计。每个稀释度的菌落数应采用2 个平板的平均数[2]。根据式(1)计算总菌数。

1.6 酵母计数的试验方法
酵母菌数的测定方法与1.5 菌落总数的测定方法相同,但计数培养基采用孟加拉红培养基。
1.7 水分含量的检测方法
水分含量的检测方法参考GB/T 9695.15-2008《肉与肉制品 水分含量测定》。将称量瓶置于104 ℃的干燥箱中,瓶盖倾斜放置在瓶边,加热45 min,烘干取出盖好,置于干燥箱中,冷却至室温,称量称量瓶质量M1,单位精确到1 mg。重复干燥至前后两次连续称量结果之差小于2 mg。精确称取试样5 g 于称量瓶中。将称量瓶及内含物移入104 ℃干燥箱中烘干,取出,放入干燥箱中冷却至室温,精确称量试样和称量瓶质量M2,再放入干燥箱中烘干,并重复上述操作直至前后两次连续称量结果之差小于2 mg。按照公式(2)计算水分含量X1。

1.8 酸价的测定方法
称取50 g 绞碎的样品,用索氏抽提法提取其中的脂肪。称取3.000 ~5.000 g 油脂于锥形瓶中,加入50 mL 中性乙醚-乙醇混合液,振荡使脂肪溶解。冷却至室温,加入酚酞指示剂2 ~3 滴,用浓度为0.050 mol·L-1的氢氧化钾标准滴定溶液滴定,至初现微红色,且 0.5 min 内不褪色为终点。V 表示试样消耗氢氧化钾标准滴定溶液体积(mL);m 表示试样质量(g)。根据公式(3)计算酸价。

1.9 pH 的测定方法
参考GB/T 9695.5-2008《肉与肉制品pH 测定》进行测量。取10 g 样品,加入90 mL 中性蒸馏水,用打浆机将样品绞碎,用pH 计测定。
2 结果与分析
2.1 发酵过程中菌落总数的变化
按照1.5 中的试验步骤,可得图1 发酵过程中微球菌数的变化图。

图1 发酵过程中微球菌数的变化图
图1 可得,原料肉污染有微球菌,但数量相对较少。与未接种发酵剂的对照组相比,实验组的微球菌数明显高于对照组。两者在发酵初期都呈上升趋势,肉块的水分活度较高,微球菌繁殖迅速,数量上升较快;随着发酵时间的延长,肉块中的水分蒸发,盐浓度升高,水分活度降低,微球菌繁殖速度减慢,曲线平缓上升。发酵到第8 天时,微球菌总数达到最大(4.7×107和2.5×107),之后呈下降趋势。此时肉块水分丧失严重,为了保证产品品质,在发酵过程中应保证微球菌的繁殖。
2.2 发酵过程中酵母菌数量的变化
图2 为发酵过程中酵母菌的变化趋势。

图2 发酵过程中酵母菌的变化图
由图2 可得,新鲜肉块中没有酵母菌,发酵进行到第4 天开始有酵母菌。由此可知,酵母菌是从外部环境侵入到肉块中的,因此,通过人工接种可以提高肉块中的酵母菌数量,有助于促缩短生产周期、促进产品风味的形成和品质的提高。
2.3 发酵过程中水分含量的变化
发酵过程水分含量的变化如图3 所示。
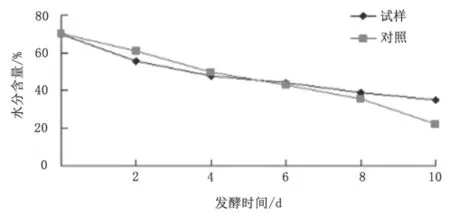
图3 发酵过程中水分含量的变化图
图3 可得,随着发酵时间的延长,水分含量均呈下降趋势;与对照组相比,试验组发酵初期水分含量下降速率明显高于对照组,这是由于在发酵初期,微生物的生长繁殖消耗了一部分水分;发酵初期两者水分含量的下降趋势略高于后期。随着发酵时间的延长,表面干燥形成硬壳,使水分蒸发速率减慢。比较发现,接种微生物可加快发酵初期水分含量降低,减少由于水分过高而导致的腐败,同时又可以在发酵后期减慢水分的蒸发,提高产品质量和成品率。
2.4 发酵过程中酸价的变化
发酵过程中酸价的变化如图4 所示。

图4 发酵过程中酸价的变化图
图4 可得,在发酵过程中,脂肪的酸价逐渐增加,并且上升趋势基本一致,说明火腿中水解产物逐渐积累;发酵结束时,酸价在4 左右。发酵过程中脂酶会促使脂肪水解,产生游离脂肪酸和甘油酯。脂酶主要来源于内源脂酶和微生物脂酶。通过比较试样和对照曲线可以得出,促使脂肪水解的关键因素是内源脂酶,而微生物脂酶对脂的分解作用不大[3]。
2.5 发酵过程中pH 的变化
发酵过程中pH 的变化如图5 所示。

图5 发酵过程中pH 的变化图
由图5 可得,宰后正常猪肉的pH 值约为6.5,在发酵初期,糖原酵解会产生乳酸,pH 值下降。之后在内源蛋白酶的作用下。蛋白质降解产生氨等碱性物质,使pH 值升高;试样与对照相比,pH 值下降快的原因可能是接种时注入了培养基[4]。进入发酵后期(第6天时),内源蛋白酶已失活,对照pH 值已呈下降趋势,而试样的pH 值却陡然上升,这是由于微球菌产生的蛋白酶会把蛋白质降解为胺、氨、游离氨基酸等碱性物质。
3 讨论
微生物的生命活动与水分含量密切相关,到发酵后期,肉块失水严重,微生物进入衰亡期。因此,在发酵过程中采取有效措施减慢水分的流失,可延长微生物对肉块的作用,促进风味的形成。
4 结论
①通过人工接种可以提高肉块中微生物数量,促进风味形成和品质提高[5]。②发酵过程中促使脂肪水解的关键因素是内源脂酶,而微生物脂酶对脂的分解作用不大[3]。③微生物会分解蛋白质产生碱性物质,提高肉块的pH 值。


