餐饮食品中罂粟壳的快速测定方法
◎ 黄 宁,丁建兰,黄恩堂,杨 希
(鹰潭市综合检验检测中心,江西 鹰潭 335000)
近年来,人们越来越关注食品中非法添加药物的问题。党的十九大报告明确指出“实施食品安全战略,让人民吃得放心”。中央已经把食品安全提高到战略高度,但在食品中非法添加罂粟壳来吸引顾客的行为,仍屡禁不止。长期食用含罂粟壳的食品会对人的神经系统、消化系统、内分泌系统造成危害。为了维护广大人民群众的身体健康,要严厉打击非法添加现象,建立快速、准确的餐饮食品中罂粟壳的测定方法具有重要意义。
餐饮食品中罂粟壳的检测方法于2018 年之前尚无国家标准,2018 年4 月市场监管总局发布的《食品中罂粟碱、吗啡、可待因、那可丁和蒂巴因的测定液相色谱-串联质谱法》补充了检验方法,由于设备资源有限,基层推广时无法直接照搬使用,给我国餐饮食品的监督管理工作带来了一定的技术难题,为进一步保障人民的饮食安全,维护人民身体健康,研究餐饮食品中罂粟壳的检测方法势在必行。笔者参考了大量文献[1-67],在相关研究的基础上,建立了一种经济、快速、准确且灵敏度高的餐饮食品中罂粟壳的检测方法。
1 仪器与材料
1.1 仪器
液相色谱/质谱联用仪(三重串联四级杆质谱)LC/MS QQQ(配四元泵、柱温箱、自动进样器、电喷雾离子源ESI,美国Agilent Technologies 1290 Inf inity Ⅱ/6460 Triple Quad LC/MS);电子天平(赛多利斯科学仪器上海有限公司MSA225P-CE)。
1.2 材料
盐酸、乙醇、正丁醇、三氯甲烷、浓氨、碘化铋钾试液、碘化汞钾试液、甲醛硫酸试液、钼硫酸试液、稀铁氰化钾试液、氢氧化钠、乙酸乙酯、甲酸、丙酮、氨水、苯、甲苯及亚硝酸钠乙醇试液为分析纯;甲醇、乙腈为色谱纯,水为超纯水。过滤用0.22 μm 滤膜。其他材料及其来源见表1 和表2。

表1 罂粟壳药材来源表

表2 标准品来源表
待测样品为市场上的牛肉粉面、烤肉串、酱卤鸡腿、 火锅底料、自制酱料及麻辣烫6 类食品共25 批样品。
2 试验条件的选择
2.1 理化反应试剂的选择
根据生物碱特性,分别用碘化铋钾试液、碘化汞钾试液、甲醛硫酸试液、钼硫酸试液和稀铁氰化钾试液与样品反应,结果显示(图1)加碘化铋钾试液(管1、3)、碘化汞钾试液(管2、4)反应效果好,阳性对照与阴性对照结果区别很明显。

图1 化学鉴别反应结果图
2.2 薄层色谱条件的选择
2.2.1 薄层板的选择
分别用硅胶G 薄层板、硅胶GF254薄层板、2%氢氧化钠溶液制备的硅胶G薄层板试验。
2.2.2 展开剂的选择
分别用乙酸乙酯-甲酸-氨水(13 ∶2 ∶1)、三氯甲烷-丙酮-氨水(16 ∶4 ∶0.3)、三氯甲烷-甲醇-氨水(13 ∶2 ∶0.3)、丙酮-苯-乙醇-氨水(20 ∶20 ∶5 ∶2)、乙酸乙酯-甲醇-氨水(85 ∶5 ∶2)以及甲苯-丙酮-乙醇-浓氨试液(20 ∶20 ∶3 ∶1)作为展开剂进行试验。
2.2.3 显色剂的选择
分别用碘化铋钾试液、亚硝酸钠乙醇试液、改良碘化铋钾试液喷在展开后的薄层板上。
2.2.4 检视条件的选择
分别在日光下、紫外光灯254 nm 下、紫外光灯365 nm 下检视。
2.2.5 结果
检视结果如图2 ~4 所示。

图2 喷显色剂碘化铋钾 试液后日光下检视图

图3 紫外光灯365 nm 下 检视图

图4 喷显色剂亚硝酸钠乙醇试液后日光下检视图
如图3 所示,薄层板用硅胶G 板较好,选择“丙酮-苯-乙醇-氨水(20 ∶20 ∶5 ∶2)”作为展开剂,5 种生物碱分离效果好,生物碱对照品点1 ~5 分离较好。显色剂选择碘化铋钾试液较理想,目标物质斑点显色清晰,呈橙红色,薄层板背景呈淡黄色,颜色均匀。如图3 中点5 所示,喷显色剂亚硝酸钠乙醇试液后,目标物质的斑点明显变成鲜艳的橘红色,斑点颜色明显,但界限不清晰,而且薄层板背景由深红棕色慢慢转白,颜色不均匀。
检视在日光下较好,如图2 所示。在紫外光365 nm下检视很不理想,目标物质没有荧光斑点,检视不出来,如图4 中点1 ~5 所示;样品中的其他杂质荧光斑点清晰,如图4 中点7 所示。
2.3 流动相的选择
试验尝试多种流动相:甲醇-0.02 mol·L-1乙酸铵溶液、乙腈-0.02 mol·L-1磷酸二氢钾+0.02 mol·L-1磷酸氢二钠氢溶液、乙腈-0.01mol·L-1乙酸铵溶液(pH3.0、3.5、3.8、4.0、4.3),试验表明乙腈-0.01 mol·L-1乙酸铵溶液(pH4.3)梯度洗脱分离效果最好,如图5 所示。
2.4 柱温的选择
分别在30、35、40 ℃柱温下进行试验,结果在柱温40 ℃时峰分离度和峰型最好,如图5 所示。

图5 40 ℃柱温时峰分离度图
3 方法与结果
3.1 理化反应法
3.1.1 方法
取样品5 g,加5%盐酸乙醇溶液20 mL,超声 30 min,趁热滤过,滤液蒸至近干,残渣中加5%盐酸溶液5 mL 使之溶解,分置二支试管中,一管中加碘化铋钾试液,生成橙红色沉淀;另一管中加碘化汞钾试液,生成灰白色沉淀。
3.1.2 结果判断
供试品应不呈正反应,若两管均呈正反应,则结果疑似阳性,待液-质联用法确证。
3.2 薄层色谱法
3.2.1 实验方法
(1)对照品溶液的制备。分别取吗啡、那可汀、可待因、蒂巴因及罂粟碱对照品,用甲醇分别稀释至0.2、0.2、0.4、0.8 mg·mL-1与0.4 mg·mL-1的溶液,即得单个对照品溶液。将5 种对照品溶于同一容量瓶中,得混合对照品溶液。
(2)样品溶液的制备。取样品10 g,加甲醇30 mL 加热回流30 min,趁热滤过,滤液蒸至近干,残渣加甲醇1 mL 溶解。
(3)薄层板。硅胶G 板。
(4) 展 开 剂。 丙 酮∶苯∶乙 醇∶氨 水(20 ∶20 ∶5 ∶2)。
(5)检视。喷碘化铋钾显色剂,标准品与阳性样品应出现明显的橙红色斑点。
3.2.2 结果判断
供试品色谱中,在与对照品色谱相应的位置上,不得显相同颜色的斑点。若显相同颜色的斑点,则为疑似阳性,待液-质联用法确证。
3.3 液-质联用法
3.3.1 标准曲线的制备
分别精密称取吗啡、那可汀、可待因、蒂巴因及罂粟碱对照品,吗啡用甲醇稀释成系列浓度40、50、100、200、300、400 ng·mL-1及500 ng·mL-1,可待因用甲醇稀释成系列浓度40、50、100、200、300、400、500、1 000 ng·mL-1及2 500 ng·mL-1,罂粟碱、蒂巴因和那可汀用甲醇稀释成系列浓度2、4、8、10、20、40、60、80 ng·mL-1及100 ng·mL-1,分别精密吸取标准溶液各5μL,注入液-质联用仪分析后得到不同浓度的峰面积,以峰面积为纵坐标,罂粟壳生物碱浓度 (ng·mL-1)为横坐标,分别进行线性回归分析。
3.3.2 样品溶液的制备
称取样品5 g(精确至0.01 g)于50 mL 聚四氟乙烯具塞离心管中,加水5 mL,振摇使之分散均匀(有些不易摇散的样品,必要时可加水10 mL),加入乙腈15 mL,涡旋振荡1 min,加入6 g 无水硫酸镁和1.5 g 无水乙酸钠的混合粉末,迅速振摇。涡旋振荡 1 min,以4 000 r·min-1离心5 min,精密量取上清液 10 mL,用经活化的C18小柱净化,用10 mL 甲醇洗脱,收集洗脱液,氮吹至干,用甲醇定容至2 mL,经 0.22 μm 滤膜过滤,待测。
3.3.3 色谱条件
以十八烷基硅烷键合硅胶为色谱柱填充剂(规格为2.1 mm×100 mm,5 μm),柱温40 ℃,流速 0.2 mL·min-1,检测波长:250 nm,扫描波长范围 200 ~400 nm,进样量5 μL,以乙腈为流动相A,0.01 mol·L-1乙酸铵溶液(pH4.3)为流动相B,按表3进行梯度洗脱。

表3 洗脱条件表
3.3.4 质谱条件ESI 离子源干燥气温度300 ℃,干燥气流速11 L·min-1,毛细管电压4 000 V,正扫描模式,MRM 多反应监测,待测化合物监测母离子、子离子、碎裂电压及碰撞能等质谱参数见表4。
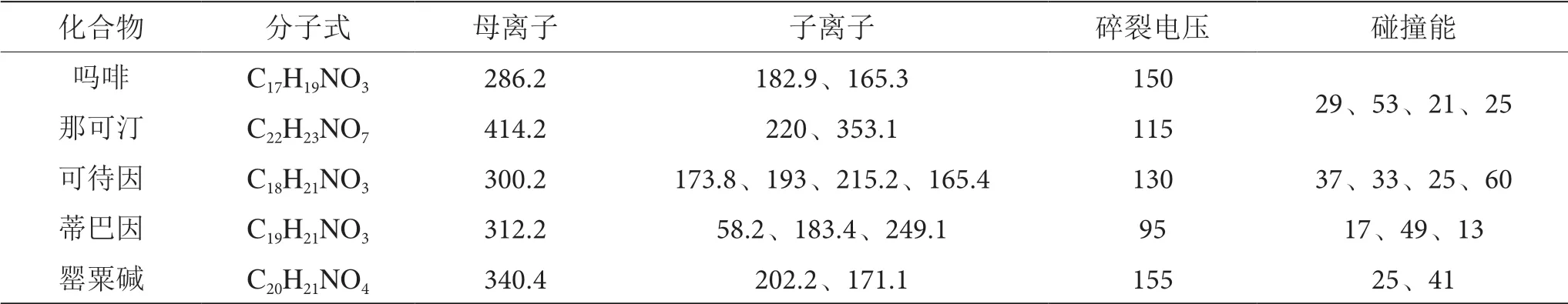
表4 待测化合物的质谱参数表
3.3.5 测定法
分别精密吸取供试品溶液和标准曲线溶液各 5 μL,注入液-质联用仪,记录色谱图。
3.3.6 结果判断
供试品色谱中,应不得出现与标准品色谱保留时间一致的色谱峰。若出现保留时间相同的色谱峰,则相应的一级质谱及二级质谱均不得与对照品一致。若色谱图、一级质谱及二级质谱均与对照品一致,结果判定为阳性。阳性结果按式(1)定量计算。

式(1)中:X—试样中待测组分的含量,单位为mg·kg-1。
ρ—从标准曲线得到的试样中待测组分的含量,单位为ng·mL-1。
V—试样的体积,单位为mL。
m—试样的质量,单位为g。
n—样品稀释倍数。
计算结果保留三位有效数字,在重复性条件下,获得的两次独立测定结果的绝对差值不得超过算术平均值的20%。
3.3.7 线性关系考察
按2.2.3 做标准曲线,进行线性回归,吗啡、可待因、罂粟碱、蒂巴因、那可汀的线性方程及相关系数如表5 所示。

表5 吗啡、可待因、罂粟碱、蒂巴因、那可汀的回归方程表
3.3.8 定量限
将已知低浓度的罂粟壳生物碱对照品溶液,按3.3.3 至3.3.6 所述方法测定,以信噪比(S/N)为10 ∶1 时的浓度为定量限(LOQ),吗啡、可待因、罂粟碱、蒂巴因及那可汀的定量限分别为2.4×10-2、2.4×10-2、6×10-4、6×10-4mg·kg-1及6×10-4mg·kg-1。
3.3.9 精密度
将混合标准品连续进样6 次,记录其峰面积,精密度用峰面积变化的相对标准偏差(RSD)表示,吗啡、可待因、罂粟碱、蒂巴因和那可汀的峰面积的RSD 值分别为1.32%、4.63%、1.11%、0.56%及1.77%,RSD均小于5%,表明精密度良好。
3.3.10 稳定性试验
在室温条件下,将同一份样品溶液每隔一段时间(0、2、4、8 h 及12 h)测定一次,计算吗啡、可待因、罂粟碱、蒂巴因且那可汀峰面积变化的相对标准偏差(RSD),分别为3.38%、1.38%、4.44%、4.99%及3.60%。说明样品在12 h 内稳定性好。
3.3.11 回收率试验
分别精密称取相同质量的样品10 份,一份不加标准品,作为测定本底值的样品。另外9 份分别加入高、中、低3 种浓度的标准品制备供试液,每种浓度重复3 次,计算其样品加标回收率,吗啡的平均加标回收率是78.28%~103.62%,可待因的平均加标回收率是80.86%~108.80%,罂粟碱的平均加标回收率是84.21%~101.61%,蒂巴因的平均加标回收率是74.63%~96.40%,那可汀的平均加标回收率是 76.26%~91.08%。表明本法准确度良好。
4 应用
用本法对市场上的牛肉粉面、烤肉串、酱卤鸡腿、火锅底料、自制酱料及麻辣烫6 类食品共25 批样品进行测定,结果均未检出吗啡、那可汀、可待因、蒂巴因及罂粟碱。方法检测准确率达100%,经理化反应法、薄层色谱法及液-质联用法检测,确实未检出罂粟壳生物碱。
5 讨论
目前大多研究只采用液相色谱-质谱联用仪测定罂粟壳中的生物碱,但液相色谱-质谱联用仪价格昂贵,维护费用高,考虑到基层监管部门仪器设备的有限性和监测方法的可行性,笔者建立的方法经济快捷,定量准确稳定,易于推广,为保障人民饮食安全,为加强餐饮食品非法添加的监管提供技术支撑。

