珍稀泌盐植物长叶红砂RtSOD基因的克隆及功能分析
索雅飞,杜超,李宁宁,王燕,王迎春
(内蒙古大学生命科学学院,内蒙古自治区牧草与特色作物生物技术重点实验室,内蒙古 呼和浩特010021)
逆境胁迫是制约植物生长发育,影响作物产量和品质的主要因素[1]。逆境胁迫主要分为两种:生物胁迫和非生物胁迫。目前非生物胁迫对植物生长发育的影响是人们研究的一大热点。非生物胁迫主要包括干旱、盐、高温、紫外照射等,其中盐、干旱是主要的环境抑制因素[2]。盐、干旱胁迫下植物体内会积累过多的活性氧,如:-OH,O2-·,H2O2等,活性氧会导致膜脂过氧化,对膜质造成损伤,形成氧化胁迫,严重影响植物的生长发育[3]。因此,抗氧化系统的研究对了解植物抗逆机制具有重要意义。
超氧化物歧化酶(superoxide dismutase, SOD),是生物体内普遍存在的金属酶,是一种极有效的抗氧化剂[4],其主要功能是清除生物体内过多的O2-·,防止膜脂过氧化,使植物细胞免受O2-·的破坏[5-6],SOD作为植物体中抗氧化酶系统中的第一道防线,对植物抵御逆境胁迫发挥着重要作用。目前,SOD基因已从拟南芥(Arabidopsisthaliana)[7]、烟草(Nicotianatabacum)[8]、水稻(Oryzasativa)[9]、小麦(Triticumaestivum)[10]、豌豆(Pisumsativum)[11]、番茄(Lycopersicumesculentum)[12]、陆地棉(Gossypiumhirsutum)[13]等多种植物中被克隆,且研究表明,在拟南芥、烟草、苜蓿(Medicagosativa)等植物中过表达不同的SOD基因均可提高其抗逆性。例如将小麦的Cu/ZnSOD基因转入拟南芥后,拟南芥中SOD、CAT、APX、GR等酶活性及NADPH氧化酶(NOX)活性升高,植株对盐和H2O2的抗性增强[10];将拟南芥的FeSOD转入烟草中后,烟草的抗氧化性增强[7];将烟草的MnSOD转入紫花苜蓿后,MnSOD在线粒体中过量表达,结果发现植物的耐冷性增强,产量增加[8]。由此可见,SOD基因作为植物体内重要的抗氧化相关基因与植物抗逆性密切相关,但目前这些研究主要集中在一些模式植物和农作物中,针对野生植物的研究较少。已有研究发现一些来源于野生植物的抗氧化相关基因在增强植物抗逆性方面具有突出的表现[14-15],因此,从野生植物中挖掘抗氧化相关基因并验证其功能具有重要意义。
长叶红砂(Reaumuriatrigyna),又名黄花红砂、黄花琵琶柴,隶属于柽柳科(Tamarieaceae)琵琶柴属(Reaumuria),是亚洲中部亚区东阿拉善-西鄂尔多斯特有种,内蒙古自治区重点保护植物[16-18]。长叶红砂具有盐腺、针状肉质叶片及下陷的气孔等特殊的形态结构,对盐生荒漠环境具有独特的适应性[19-25]。在对环境的适应过程中,其体内抗氧化系统被显著激活,进行活跃的解毒活动[26]。党振华[27]对长叶红砂转录组的研究发现,植物体内抗氧化相关基因SOD、POD、APX、GSH、GRX等在胁迫条件下被显著诱导表达,说明这些基因可能在长叶红砂抵抗逆境过程中发挥着重要的作用。因此,长叶红砂抗氧化系统的研究对探索植物耐盐机制,发现特有耐盐决定因子,挖掘相关抗逆基因具有重要意义。本研究利用PCR技术克隆得到RtSOD基因的开放阅读框,对其进行序列及表达分析,之后构建植物表达载体pPZP221-RtSOD,采用农杆菌介导法对拟南芥进行遗传转化,获得纯合的转基因植株后对其进行盐、干旱胁迫处理,进一步分析该基因在植物抵抗非生物胁迫过程中发挥的功能。此研究对深入了解长叶红砂在非生物胁迫下的抗氧化机制具有重要意义,为研究野生植物的抗逆机制奠定了基础,对开发和利用野生植物资源,筛选优异基因,培育抗逆牧草新品种具有重要作用。
1 材料与方法
1.1 材料
长叶红砂(Reaumuriatrigyna)种子由本实验室保存,拟南芥哥伦比亚野生型种子(Col-0)和农杆菌GV3101均由内蒙古大学祁智教授惠赠,植物表达载体pPZP221由内蒙古大学哈斯阿古拉教授惠赠。
1.2 长叶红砂幼苗培养及胁迫处理
长叶红砂种子剪去绒毛,NaClO溶液浸泡10 min,无菌水冲洗3次后将其播种于固体MS培养基中。在24 ℃、湿度70%,16 h光照/8 h黑暗条件下培养一个月,长到约10 cm高度,转移到1/2 MS液体培养基中继续生长,在液体培养基中生长10 d后,收集植物材料,分别对其根、茎、叶的RNA进行提取,3组重复,用于RtSOD基因的组织特异性分析。
挑选长势相近幼苗分别用NaCl(0、200、400、600 mmol·L-1)、PEG(20%)、4 ℃、H2O2(20 mmol·L-1)、ABA(10 μmol·L-1)处理0、3、6、12、24、48、72 h,每个处理分别为3个株系,且每个处理重复3次。收集材料,液氮速冻,提取植株RNA,然后保存于-80 ℃,用于分析不同胁迫条件下该基因在长叶红砂中的表达特性。
1.3 长叶红砂RtSOD基因开放阅读框的克隆
长叶红砂总RNA的提取参照RNA Plant Plus Regen (TaKaRa)中多糖多酚植物组织RNA提取说明书进行,cDNA合成参照PrimeScriptTMII 1st Strand cDNA synthesis kit (TaKaRa)反转录试剂盒说明书进行。根据已有的长叶红砂转录组数据库及ORF Finder找出RtSOD基因预测的开放阅读框,在其两端设计带有BamHI和KpnI酶切位点的引物,RtSOD-F:5′-CGGGATCCATGGCCACCAAC-3′;RtSOD-R:5′-GGGGTACCTCAGT TCGGAGTCAG-3′,以反转录的cDNA为模板扩增ORF,PCR反应总体系25 μL,内含10×Buffer 2.5 μL、dNTP 2 μL、上下游引物各0.5 μL、模板1 μL、Taq 酶0.5 μL、ddH2O 18 μL。反应程序:95 ℃预变性 5 min;95 ℃变性 5 s;60 ℃复性 30 s;72 ℃退火 2 min;72 ℃延伸 10 min,35个循环。PCR结束后将产物插入pMD-19T载体中,转化大肠杆菌,之后经菌液PCR验证后测序。
1.4 长叶红砂RtSOD基因的生物信息学分析
利用NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)识别开放阅读框(open reading frame, ORF)并翻译推测出氨基酸序列;通过在线软件 ProtParam(http://www.expasy.org)进行预测基因编码的蛋白分子量、理论等电点及保守结构域等;利用ClustalX和Mega5.05[28]软件分别进行多序列比对分析及系统进化树的构建。
1.5 qRT-PCR分析RtSOD基因的表达量
本实验利用Rotor Gene Q Real-time PCR Platform系统进行,RtSOD用于qRT-PCR的特异引物为RtSOD-F′:5′-AACTATCTCGCCACTCCCTCTCT-3′;RtSOD-R′:5′-TTGGGTCAAAGTAACAACTCCTTC-3′;β-Actin内参基因引物序列Actin-F′: 5′-CTGGATTCTGGTGATGGTGTGTCT-3′; Actin-R′:5′-GAACCACCGATCCAGACACTGTAC-3′。反应总体系20 μL,内含SYBR Premix Ex TaqII 10 μL、上下游引物各0.5 μL、模板1 μL、ddH2O 8 μL。反应程序为95 ℃预变性30 s,94 ℃变性5 s,60 ℃退火15 s,72 ℃延伸10 s,40个循环,溶解曲线从65~95 ℃,3次重复。用2-ΔΔCt法[28]计算不同处理条件下RtSOD基因的相对表达水平。
1.6 植物表达载体的构建
选取测序正确的阳性克隆提取质粒,利用限制性内切酶BamHI和KpnI双酶切pPZP221和pMD-19T-RtSOD质粒,琼脂糖凝胶电泳检测酶切产物,回收RtSOD基因和pPZP221载体的目的片段。将双酶切得到的目的基因片段与pPZP221真核表达载体进行连接。将连接产物转化到克隆菌中,涂到含有壮观霉素(spectinomycin, Spe)的抗性平板上过夜培养,挑菌,PCR验证,将条带正确的菌液送去测序,最终得到pPZP221-RtSOD阳性重组载体。
1.7 农杆菌介导的拟南芥遗传转化
将植物表达载体pPZP221-RtSOD转入农杆菌,在筛选培养基(LB+100 mg·L-1Spe+50 mg·L-1Rif)上获得转化菌落,PCR验证,得到RtSOD农杆菌转化菌株。
将携带重组质粒的农杆菌活化扩培后,离心收集菌体,加入5%的蔗糖溶液重悬,将A600调到0.8后加入0.1% 6-BA和0.03% Silwet L-77,混匀。挑选健壮的拟南芥进行浸染,用准备好的浸染液浸染拟南芥花序5 min后,罩膜,置于培养箱中暗培养24 h,之后在正常条件下培养。待角果成熟后,收集种子,加入变色硅胶干燥,之后进行筛选。
1.8 RtSOD转基因拟南芥纯合体的筛选及验证
将经过消毒处理的100粒转基因拟南芥T1代种子播种于含50 μg·mL-1的庆大霉素(gentamicin,Gent)的1/2MS培养基上培养,约1周后,选择长根及有4片绿色真叶的幼苗移到营养土中继续培养,待幼苗健壮,取植株组织进行PCR鉴定,方法参照TransDirectTMPlant Tissue PCR Kit 试剂盒,电泳检测PCR产物,挑选有明显条带的株系继续进行qRT-PCR验证,最终筛选出表达量较高的3个株系继续培养收获种子,之后取T2代种子继续播种于含50 μg·mL-1Gent的1/2 MS培养基上,选出呈3∶1性状分离培养皿上的阳性幼苗移至营养土中继续培养,收种子。之后取T3代的种子继续播种到抗性培养基上,筛选100%成活培养皿上的幼苗移到营养土中,得到稳定遗传的转基因拟南芥纯合体。
1.9 RtSOD转基因拟南芥抗逆性分析
1.9.1盐、干旱胁迫后RtSOD转基因拟南芥根长的测定 将野生型(WT)和RtSOD转基因拟南芥种子(S2,S5,S6)表面消毒后播种在1/2MS培养基中,培养5 d后将幼苗移到0,100,150 mmol·L-1NaCl和0,100,150,200 mmol·L-1甘露醇(mannitol)的培养基上,培养10 d后分别测定不同浓度NaCl和甘露醇处理后幼苗的根长,每个处理3次重复。
1.9.2盐、干旱胁迫后RtSOD转基因拟南芥鲜重及叶绿素含量的测定 将野生型(WT)和RtSOD转基因拟南芥种子(S2,S5,S6)表面消毒后播种在1/2 MS培养基中培养,10 d后移到营养土中继续培养20 d后,将植株分为3组,一组作为对照继续培养,一组植株用150 mmol·L-1NaCl处理10 d,另一组植株停止浇水干旱处理10 d,同一时间分别收集胁迫处理和未经胁迫处理的植株,分别测定其鲜重、叶绿素含量,之后将材料用液氮冻干,保存于-80 ℃备用。
1.9.3SOD、POD、CAT活性及MDA、脯氨酸(Pro)、H2O2含量的测定 参照科铭生物公司的SOD、POD、CAT、MDA、H2O2、Pro等检测试剂盒说明书进行测定。
1.10 盐、干旱胁迫下转基因拟南芥胁迫相关基因表达量的测定
将野生型和转基因拟南芥用盐和干旱胁迫处理后(如1.9.1所示),收集植株,液氮冻干,提取RNA后将其反转录为cDNA,利用Rotor Gene Q Real-time PCR Platform系统测定植株中拟南芥胁迫相关基因的表达量。通过登录号查找到相关基因引物序列(表1)。
2 结果与分析
2.1 长叶红砂RtSOD基因ORF的克隆
从长叶红砂转录组数据库中得到RtSOD的基因序列,在其序列两端设计带有BamHI和KpnI酶切位点的引物进行克隆,结果与预期相符,得到长为663 bp的目的条带(图1),之后进行胶回收,连接,转化,菌液PCR验证发现在663 bp处有明亮条带,表明重组菌中成功转入目的基因,将菌液送去测序。测序结果显示所得序列正确,可进行后续实验。

表1 拟南芥胁迫相关基因引物序列Table 1 The primer sequence of stress-related gene in A. thaliana
2.2 RtSOD基因氨基酸序列的生物信息学分析

图1 RtSOD基因ORF片段的PCR扩增Fig.1 The ORF amplification of RtSOD gene M:DL2000 marker; S:RtSOD gene.
氨基酸序列比对分析结果显示,RtSOD与刚毛柽柳(Tamarixhispida,GenkBank登录号AHH91635.1)、盐角草(Salicorniaeuropaea,登录号AFD50705.1)、葡萄(Vitisvinifera,登录号NP_001268067.1)、陆地棉(Gossypiumhirsutum,登录号AAZ41971.1)、拟南芥(Arabidopsisthaliana,登录号NP_565666.1)中SOD基因的同源性较高,分别为92%,84%,81%,80%和75%。多重序列比对分析发现,RtSOD属于Cu/Zn超氧化物歧化酶家族,同家族其他蛋白一样,含有部分保守结构,包含4个铜离子结合位点和4个锌离子结合位点(图2)。RtSOD与Cu/Zn超氧化物歧化酶家族的其他蛋白进行系统进化树分析,结果发现,RtSOD与柽柳科的刚毛柽柳的SOD基因亲缘关系最近,聚为一类(图3)。
2.3 RtSOD基因表达特性分析
2.3.1RtSOD基因的组织特异性表达分析 qRT-PCR分析结果显示,RtSOD在不同组织中表达量有显著差异,主要在茎中表达,根和叶中表达量均较低,表达趋势为:根<叶<茎(图4)。

图2 长叶红砂、盐角草、刚毛柽柳、葡萄、陆地棉和拟南芥SOD氨基酸序列比对Fig.2 Amino acid sequence alignment of Cu/Zn SOD from R. trigyna, S. europaea, T. hispida, G. hirsutum, V. vinifera and A. thaliana 黑色阴影表示保守氨基酸序列; 线内区域表示Cu/Zn SOD家族保守区; 星号和黑点分别代表铜、锌离子结合位点Black backgrounds show conserved amino acid. Red line show conserved region of Cu/Zn SOD superfamily proteins. Asterisks and black spot mean Cu2+ and Zn2+ binging site.

图3 RtSOD与其他植物SOD蛋白的系统进化树Fig.3 The phylogenetic tree of RtSOD and the other plants SOD protein
2.3.2不同非生物胁迫RtSOD基因表达特性分析

图4 RtSOD基因组织特异性表达分析Fig.4 Tissue specific expression analysis of RtSOD 不同小写字母表示P<0.05水平上的显著差异性The different letters mean significant difference at P<0.05.下同The same below.
qRT-PCR分析RtSOD基因在NaCl、4 ℃、20% PEG、H2O2和ABA处理后长叶红砂中的表达特性(图5)。结果显示:在不同浓度NaCl胁迫下,随浓度的升高RtSOD基因表达量呈先降低后升高之后又降低的趋势,在200和600 mmol·L-1浓度下显著低于对照组,而在400 mmol·L-1NaCl浓度下升高且显著高于对照组(图5A),因此之后选取400 mmol·L-1NaCl对其进行胁迫,分析不同时间梯度RtSOD基因的表达量,结果表明盐胁迫3和6 h时无明显差异,胁迫12 h后逐渐升高,24 h达到最高,之后逐渐降低,且48 h后显著低于对照(图5B)。在4 ℃胁迫下,随着胁迫时间的延长,RtSOD基因表达量呈先升高后降低的趋势,在12 h时达到最高,之后逐渐降低(图5C)。PEG胁迫和ABA、H2O2处理下,RtSOD基因表达量均随时间的延长呈先降低后上升之后又降低的趋势,PEG胁迫下其表达量在6 h时显著降低,12 h时达到最高(图5D)。ABA处理下3 h时显著降低,之后逐渐升高,在6 h时达到最高,之后降低(图5E)。 H2O2处理下RtSOD基因在6 h时表达量显著降低, 12 h时达到最高,之后降低(图5F)。以上结果表明不同非生物胁迫均可诱导长叶红砂RtSOD基因的表达。
2.4 植物表达载体的构建
经含KpnI和BamHI酶切位点的引物扩增RtSOD基因ORF序列后,目的基因质粒酶切后与pPZP221酶切质粒连接,构建真核表达载体pPZP221-RtSOD(图6)。阳性菌落通过PCR进行验证,上下游引物分别为RtSOD-BamHI-F、RtSOD-KpnI-R,对其质粒进行双酶切鉴定。PCR结果与预期结果一致,得到663 bp的pPZP221-RtSOD序列。重组质粒酶切后得到的两条片段与目的基因和载体片段大小相符,最终确定重组载体构建成功。

图5 RtSOD基因在不同胁迫处理幼苗中表达量Fig.5 Expression of RtSOD in R. trigyna seedlings under different stress treatments
2.5 RtSOD转基因拟南芥的鉴定
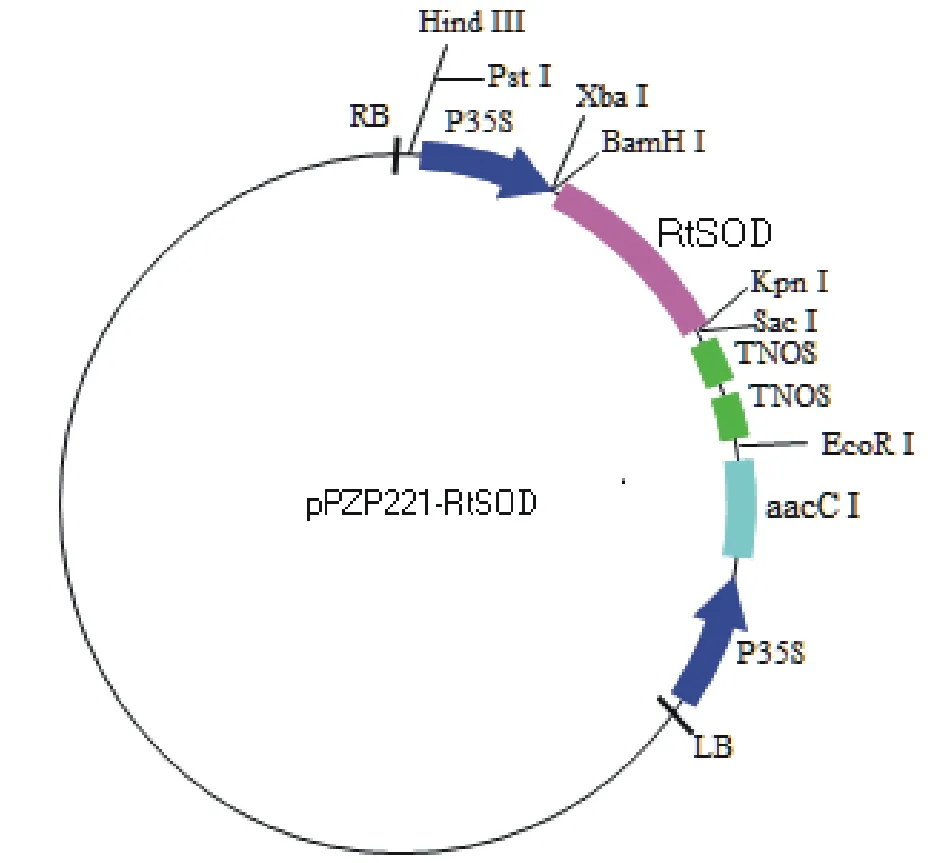
图6 pPZP221-RtSOD重组表达载体Fig.6 pPZP221-RtSOD recombinate vector
将pPZP221-RtSOD阳性重组质粒通过农杆菌介导转化拟南芥,筛选出的T1代拟南芥通过基因组PCR和qRT-PCR的方法进行鉴定,结果显示:转基因拟南芥的7个株系中S1,S2,S3,S5,S6,S7均可扩增出RtSOD的特异片段,而野生型拟南芥无扩增,说明RtSOD基因成功在S1,S2,S3,S5,S6,S76个株系中表达,而S4株系可能出现了假阳性。之后通过qRT-PCR进一步鉴定转基因株系,结果发现RtSOD在S2,S5,S6株系中表达量最高且明显高于野生型(图7),最终筛选出S2,S5,S6三个株系继续传代,在含50 μg·mL-1Gent的1/2 MS培养基上培养,到T3代获得成活率100%、稳定遗传的RtSOD转基因拟南芥植株(图8),用于后续研究。
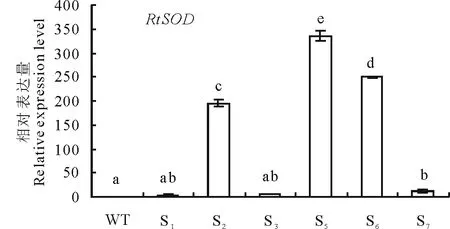
图7 RtSOD转基因拟南芥qRT-PCR验证Fig.7 qRT-PCR identification of transgenic A. thaliana

图8 抗生素培养基上筛选的T3代转基因拟南芥Fig.8 Screening of transgenic A. thaliana on medium with gentamycin
M: DL2000 marker; WT: 野生型Wild-type; S1~S7:RtSOD转基因拟南芥RtSODtransgenicA.thaliana. WT:野生型Wild-type; S2,S5,S6:转基因拟南芥TransgenicA.thaliana.下同The same below.
2.6 不同胁迫下RtSOD转基因拟南芥抗逆性分析
2.6.1RtSOD基因的过表达提高了转基因拟南芥对盐、干旱胁迫的耐受性 首先对野生型拟南芥和S2,S5,S6三个纯合的转基因株系根长进行了研究,发现在正常条件下野生型和转基因幼苗的根长无明显差别,在100、150 mmol·L-1NaCl胁迫下,幼苗根长随浓度增加逐渐缩短,但转基因株系明显长于野生型,且在150 mmol·L-1NaCl浓度下差异显著(图9)。在100、150、200 mmol·L-1甘露醇胁迫下,随着甘露醇浓度的增加幼苗生长受到影响,但转基因株系根长仍显著长于野生型(图10)。上述结果都表明RtSOD基因的过表达可提高转基因植株对盐、干旱胁迫的耐受性。
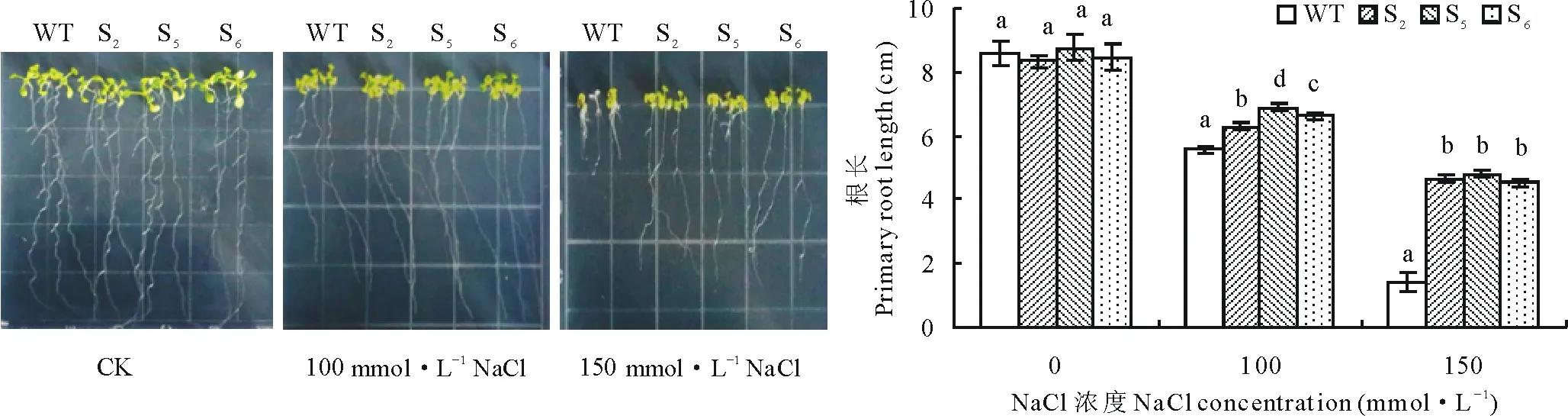
图9 NaCl胁迫下野生型和转基因拟南芥根长的检测Fig.9 Measurement of primary root length of RtSOD transgenic and wild-type A. thaliana under NaCl stress
为了进一步确定RtSOD基因与植物抗逆性的关系,对野生型和转基因拟南芥在盐、干旱胁迫下的表型进行了分析,并测定其鲜重和叶绿素含量。基于上述实验结果,选取150 mmol·L-1为最适NaCl胁迫浓度对植物进行盐胁迫,停止浇水对其进行干旱胁迫,胁迫时间10 d。结果发现:正常条件下野生型和转基因拟南芥生长状况无明显差异,盐和干旱胁迫后转基因植株明显好于野生型(图11A)。且胁迫后转基因植株的鲜重和叶绿素含量都显著高于野生型(图11B、C)。综合分析说明,RtSOD基因的过表达可提高转基因植物对盐和干旱胁迫的耐受性。
2.6.2RtSOD基因的过表达提高了转基因拟南芥在盐、干旱胁迫下的抗氧化能力 由于RtSOD基因与植物的抗氧化系统相关,因此,为了确定胁迫条件下RtSOD在拟南芥抗氧化系统中发挥的功能,检测了盐、干旱胁迫下RtSOD转基因和野生型拟南芥中SOD,POD,CAT活性,MDA、脯氨酸及H2O2含量。结果发现:在盐和干旱胁迫下,转基因拟南芥中SOD,POD,CAT活性升高且显著高于野生型(图12)。MDA和H2O2的含量较对照升高,但转基因显著低于野生型(图12)。此外,胁迫条件下,转基因拟南芥的脯氨酸含量升高且显著高于野生型(图12)。这些结果表明,RtSOD基因的过表达可提高转基因植株中的抗氧化酶活性及脯氨酸含量,降低活性氧积累,减轻膜损伤,从而提高转基因植物的抗氧化性。
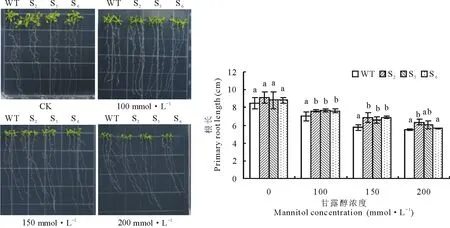
图10 甘露醇胁迫下野生型和转基因拟南芥根长的检测Fig.10 Measurement of primary root length of RtSOD transgenic and wild-type A. thaliana under mannitol stress

图11 RtSOD转基因拟南芥抗逆分析Fig.11 Resistance analysis of RtSOD transgenic A. thaliana

图12 野生型和RtSOD转基因拟南芥中SOD,POD,CAT活性及MDA,H2O2,脯氨酸含量Fig.12 SOD,POD,CAT activity and MDA,H2O2, proline content of wild-type and RtSOD transgenic A. thaliana
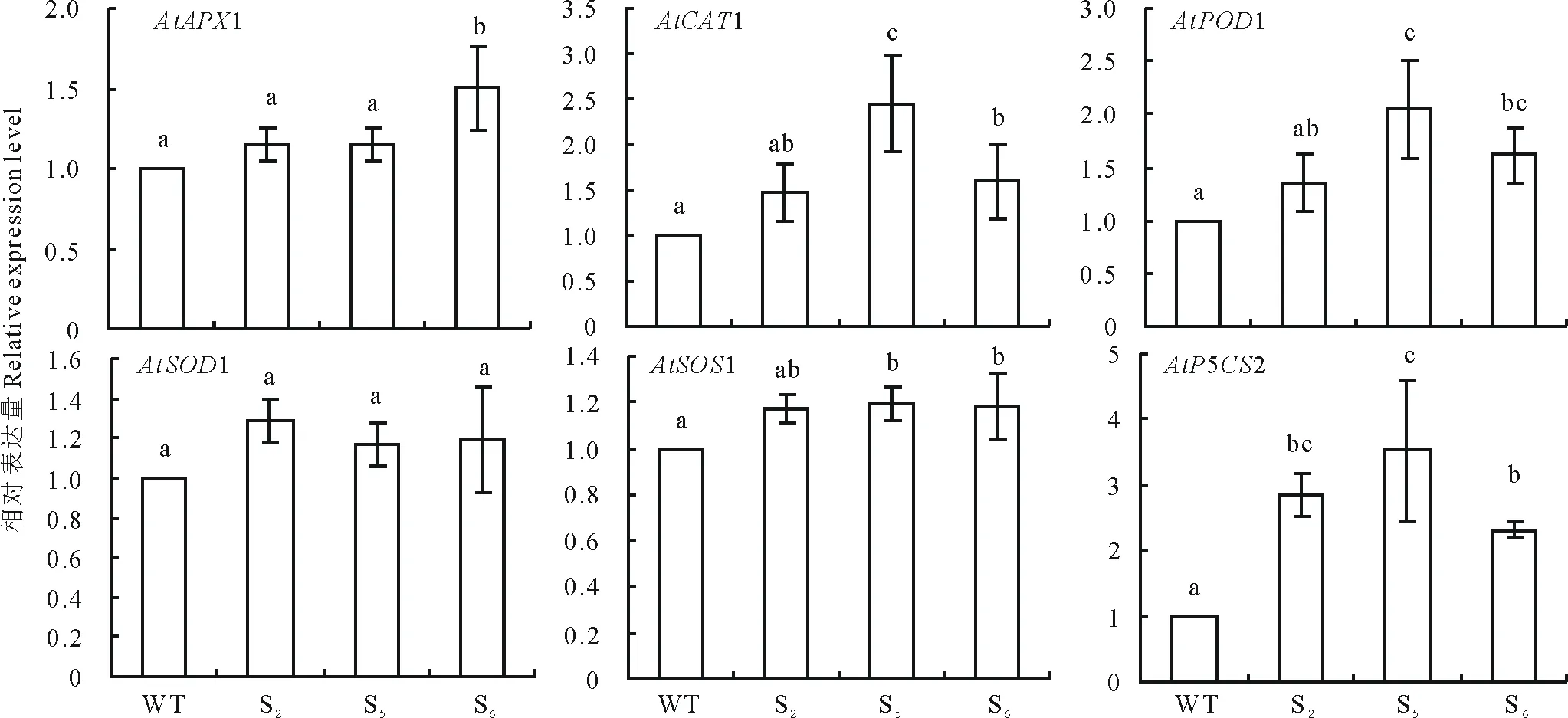
图13 NaCl胁迫下野生型和RtSOD转基因拟南芥株系中胁迫相关基因表达量分析Fig.13 Expression analysis of stress-related genes in RtSOD transgenic lines and wild-type plants under salt stress
2.6.3盐、干旱胁迫下RtSOD的过表达促进转基因拟南芥中胁迫相关基因的表达 利用qRT-PCR测定了150 mmol·L-1NaCl和干旱胁迫后转基因拟南芥中胁迫相关基因的表达量。结果显示,在盐胁迫下(图13),RtSOD转基因植株中抗氧化相关基因AtAPX1,AtCAT1和AtPOD1,盐胁迫相关基因AtSOS1及脯氨酸合成相关基因AtP5CS2表达量都显著高于野生型。干旱胁迫下,RtSOD转基因植株中抗氧化相关基因AtSOD1,AtCAT1,AtPOD1,脯氨酸合成相关基因AtP5CS1以及干旱胁迫相关基因AtRD29A的表达量都高于野生型(图14)。由此说明,盐、干旱胁迫条件下,拟南芥中RtSOD基因的过表达可能通过提高抗氧化、脯氨酸合成以及离子转运相关基因表达量,从而增强其对胁迫的耐受性。
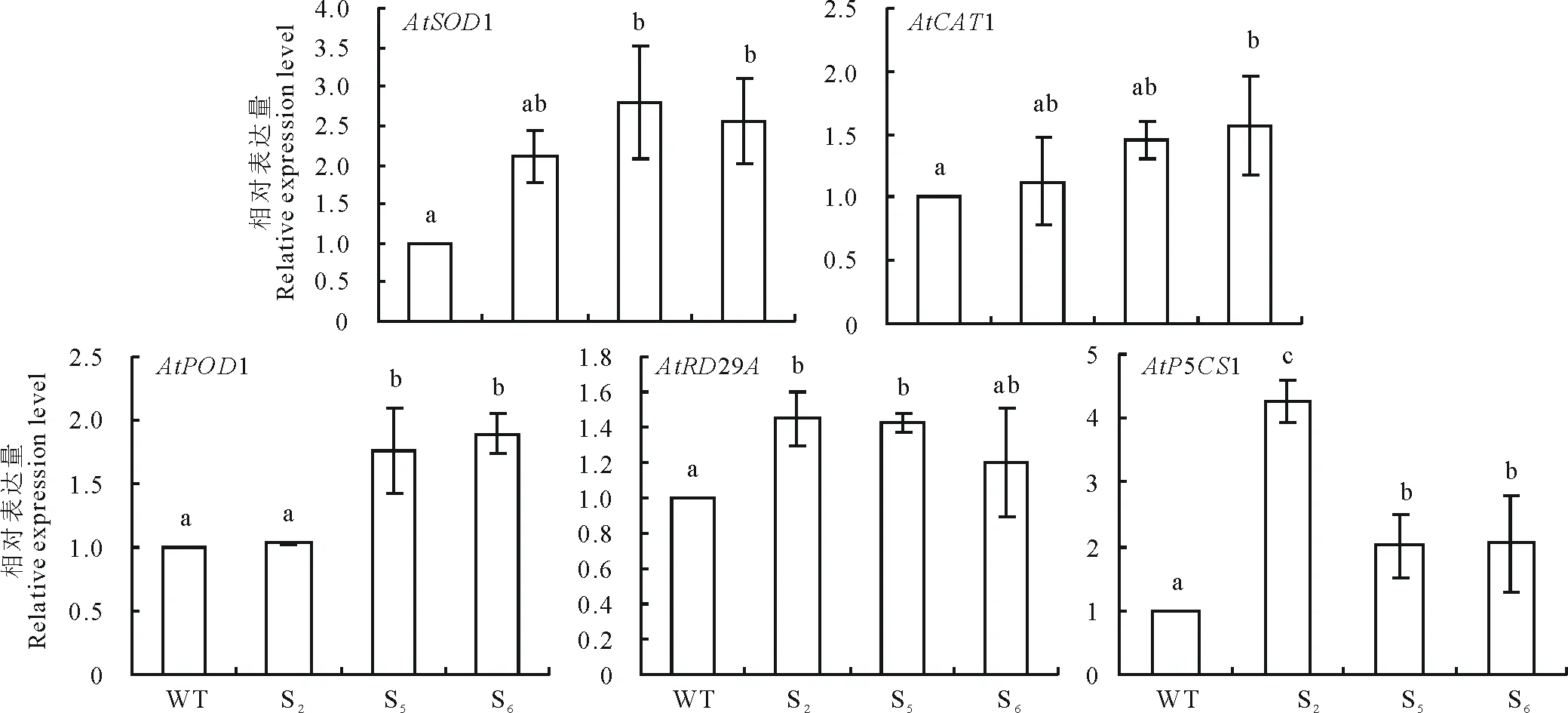
图14 干旱胁迫下野生型和RtSOD转基因拟南芥中胁迫相关基因表达量分析Fig.14 Expression analysis of stress-related genes in RtSOD transgenic lines and wild-type plants under drought stress
3 讨论
作为植物响应逆境胁迫过程中重要抗氧化酶,SOD可被多种逆境胁迫诱导表达,从而发挥作用,使得植物能够适应胁迫环境。研究发现盐、干旱、高温、低温等非生物胁迫均可诱导植物体内SOD的表达,从而提高其抗逆性[29-34]。长叶红砂作为一种独特的强旱生泌盐盐生植物,盐胁迫下其体内SOD活性明显升高,进而推测长叶红砂对荒漠环境具有极强适应性的原因之一是由于SOD活性水平的升高[26],因此,研究RtSOD基因的功能对进一步挖掘长叶红砂逆境调控机制具有深远的意义。本研究从长叶红砂中克隆得到RtSOD基因,之后根据逆境胁迫下其他植物中SOD的表达特点选取了NaCl、4 ℃、PEG、H2O2以及ABA等非生物胁迫研究RtSOD的表达特性,结果发现在4 ℃胁迫下RtSOD基因表达量呈先升高后降低的趋势,而在NaCl、PEG、H2O2以及ABA胁迫下,RtSOD基因表达量随时间变化呈先降低后升高之后又降低的趋势,说明多种环境胁迫均可诱导该基因的表达,不同胁迫下基因的表达模式有一定差异,但其表达峰值均出现在6 h以后,说明当植物遭受环境胁迫时,其体内的活性氧积累逐渐增加,当活性氧积累达到一定水平时,才会诱导植物体内RtSOD基因的表达,并达到峰值,之后随着体内活性氧被清除,其表达量降低。
将RtSOD转基因转入拟南芥,进一步研究RtSOD基因的抗逆功能,结果显示,在盐、干旱胁迫下转基因植株中的根长、生物量及叶绿素含量都较野生型高,说明RtSOD基因的过表达增强了拟南芥对非生物胁迫的耐受性。这与先前其他关于SOD基因的研究结果相一致,转基因烟草中Cu/ZnSOD基因的过表达增强其对非生物胁迫的抗性[35]。Negi等[36]的研究表明,SOD基因可通过提高植物中其他抗氧化酶活性及促进渗透调节物质的积累来增强植物抗盐能力。在本研究中发现RtSOD基因过表达后,盐和干旱胁迫条件下转基因拟南芥中SOD、POD、CAT等抗氧化酶活性及脯氨酸含量均升高,H2O2和MDA含量降低,表明RtSOD基因也可通过提高抗氧化酶活性及促进渗透调节物质积累来增强其对盐、干旱胁迫的耐受性。此外,转基因拟南芥中抗氧化相关基因AtSOD1、AtPOD1、AtCAT1,脯氨酸合成关键基因AtP5CS1,以及离子转运相关基因AtSOS1的表达量均上调,基于这些抗逆相关基因在植物抵御逆境胁迫过程中发挥的重要功能[37-39],推测RtSOD基因也可能通过诱导这些胁迫相关基因的表达来提高植物的抗氧化能力、促进植物的渗透调节能力及维持植物体内离子平衡能力,从而增强其抗逆性。
参考文献References:
[1] Boyer J S. Plant productivity and environment. Science, 1982, 218: 443-448.
[2] Das S K, Patra J K, Thatoi H. Antioxidative response to abiotic and biotic stresses in mangrove plants: A review. International Review of Hydrobiology, 2016, 101(1/2): 3-19.
[3] Potters G, Horemans N, Jansen M A. The cellular redox state in plant stress biology-A charging concept. Plant Physiology & Biochemistry, 2010, 48(5): 292-300.
[4] Alscher R G, Erturk N, Heath L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. Journal of Experimental Botany, 2002, 53: 1331-1341.
[5] Neill S J, Desikan R, Clarke A,etal. Hydrogen peroxide and nitric oxideas signalling molecules in plants. Journal of Experimental Botany, 2002, 53: 1237-1247.
[6] Bowler C, Montagu M V, Inze D. Superoxide dismutase and stress tolerance. Annual Review of Plant Biology, 2003, 43(1): 83-116.
[7] Van C W, Capiau K, Van M M,etal. Enhancement of oxidative stress tolerance in transgenic tobacco plants overproducing Fe-superoxide dismutase in chloroplasts. Plant Physiology, 1996, 112(4): 1703-1714.
[8] McKersie B D, Chen Y. Superoxide dismutase enhances tolerance of freezing stress in transgenic alfalfa (MedicagosativaL.). Plant Physiology, 1993, 103(4): 1155-1163.
[9] Feng W, Wang H, Bing L,etal. Cloning and characterization of a novel splicing isoform of the iron-superoxide dismutase gene in rice (OryzasativaL.). Plant Cell Reports, 2006, 24(12): 734-742.
[10] Wang M, Xin Z, Zhen X,etal. A wheat superoxide dismutase gene TaSOD2, enhances salt resistance through modulating redox homeostasis by promoting NADPH oxidase activity. Plant Molecular Biology, 2016, 91(1/2): 1-16.
[11] Pitcher L H, Zilinskas B A. Overexpression of copper/zinc superoxide dismutase in the cytosol of transgenic tobacco confers partial resistance to ozone-induced foliar necrosis. Plant Physiology, 1996, 110(2): 583-588.
[12] Feng K, Yu J, Cheng Y,etal. The SOD gene family in tomato: identification, phylogenetic relationships, and expression patterns. Frontiers in Plant Science, 2016, 7(131): 1279.
[13] Hu G H, Yu S X, Fan S L,etal. Cloning and expression of the chloroplast copper/zinc-superoxide dismutase gene in upland cotton (GossypiumhirsutumL.). Journal of Plant Physiology and Molecular Biology, 2007, 33(33): 197-204.
[14] Li K, Pang C H, Ding F,etal. Overexpression ofSuaedasalsa, stroma ascorbate peroxidase inArabidopsis, chloroplasts enhances salt tolerance of plants. South African Journal of Botany, 2012, 78(1/2): 235-245.
[15] Yang Y L, Shi R X, Wei X L,etal. Effect of salinity on antioxidant enzymes in calli of the halophyteNitrariatangutorumBobr. Plant Cell, Tissue and Organ Culture (PCTOC), 2010, 102(3): 387-395.
[16] Zhao Y Z. Vascular plants of plateau ordos. Hohhot: Inner Mongolia University Press, 2006: 47.
赵一之. 鄂尔多斯高原维管植物. 呼和浩特: 内蒙古大学出版社, 2006: 47.
[17] Ma Y Q. Inner Mongolia flora (Volume 3). Hohhot: Inner Mongolia People’s Publishing House, 1989: 519-522.
马疏泉. 内蒙古植物志(第三卷).呼和浩特: 内蒙古人民出版社, 1989: 519-522.
[18] Yang C, Wang Y C, Liu Q,etal. Conservation biology ofTetraenamongolicaMaxim. Beijing: Science Press, 2002.
杨持, 王迎春, 刘强, 等. 四合木保护生物学. 北京: 科学出版社, 2002.
[19] Xue Y, Wang Y C, Wang T Z. Physiological and biochemical mechanisms of an endemic halophyteReaumuriatrigynaMaxim under salt stress.Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(1): 136-142.
薛焱, 王迎春, 王同智. 濒危植物长叶红砂适应盐胁迫的生理生化机制研究. 西北植物学报, 2012, 32(1): 136-142.
[20] Xue Y, Wang Y C. Study on characters of ions secretion fromReaumuriatrigyna. Journal of Desert Research, 2008, 28(3): 437-442.
薛焱, 王迎春. 盐生植物长叶红砂泌盐特性的研究.中国沙漠, 2008, 28(3): 437-442.
[21] Xue Y, Wang Y C. Influence of light, temperature and salinity on seed germination ofReaumuriatrigynaMaxim. Plant Physiology Communications, 2007, 43(4): 708-710.
薛焱, 王迎春. 光照, 温度和盐分对长叶红沙种子萌发的影响. 植物生理学通讯, 2007, 43(4): 708-710.
[22] Dang Z H, Zheng L L, Feng Z,etal. Cloning and sequence analysis of the plasma membrane Na+/H+antiporter cDNA in recretohalophyteReaumuriatrigynaMaxim. Acta Agriculturae Boreali-Sinica, 2013, 28(3): 1-6.
党振华, 郑琳琳, 冯智, 等. 泌盐植物长叶红砂质膜Na+/H+逆向转运蛋白基因(RtSOS1)全长cDNA 的克隆及序列分析. 华北农学报, 2013, 28(3): 1-6.
[23] Dang Z H, Zheng L L,Wang Y C,etal.Transcriptomic profiling of the salt-stress response in the wild recretohalophyteReaumuriatrigyna. BMC Genomics, 2013, 14(1): 29.
[24] Dang Z H, Qi Q, Zhang H R,etal. Identification of salt-stress-induced genes from the RNA-Seq data ofReaumuriatrigynausing differential-display reverse transcription PCR. International Journal of Genomics, 2014, 2014: 1-16.
[25] Wang J, Zheng L L, Gu T P,etal. Cloning and expression analysis of two WRKY transcription factors from the rare recretohalophyteReaumuriatrigyna. Acta Prataculturae Sinica, 2014, 23(4): 122-129.
王佳, 郑琳琳, 顾天培, 等. 珍稀泌盐植物长叶红砂两个WRKY转录因子的克隆及表达分析. 草业学报, 2014, 23(4): 122-129.
[26] Xue Y, Wang Y C, Wang T Z. Responses of antioxidant system of an endemic halophyteReaumuriatrigynato NaCl stress. Journal of Desert Research, 2012, 32(6): 1659-1673.
薛焱, 王迎春, 王同智. 盐胁迫对濒危植物长叶红砂抗氧化系统的影响. 中国沙漠, 2012, 32(6): 1659-1673.
[27] Dang Z H. Transcmptomic study of the salt-stress response in the revretohalophyteReaumuriatrigynanative to alxadesert. Huhhot: Inner Mongolia University, 2013.
党振华. 阿拉善荒漠区珍稀泌盐植物长叶红砂响应盐胁迫的转录组学研究. 呼和浩特: 内蒙古大学, 2013.
[28] Zhang H R. Analysis the function of key genes in flavonoid biosynthetic pathway and the pathway in response to abiotic stresses inReaumuriatrigyna. Huhhot: Inner Mongolia University, 2016.
张慧荣. 长叶红砂黄酮类化合物合成相关基因功能分析及其对逆境胁迫的响应. 呼和浩特: 内蒙古大学, 2016.
[29] Li A H, Na B K, Ahn S K,etal. Functional expression and characterization of a cytosolic copper/zinc-superoxide dismutase ofSpirometraerinacei. Parasitology Research, 2010, 106(3): 627-635.
[30] Morita S, Tsukamoto S, Sakamoto A. Differences in intron-mediated enhancement of gene expression by the first intron of cytosolic superoxide dismutase gene from rice in monocot and dicot plants. Plant Biotechnology, 2012, 29(1): 115-119.
[31] Abu S. Isolation and expression analysis of chloroplastic copper/zinc superoxide dismutase gene in barley. South African Journal of Botany, 2011, 77(2): 328-334.
[32] Gómez J M, Jiménez A, Olmos E,etal. Location and effects of long-term NaCl stress on superoxide dismutase and ascorbate peroxidase isoenzymes of pea (Pisumsativumcv.Puget) chloroplasts. Journal of Experimental Botany, 2004, 55: 119-130.
[33] Hernández-Nistal J, Dopico B, Labrador E. Cold and salt stress regulates the expression and activity of a chickpea cytosolic Cu/Zn superoxide dismutase. Plant Science, 2002, 163(3): 507-514.
[34] Guan L, Scandalios J G.Two strucrally similar maize cytosolic superoxide dismutase genes, SodA and Sod4A, respond differently to abscisic acid and high osmoticun.Plant Physiology, 1998, 117(1): 217-224.
[35] Youngpyo L, Ahmad R, Haengsoon L,etal. Improved tolerance of Cu/Zn superoxide dismutase and ascorbate peroxidase expressing transgenic tobacco seeds and seedlings against multiple abiotic stresses. International Journal of Agriculture & Biology, 2013, 15(4): 725-730.
[36] Negi N P, Shrivastava D C, Sharna V,etal. Overexpression of Cu/Zn SOD fromArachishypogaeaalleviates salinity and drought stress in tobacco.Plant Cell Reports, 2015, 34(7): 1109-1126.
[37] Du Y Y, Wang P C, Chen J,etal. Comprehensive functional analysis of the catalase gene family inArabidopsisthaliana. Acta Botanica Sinica, 2008, 50(10): 1318-1326.
[38] Tuteja N.Mechanisms of high salinity tolerance in plants.Methods in Enzymology, 2007, 428: 419.
[39] Feki K, Brini F, Amar S B,etal. Comparative functional analysis of two wheat Na+/H+, antiporter SOS1, promoters inArabidopsisthaliana, under various stress conditions. Journal of Applied Genetics, 2015, 56(1): 15-26.

