抗坏血酸引发对NaCl胁迫燕麦种子活力的影响
董秋丽,夏方山,李晓禹,王明亚,毛培胜,朱慧森,佟莉蓉,杜利霞
(1.山西农业大学林学院,山西 太谷 030801;2.山西农业大学动物科技学院,山西 太谷 030801; 3.中国农业大学动物科技学院,草业科学北京市重点实验室,北京 100193)
燕麦(Avenasativa)具有耐瘠薄及抗逆性强等优点,因其产草量高、营养价值高及适口性好,已成为解决草地畜牧业生产中冷季缺草问题的重要饲草料来源[1]。此外,燕麦籽实因富含可溶性膳食纤维β-葡聚糖、均衡蛋白质及油脂等对人类健康至关重要的营养成分,是对人类具有绿色营养保健作用的重要小杂粮作物[2]。所以,燕麦成为我国北方地区广泛种植的优质高产粮饲兼用作物,其播种面积和总产量仅次于小麦(Triticumaestivum)、玉米(Zeamays)及水稻(Oryzasativa)[3-5]。因此,探讨燕麦高效种植途径对于农牧业可持续发展及解决饲粮安全问题具有重要意义。
耐盐植物品种选育被认为是有效抑制土壤盐渍化,并科学利用盐碱地资源最有效、最经济的途径之一[6]。燕麦被认为是改良盐渍化土壤的主要先锋作物之一,种植于含盐量0.2%的土壤上能有效提高其出苗和产量[7-8]。但土壤盐渍化依然是制约燕麦生产的关键因素,尤其春季返盐季节对其种子萌发及幼苗生长发育的损害最大[9]。此外,由于燕麦籽实不饱和脂肪酸含量达80%以上,而脂肪衍生物容易酸败或劣变,致使其种子萌发过程更容易遭受逆境损伤,从而降低其种用价值[2]。因此,探究如何提高燕麦种子萌发及其幼苗生长能力是其充分利用并改良盐渍化土地的最有效途径。引发是指控制种子的水合状态,使其避免胚根突破种皮而足以发生萌发前代谢,从而改善种子在不同生态条件下的活力水平及幼苗生长潜能[10]。利用适当的小分子生理活性物质对种子进行引发处理,不仅能启动其萌发前的代谢反应,还能参与其萌发过程的代谢反应[11]。这既能有效地增强种子活力及幼苗的抗逆性,又有助于其市场流通和应用于农牧业生产。因此,如何采用生理活性物质引发提高种子活力及其抗逆性,是当下种子科学领域研究的主要热点问题之一。抗坏血酸(ascorbic acid,AsA)作为种胚细胞内普遍存在的重要小分子生理活性物质,其生物学功能的研究日益受到种子科学的重视[12]。AsA可参与种胚细胞内许多氧化还原反应及物质代谢活动,从而维持其活力水平及促进其细胞分裂与伸长[11,13]。外源AsA提高种子耐盐性的研究已在菜豆(Phaseolusvulgaris)[14]、甘蔗(Saccharum)[15]、鹰嘴豆(Cicerarietinum)[16]、小麦[17]及油菜(Brassicacampestris)[18]等植物中报道。然而,关于外源AsA引发对盐胁迫种子活力的影响研究较少。因此,试验以燕麦种子为材料,探索AsA引发对其盐胁迫条件下萌发的活力影响,为外源AsA引发促进植物种子耐盐性萌发机理的研究提供参考依据。
1 材料与方法
1.1 材料来源
供试燕麦(品种:太阳神)种子由北京正道生态科技有限公司提供,2016年进口于惠特兰种子有限责任公司(Wheatland Seed LLC),在-20 ℃保存至进行试验。种子自然含水量为7.8%,初始发芽率为100%。
1.2 含水量的测定
准确称取4.5 g燕麦种子,放入样品盒中称重(精确到0.001 g),设2次重复。称取后保持样品盒开启,放入130~133 ℃烘箱内烘干1 h,烘干后取出,盖好盒盖,放入干燥器里冷却30 min,按公式计算含水量:种子含水量=[(M2-M3)/(M2-M1)]×100%,式中:M1为样品盒和盖的重量(g);M2为样品盒、盖及样品的烘前重量(g);M3为样品盒、盖及样品的烘后重量(g)。
1.3 AsA引发处理
在20 ℃黑暗条件下,将燕麦种子分别用浓度为0、0.5、1.0、1.5和2.0 mmol·L-1的AsA引发处理0.5 h后,蒸馏水冲洗2次,用滤纸吸干表层水分,然后25 ℃室内风干至含水量为10%,每个处理重复4次。
1.4 发芽试验及指标测定
选取均匀饱满的处理种子100粒放入培养皿中,分别加入8 mL浓度为0(CK)、50、100和200 mmol·L-1的NaCl溶液,在20 ℃恒温条件下培养,每天更换NaCl溶液,设4次重复。发芽条件参照国际种子检验协会(International Seed Testing Association,ISTA)的种子检验规程(2015)[19]规定进行。每天统计种子发芽数,以第10天为末次计数,并最终测定其平均苗长,发芽率(germination percentage,Gp)按照ISTA的种子检验规程(2015)[19]进行计算,发芽指数(germination index,Gi)按照Abdul-Baki等[20]的方法进行计算,平均发芽时间(mean germination time,MGT)按照Ellis等[21]的方法进行计算。
1.5 统计分析
通过Excel 2010和SAS 8.0统计分析软件处理试验数据,采用Duncans法进行多重比较,结果以平均值±标准误表示。
2 结果与分析
2.1 AsA引发对NaCl胁迫燕麦种子发芽率(Gp)的影响
随NaCl浓度的升高,AsA浓度为1.5 mmol·L-1时,燕麦种子Gp呈先升后降的趋势,在NaCl浓度为50 mmol·L-1时显著(P<0.05)高于其浓度为0(CK)时(表1);AsA浓度为0、0.5、1.0和2.0 mmol·L-1时,燕麦种子Gp在NaCl浓度为0(CK)和50 mmol·L-1时差异不显著(P>0.05),而在其浓度为100和200 mmol·L-1时显著(P<0.05)下降。随AsA浓度的升高,燕麦种子Gp在NaCl浓度为0(CK)和50 mmol·L-1时差异不显著(P>0.05);在NaCl浓度为100和200 mmol·L-1时呈先升后降的趋势,均在AsA浓度为1.0 mmol·L-1时最高。
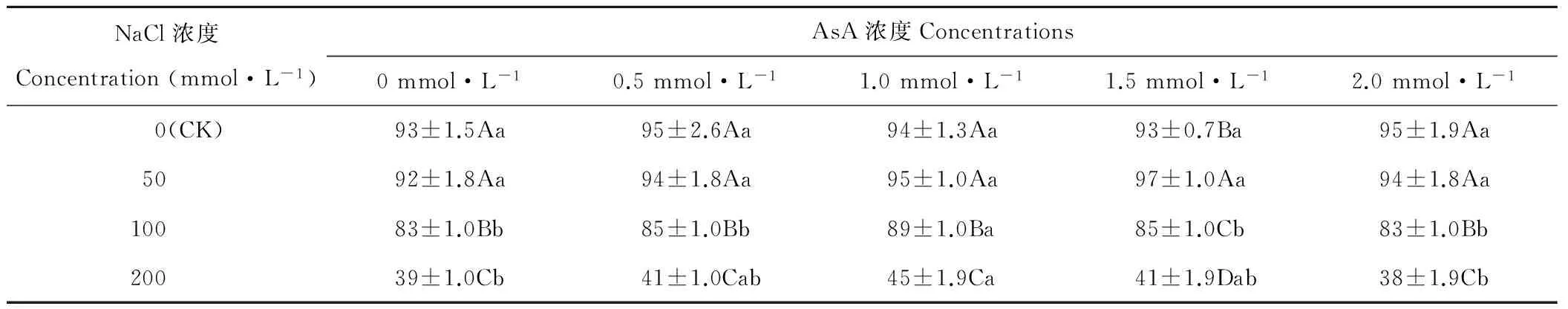
表1 AsA引发对NaCl胁迫燕麦种子发芽率的影响Table 1 Effect of AsA treatments on germination percentage in oat seeds under NaCl stress (%)
注:同列不同大写字母表示差异显著(P<0.05),同行不同小写字母表示差异显著(P<0.05)。下同。
Note: Means in the same column with different capital letters are significant differences (P<0.05), in the same row with different small letters are significant differences (P<0.05). The same below.
2.2 AsA引发对NaCl胁迫燕麦种子发芽指数(Gi)的影响
随NaCl浓度的升高,燕麦种子Gi逐渐下降(表2),但在NaCl浓度为0(CK)和50 mmol·L-1时差异不显著(P>0.05)。随AsA浓度的升高,燕麦种子Gi在NaCl浓度为0(CK)和50 mmol·L-1时呈下降趋势;在NaCl浓度为100和200 mmol·L-1时呈先升后降的趋势,均在AsA浓度为2.0时显著(P<0.05)低于其他浓度;然而,NaCl浓度为100 mmol·L-1时,燕麦种子Gi在AsA浓度为0.5 mmol·L-1时显著(P<0.05)高于1.0~2.0 mmol·L-1,但与其浓度为0时差异不显著(P>0.05);NaCl浓度为200 mmol·L-1时,燕麦种子Gi在AsA浓度为1.0 mmol·L-1时显著(P<0.05)高于其他浓度。
2.3 AsA引发对NaCl胁迫燕麦种子平均发芽时间(MGT)的影响
随NaCl浓度的升高,燕麦种子MGT逐渐增加,除AsA浓度为0和2.0 mmol·L-1时,其MGT在NaCl浓度为0(CK)和50 mmol·L-1时差异不显著(P>0.05)外,其他条件下均差异显著(P<0.05)(表3)。NaCl浓度为0 mmol·L-1时,燕麦种子MGT随AsA浓度的增加先降后升,并在AsA浓度为0.5 mmol·L-1时显著(P<0.05)低于其他浓度;NaCl浓度为50、100和200 mmol·L-1时,燕麦种子MGT随AsA浓度增加呈增加趋势,2.0 mmol·L-1时显著高于0~1.0 mmol·L-1。

表2 AsA处理对NaCl胁迫燕麦种子发芽指数的影响Table 2 Effect of AsA treatmens on germination index in oat seeds under NaCl stress
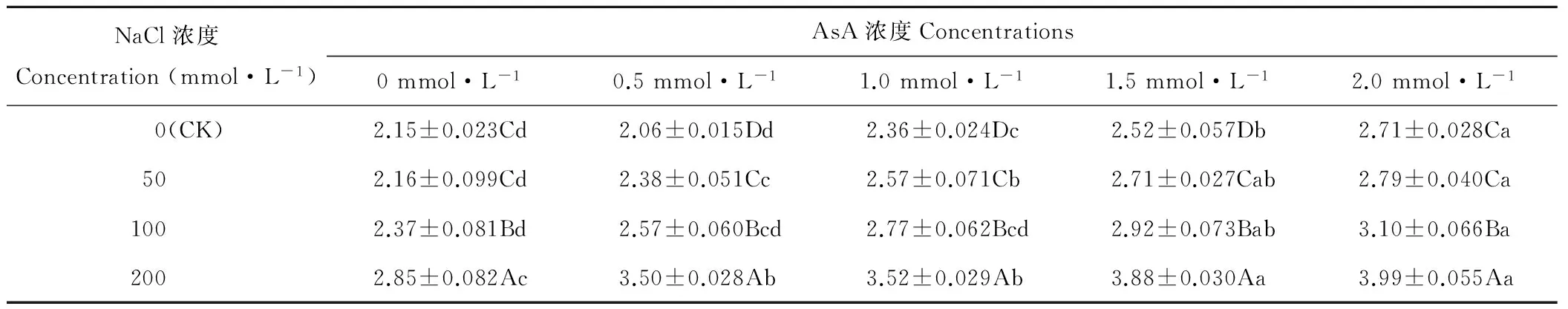
表3 AsA处理对NaCl胁迫燕麦种子平均发芽时间的影响Table 3 Effect of AsA treatments on mean germination time of oat seeds under stress (d)
2.4 AsA浓度影响NaCl胁迫下燕麦种子萌发的双因素方差分析
双因素方差分析结果表明(表4),不同NaCl浓度及AsA引发浓度对燕麦种子Gp、Gi和MGT的影响差异极显著(P<0.01),不同NaCl浓度与AsA引发浓度的交互作用对燕麦种子Gp的影响差异显著(P<0.05),对其Gi和MGT的影响均差异极显著(P<0.01)。
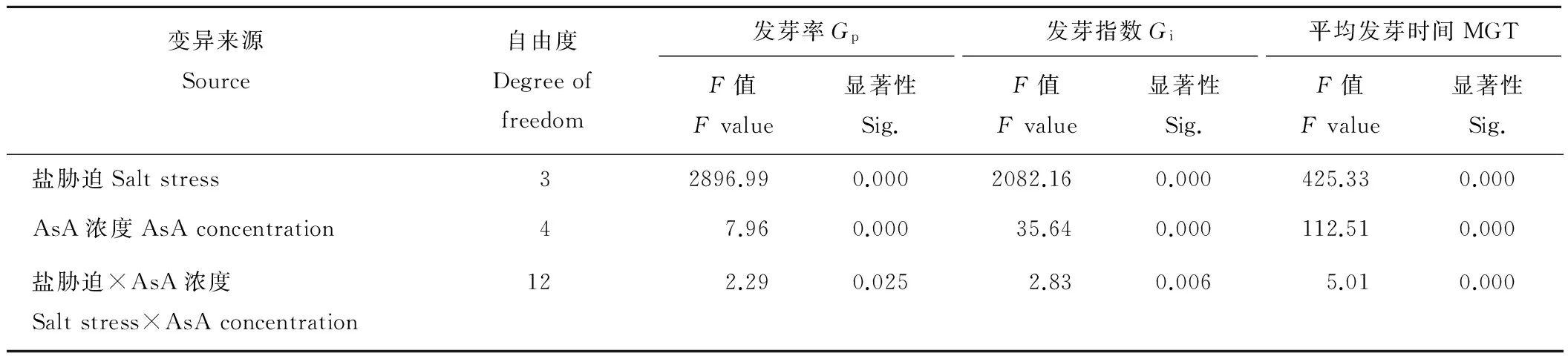
表4 AsA浓度和盐胁迫对燕麦种子活力影响的双因素方差分析Table 4 Variance analysis of AsA concentration and salt stress on oat seed vigor
Gp: Germination percentage;Gi: Germination index; MGT: Mean germination time.
3 讨论
盐胁迫是限制植物生长发育最主要、最常见的非生物胁迫,导致其产量和品质的下降,从而给农牧业生产造成巨大经济损失。盐胁迫不仅会抑制燕麦种子的萌发及幼苗生长,还会造成其产量及品质的降低[5,22]。本试验中,与CK相比,燕麦种子Gp、Gi在50 mmol·L-1的NaCl胁迫下变化不显著(P>0.05),其MGT显著(P<0.05)增大;在100和200 mmol·L-1的NaCl胁迫下,燕麦种子Gp和Gi均显著(P<0.05)下降,而其MGT则显著(P<0.05)增大。这与前人的研究结果相似,即NaCl胁迫会降低燕麦种子的活力水平。刘凤岐等[5]研究发现,NaCl胁迫显著(P<0.05)降低了燕麦种子Gp、发芽势、株高和根长,且这种抑制现象随NaCl浓度的增大而增加。此外,复合盐碱胁迫下也发现了燕麦种子Gp、发芽势、胚根及胚芽生长的降低[23]。这说明燕麦种子活力下降是限制其在盐碱地种植的关键因素。
AsA作为植物体内普遍存在的高丰度小分子生理活性物质,既能维持种子的活力水平,又能促进其萌发及幼苗生长[24]。此外,高含量的AsA会激活植物根系分生组织细胞的分裂,外源AsA处理促进植物根系的生长[25]。然而,本试验中,在NaCl浓度为0 mmol·L-1(CK)时,燕麦种子Gp随AsA浓度的增加变化不显著(P>0.05),但其Gi呈下降趋势,并在AsA浓度为1.5和2.0 mmol·L-1时显著(P<0.05)低于0和0.5 mmol·L-1,且其MGT在AsA浓度为1.0~2.0 mmol·L-1时显著(P<0.05)高于0和0.5 mmol·L-1。这说明在正常条件下,AsA引发导致了燕麦种子活力的下降。这可能与燕麦种子本身活力水平较高(初始发芽率为100%)有关,种子在正常萌发过程中AsA含量及相关抗氧化酶活性也会明显升高[26]。然而,AsA浓度的增加改变了其引发溶液的水势,从而造成燕麦种子内渗透调节物质的含量发生了变化,导致其在引发过程遭受渗透损伤[27]。因此,在农牧业生产中对AsA引发的应用要根据种子本身活力水平及萌发条件而定。
植物体内AsA含量高低直接决定了其抗逆性的强弱[28]。因此,外源AsA处理可有效促进植物种子的耐盐性萌发及幼苗生长,这已在紫花苜蓿(Medicagosativa)[29]、黄芩(Scutellariabaicalensis)[30]及油菜(Brassicacampestris)[31]等植物种子中被验证。本试验结果表明,随AsA浓度增加,燕麦种子Gp在NaCl浓度为100和200 mmol·L-1时呈先升后降的趋势,这说明AsA引发能够提高燕麦种子的耐盐性萌发。NaCl胁迫会导致植物种子内H2O2快速产生,而外源AsA可以增强酶促或非酶促抗氧化途径的作用来有效清除盐胁迫产生的H2O2,从而提高植物种子耐盐性萌发及幼苗生长[32-34]。然而,外源AsA引发提高燕麦种子耐盐性萌发及其幼苗生长的机理是否与此相同仍需进一步深入探讨。本试验中,燕麦种子Gp均在AsA浓度为1.0 mmol·L-1时显著大于其他浓度,且不同浓度AsA引发浓度对燕麦种子Gp、Gi和MTG的影响差异极显著(P<0.01),这说明AsA引发对NaCl胁迫的缓解作用与其浓度有关,以1.0 mmol·L-1的AsA引发对NaCl胁迫的缓解效果最好。江绪文等[30]研究发现适宜浓度(0.50 mmol·L-1)的AsA能提高种子的萌发能力和幼苗对盐胁迫的适应能力,从而起到缓解盐胁迫对种子萌发及幼苗生长的抑制作用。范美华等[31]也发现,20 mg·L-1的AsA处理对30%海水胁迫下油菜种子萌发及幼苗生长的缓解效果最好。外源AsA浓度的增加也会造成燕麦种子内渗透势的增强。同时,外源AsA会导致NaCl胁迫种子内可溶性糖和脯氨酸等渗透调节物质含量增加[30-31]。因此,高浓度AsA会导致NaCl胁迫燕麦种子的萌发及幼苗生长能力的下降。
然而,植物种子耐盐性萌发及幼苗生长的增强不仅与外源AsA浓度有关,还与其遭受的盐胁迫强度有关。NaCl胁迫程度越重,植物种子内H2O2积累就越多[33-34]。因此,维持种子内H2O2平衡所需的AsA就越多。试验中,燕麦种子Gp在NaCl浓度为50 mmol·L-1时变化不显著,而在NaCl浓度为100和200 mmol·L-1时呈先升后降的趋势;且不同盐胁迫及其与AsA引发浓度之间的交互作用对燕麦种子Gp、Gi和MTG的影响差异极显著(P<0.01)。因此,在农牧业生产实践中应根据燕麦种子本身活力及盐胁迫的程度采用最佳浓度的AsA进行引发处理。本试验中,随AsA浓度增加,燕麦种子Gi呈下降趋势,而其MGT呈上升趋势,说明AsA引发延长了燕麦种子萌发的时间,这可能由于外源AsA在清除NaCl胁迫过程产生的H2O2需要反应时间,而且所需的反应时间与AsA及NaCl浓度关系密切。
4 结论
外源AsA引发可提高燕麦种子在NaCl胁迫下的萌发及幼苗生长能力,且这种作用效果与AsA及NaCl的浓度有关,以1.0 mmol·L-1的AsA引发对100和200 mmol·L-1的NaCl胁迫效果最好。然而,外源AsA引发延长了NaCl胁迫下燕麦种子的MGT。
参考文献References:
[1] Gao C T, Liu J H, Zhang Y Q,etal. physiological responses of oats seedling to short-term salt stress. Acta Agrestia Sinica, 2017, 25(2): 337-343.
高彩婷, 刘景辉, 张玉芹, 等. 短期盐胁迫下燕麦幼苗的生理响应. 草地学报, 2017, 25(2): 337-343.
[2] Claudine C, Tom S, Susan R V,etal. Comparison of two headspace sampling techniques for the analysis of off-flavour volatiles from oat based products. Food Chemistry, 2012, 134(3): 1592-1600.
[3] Shewry P R, Piironen V, Lampi A M,etal. Phytochemical and fiber components in oat varieties in the HEALTHGRAIN diversity screen. Journal of Agricultural and Food Chemistry, 2008, 56(21): 9777-9784.
[4] Guo H Y, Jia J Q, Lü J H,etal. Analyses of genetic diversities and evolutions ofAvenaL. germplasm resources by ISSR. Acta Agrestia Sinica, 2014, 22(2): 344-351.
郭红媛, 贾举庆, 吕晋慧, 等. 燕麦属种质资源遗传多样性及遗传演化关系ISSR分析. 草地学报, 2014, 22(2): 344-351.
[5] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189.
刘凤歧, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[6] Dai W, Qiu G J, Shi Y G,etal. Effects of salt stress on growth and physiological characteristics ofLigustrumjapohicum‘Howardii’. Journal of Shanxi Agricultural University (Natural Science Edition), 2017, 37(3): 183-188.
戴文, 邱国金, 史云光, 等. 盐胁迫对金森女贞的生长与生理特性的影响. 山西农业大学(自然科学版), 2017, 37(3): 183-188.
[7] Han L P, Ma F J, Liu J T,etal. Analysis of oat-straw salt ion accumulation and the potential for improving saline-alkali soils in coastal Hebei province. Chinese Journal of Eco-Agriculture, 2012, 20(12): 1706-1712.
韩立朴, 马凤娇, 刘金铜, 等. 远东近滨海地区燕麦秸秆盐分积累与改良盐碱地潜力分析. 中国生态农业学报, 2012, 20(12): 1706-1712.
[8] Wu J Y, Liu J H, Zhai L J,etal. Salt tolerance of seed germination and seedling growth of different oat varieties. Chinese Journal of Ecology, 2009, 28(10): 1960-1965.
武俊英, 刘景辉, 翟利剑, 等. 不同品种燕麦种子萌发和幼苗生长的耐盐性. 生态学杂志, 2009, 28(10): 1960-1965.
[9] Liu J X, Wang J C, Jia H Y. Different between physiological responses ofAvenanudaseedling to salt and alkali stresses. Journal of Soil and Water Conservation, 2015, 29(5): 331-336.
刘建新, 王金成, 贾海燕. 燕麦幼苗对盐胁迫和碱胁迫的生理响应差异. 水土保持学报, 2015, 29(5): 331-336.
[10] Xia F, Chen L, Yan H,etal. Antioxidant and ultrastructural responses to priming with PEG in aged, ultra-dry oat seed. Seed Science and Technology, 2016, 44(3): 1-13.
[11] Bewley J D, Bradford K J, Hilhorst H W M,etal. Seeds: Physiology of development, germination and dormancy. 3rd. New York: Springer, 2013.
[12] Yu L, Liu Y H, Yuan W C,etal. Recent advances in the study of accumulation of ascorbic acid and its molecular mechanism in plants. Chinese Bulletin of Botany, 2016, 51(3): 396-410.
俞乐, 刘拥海, 袁伟超, 等. 植物抗坏血酸积累及其分子机制的研究进展. 植物学报, 2016, 51(3): 396-410.
[13] Lee Y P, Baek K H, Lee H S,etal. Tobacco seeds simultaneously over-expressing Cu/Zn-superoxide dismutase and ascorbate peroxidase display enhanced seed longevity and germination rates under stress conditions. Journal of Experiment Botany, 2010, 61(9): 2499-2506.
[14] Saeidi-Sar S, Abbaspour H, Afshari H,etal. Effects of ascorbic acid and gibberellin A3on alleviation of salt stress in common bean (PhaseolusvulgarisL.) seedlings. Acta Physiologiae Plantarum, 2013, 35(3): 667-677.
[15] Ejaz B, Sajid Z A, Aftab F. Effect of exogenous application of ascorbic acid on antioxidant enzyme activities, proline contents, and growth parameters ofSaccharumspp. hybrid cv. HSF-240 under salt stress. Turkish Journal of Biology, 2012, 36(6): 630-640.
[16] Beltagi M S. Exogenous ascorbic acid (vitamin C) induced anabolic changes for salt tolerance in chick pea (CicerarietinumL.) plants. African Journal of Plant Science, 2008, 2(10): 118-123.
[17] Chang Y X, Xu K D, Zhou L,etal. Ascorbic acid mitigating the inhibition of salt stress to wheat seedling growth. Journal of Triticeae Crops, 2013, 33(1): 151-155.
常云霞, 徐克东, 周琳, 等. 抗坏血酸对盐胁迫下小麦幼苗生长抑制的缓解效应. 麦类作物学报, 2013, 33(1): 151-155.
[18] Khan A, Iqbal I, Shah A,etal. Alleviation of adverse effects of salt stress in brassica (Brassicacampestris) by pre-sowing seed treatment with ascorbic acid. American-Eurasian Journal of Agricultural and Environmental Science, 2010, 7(5): 557-560.
[19] ISTA. International rules for seed testing. Bassersdorf: Zurich, 2015.
[20] Abdul-Baki A A, Anderson J D. Vigour determination in soybean seed multiple criteria. Crop Science, 1973, 13(6): 630-633.
[21] Ellis R H, Roberts E H. The influence of genotype, temperature and moisture on seed longevity in chickpea, cowpea and soybean. Annals of Botany, 1982, 50(1): 69-82.
[22] Lu P N, Liu J H, Li Q,etal. Comparison of quality and yield of different oat varieties in saline-alkali land. Journal of Triticeae Crops, 2016, 36(11): 1510-1516.
卢培娜, 刘景辉, 李倩, 等. 盐碱地不同燕麦品种的品质及产量比较. 麦类作物学报, 2016, 36(11): 1510-1516.
[23] Gao Z W, Lin J X, Shao S,etal. Effect of complex salt-alkali stresses on seed germination of oat. Pratacultural Science, 2014, 31(3): 451-456.
高战武, 蔺吉祥, 邵帅, 等. 复合盐碱胁迫对燕麦种子发芽的影响. 草业科学, 2014, 31(3): 451-456.
[24] Zhang Q L, Liu Q, Gao H,etal. Effect of endogenous ascorbic acid on seed germination and seedling growth of rice. Journal of Tropical and Subtropical Botany, 2016, 24(3): 273-279.
张启雷, 刘强, 高辉, 等. 内源抗坏血酸对水稻种子萌发及幼苗生长的影响. 热带亚热带植物学报, 2016, 24(3): 273-279.
[25] Shin R, Schachtman D P. Hydrogen peroxide mediates plant root cell response to nutrient deprivation. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(23): 8827-8832.
[26] Zhu Z J. Changes of activities of ascorbate-dependent H2O2-scavenging enzymes during imbibition and germination of oil rape seeds. Journal of Zhejiang Agricultural University, 1997, 23(5): 505-509.
朱祝军. 油菜种子发芽过程中依赖于抗坏血酸的H2O2清除酶活性的变化. 浙江农业大学学报, 1997, 23(5): 505-509.
[27] Chang Y X, Xu K D, Liu B,etal. Alleviative effect of exogenous ascorbic acid on cadmium toxicity in wheat seedlings. Journal of Triticeae Crops, 2017, 37(2): 246-252.
常云霞, 徐克东, 刘彬, 等. 外源抗坏血酸对镉毒害小麦幼苗的缓解作用. 麦类作物学报, 2017, 37(2): 246-252.
[28] Gallie D R. The role of L-ascorbic acid recycling in responding to environmental stress and in promoting plant growth. Journal of Experiment Botany, 2013, 64(2): 433-443.
[29] Liu Y J, Fan J, Han X K,etal. Effect of exogenous vitamins on seed germination and recovery ofMedicagosativaL. under high NaCl stress. Chinese Agricultaural Science Bulletin, 2015, 31(26): 12-27.
刘艳军, 范晶, 韩学珅, 等. 外源维生素对高NaCl胁迫下紫花苜蓿种子萌发及恢复性的影响. 中国农学通报, 2015, 31(26): 12-27.
[30] Jiang X W, Li H Q, Wang J H. Physiological response ofScutellariabaicalensisseed germination and seedling to exogenous ascorbic acid under salt stress. Plant Physiology Journal, 2015, 51(2): 166-170.
江绪文, 李贺勤, 王建华. 盐胁迫下黄芩种子萌发及幼苗对外源抗坏血酸的生理响应. 植物生理学报, 2015, 51(2): 166-170.
[31] Fan M H, Zhang Y X, Shi Y,etal. Effects of exogenous ascorbic acid on seed germination and growth ofBrassicanapusunder seawater stress. Chinese Journal of Oil Crop Science, 2009, 31(1): 34-38.
范美华, 张义鑫, 石戈, 等. 外源抗坏血酸对油菜种子在海水胁迫下萌发生长的影响. 中国油料作物学报, 2009, 31(1): 34-38.
[32] Shi Y C, Yang Y Y, Xue R L,etal. Research advance of biological function of ascorbic acid in plants. Plant Physiology Journal, 2015, 51(1): 1-8.
石永春, 杨永银, 薛瑞丽, 等. 植物中抗坏血酸的生物学功能研究进展. 植物生理学报, 2015, 51(1): 1-8.
[33] Wang C, Zhu Y L, Yang L F,etal. Effects of NaCl stress on ascorbate-glutathione cycle in vegetable soybean seeds. Plant Nutrition and Fertilizer Science, 2010, 16(5): 1209-1216.
王聪, 朱月林, 杨立飞, 等. NaCl胁迫对菜用大豆种子抗坏血酸-谷胱甘肽循环的影响. 植物营养与肥料学报, 2010, 16(5): 1209-1216.
[34] Liu Z P, Li B B, Xue H N,etal. Effect of NaCl stress on antioxidant system and ascorbate-glutathione cycle in barley seeds. Journal of Triticeae Crops, 2016, 36(6): 736-741.
刘志萍, 李琲琲, 薛海楠, 等. NaCl胁迫对大麦籽粒抗坏血酸-谷胱甘肽循环的影响. 麦类作物学报, 2016, 36(6): 736-741.

