响应面法优化无核白葡萄多酚氧化酶的提取工艺
, , ,,,,*
(1.石河子大学食品学院,新疆石河子 832000; 2.新疆农业科学院农业质量标准与检测技术研究所,新疆乌鲁木齐 830091; 3.农业部农产品质量安全风险评估实验室(乌鲁木齐),新疆乌鲁木齐 830091; 4.新疆农产品质量安全实验室,新疆乌鲁木齐 830091; 5.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
无核白葡萄又名“无籽露”,中晚熟品种,在世界分布极广。无核白葡萄不仅含有许多糖分,还含有易于人体吸收的铁、钙、磷、钾、镁等矿物质和多种维生素[1]。无核白葡萄多以制干为主,鲜食为辅,而干制过程中的褐变问题不仅有损产品特色,也严重影响了其商品价值和经济效益,褐变一直是困扰葡萄干制业发展的关键因素[2]。有研究表明,多酚氧化酶催化的酶促褐变是导致无核白葡萄干制褐变的主要原因[3-4]。
多酚氧化酶(polyphenol oxidase,PPO)是以氧为受氢体的一种氧化酶,它能催化酚类化合物氧化成相应的醌类化合物[5]。无核白葡萄富含酚类物质,在PPO酶的催化下生成邻醌,邻醌具有很高的活性,极易与蛋白质氨基酸等发生聚合,最后生成黑色素,造成色泽的劣变及营养损失[6]。
提取多酚氧化酶的常见方法有丙酮提取法、缓冲溶液浸提法、超声波辅助浸提法。粟银等[7]在研究新疆马乳葡萄多酚氧化酶性质采用丙酮法提取新疆马乳葡萄中的PPO。Zhou等[8]在研究通过水杨酸竞争性抑制多酚氧化酶抑制中国鲜切板栗的酶促褐变中采用缓冲溶液浸提法提取板栗中PPO。明婷等[9]在不同温度对新鲜莲子根褐变率和苯酚的影响中采用缓冲溶液浸提法提取莲子根中的PPO。李全文[10]在桑叶多酚氧化酶的提取、纯化、及其固定化研究中采用超声波辅助浸提法提取桑叶中PPO。另外,无核白葡萄多酚氧化酶提取方法也很多,林向东等[11]在无核白葡萄多酚氧化酶特性研究中采用了丙酮提取法提取PPO。吴继红等[12]在新疆无核白葡萄多酚氧化酶特性研究中采用了缓冲溶液法提取PPO。但关于无核白葡萄多酚氧化酶提取条件优化的报道却极少见。
因此本实验采用常见的3种方法提取无核白葡萄中多酚氧化酶,筛选出适合无核白葡萄多酚氧化酶提取方法,在此基础上对提取方法的提取条件进行优化,以期为无核白葡萄多酚氧化酶纯化、性质、结构研究提供基础。
1 材料与方法
1.1 材料与仪器
无核白葡萄果实可溶性固形物含量为18%~20%,含水量为79.44%±0.13%,果实直径为(12.1±0.2) mm,长度为19.3 mm,新疆乌鲁木齐市北园春市场;丙酮、磷酸氢二钠、磷酸二氢钠、考马斯亮蓝G-250、牛血清蛋白、邻苯二酚均为分析纯。
FA2104N电子天平上海民桥精密科学仪器有限公司;TU-1810紫外-可见分光光度计北京普析通用仪器有限责任公司;SK2200H超声波清洗器上海科导超声仪器有限公司;TGL-16G高速冷冻离心机上海安亭科学仪器厂;雷磁PHSJ-3F pH计上海权浩仪表有限公司。
1.2 实验方法
1.2.1无核白葡萄PPO提取方法确定通过比较丙酮提取法、缓冲溶液浸提法和超声波辅助浸提法这三种方法提取PPO的酶活、酶蛋白含量的多少来确定无核白葡萄PPO的提取方法。
1.2.1.1丙酮提取法准确称取10.0 g鲜无核白葡萄,加入10 mL 4 ℃冷丙酮,用均质机将鲜无核白葡萄研磨成匀浆,抽滤,滤饼再次用冷丙酮抽滤,在室温下干燥即得无核白葡萄多酚氧化酶丙酮粉。将丙酮粉溶于0.2 mol/L,pH6.8,4 ℃预冷磷酸缓冲液中在4 ℃冰箱中浸提1.5 h,在4 ℃下,以9000 r/min离心15 min,去除沉淀,取其上清液[11]。重复1次,即为无核白葡萄PPO粗提液。
1.2.1.2缓冲溶液浸提法准确称取10.0 g鲜无核白葡萄,加入10 mL 0.2 mol/L,pH6.8,4 ℃预冷磷酸缓冲液,用均质机将鲜无核白葡萄研磨成匀浆,在4 ℃冰箱中浸提1.5 h,在4 ℃下,以9000 r/min离心15 min,去除沉淀,取其上清液[12]。重复1次,即为无核白葡萄PPO粗提液。
1.2.1.3超声波辅助浸提法准确称取10.0 g鲜无核白葡萄,加入10 mL 0.2 mol/L,pH6.8,4 ℃预冷磷酸缓冲液,用均质机将鲜无核白葡萄研磨成匀浆,在100 W功率4 ℃条件下超声30 min,超声仪内放置冰块使温度保持在4 ℃左右,再在4 ℃冰箱中浸提1 h。在4 ℃下,以9000 r/min离心15 min,去除沉淀,取其上清液[10]。重复1次,即为无核白葡萄PPO粗提液。
1.2.1.4蛋白质含量测定采用考马斯亮蓝法测定蛋白质含量[13],用牛血白蛋白做蛋白质标准曲线,标准曲线方程为y=0.003x+0.418,R2=0.994(式中y为吸光度,x为蛋白质质量浓度,μg/mL)。根据标准曲线方程计算蛋白质含量。
1.2.1.5酶活力与比活力测定在试管中加入3 mL 0.2 mol/L pH6.8磷酸缓冲液,1 mL 0.2 mol/L邻苯二酚溶液,1 mL PPO粗提液,混合均匀,在420 nm吸光度下测定其4 min内的吸光度值,每隔30 s测一次吸光度值[14]。
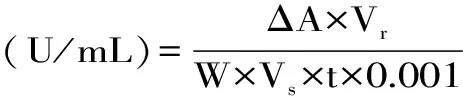
式(1)
式中:Vr为加样缓冲液总体积(mL),Vs为比色体积(mL),W为取样质量(g)。
酶比活力即为每毫克蛋白质所具有的酶活力数。

式(2)
1.2.2缓冲溶液浸提法提取无核白葡萄PPO单因素实验
1.2.2.1料液比对无核白葡萄PPO比活力的影响以浸提时间为2 h,缓冲溶液pH6.0,考察料液比为3∶1、2∶1、1∶1、1∶2、1∶3、1∶4 (g/mL)时对无核白葡萄PPO比活力的影响。
1.2.2.2提取时间对无核白葡萄PPO比活力的影响以料液比为1∶2 (g/mL),缓冲溶液pH6.0,考察提取时间0、1、2、3、4、5 h时对无核白葡萄PPO比活力的影响。
1.2.2.3缓冲溶液pH对对无核白葡萄PPO比活力的影响以料液比为1∶2 g/mL,浸提时间为3 h时,考察缓冲溶液pH在4.0、5.0、6.0、7.0、8.0、9.0时对无核白葡萄PPO比活力的影响。
1.2.3响应面法优化无核白葡萄PPO提取条件的实验在单因素实验基础上,采用Box-Behnken中心实验优化设计,分析料液比、提取时间、缓冲液pH对无核白葡萄PPO比活力的影响。响应面设计实验因素及水平见表1。
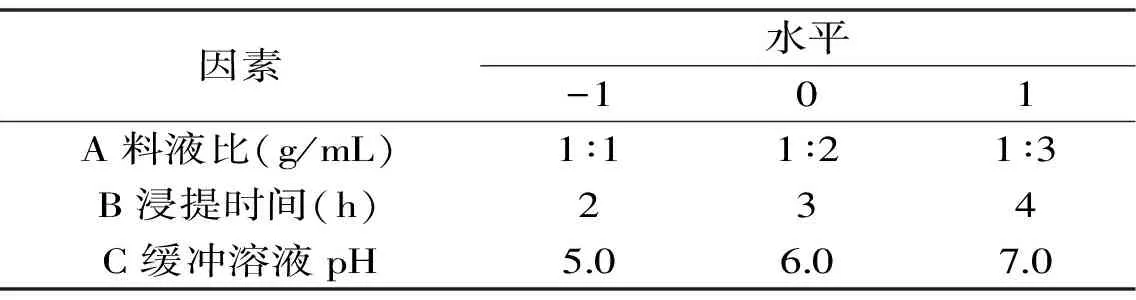
表1 响应面实验水平设计Table 1 Factors and levels in the response surface analysis
1.3 数据处理
所有数据均为3次重复实验的平均值,表示为平均值±标准差,实验数据采用Origin8.5软件作图,响应面设计利用Design Expert 8.0.6软件。
2 结果与分析
2.1 无核白葡萄PPO提取方法确定
由表2可知,超声波辅助浸提法提取出的酶蛋白含量最高,丙酮提取法提取的蛋白含量最低。其原因可能是一方面超声波加速无核白葡萄组织破碎,细胞内物质流出,使得蛋白质含量增加,另一方面是超声的过程中超声空化作用所产生的冲击波改变酶分子的构象或者是超声波产生的热使一部分酶的活力下降[15]。丙酮提取法提取酶活最低,缓冲溶液浸提法提取酶活最高。可能是有机试剂在提取过程中会使酶失活,导致酶活降低[9]。总的来说,缓冲溶液浸提法适合无核白葡萄PPO,所得酶活高,酶蛋白含量高为后续的PPO纯化做好铺垫。

表2 不同提取方法酶活与酶蛋白含量的比较Table 2 Comparison of enzyme activities and enzyme proteins in different extraction methods
注:同列小写字母不同表示差异显著(p<0.05)。
2.2 单因素实验结果
2.2.1料液比对无核白葡萄PPO比活力的影响由图1可知,当料液比小于1∶2 mg/mL时,随着料液比的增加其酶比活力逐渐增加;当料液比大于1∶2 mg/mL时,随着料液比的增加其酶比活力随之降低。原因可能是尽管鲜葡萄中水分很高,但料液比过低就无法使无核白葡萄中的PPO溶解于缓冲液中,提取不完全导致PPO酶比活力低,料液比增加,比活力也随之增加[16]。但当料液比达到一定比例时,PPO酶溶解量不再随之变化,而提取液量增加,导致PPO酶比活力降低。

图1 料液比对无核白葡萄PPO比活力的影响Fig.1 Effect of liquid ratio on specific activity of PPO enzyme in seedless white grape
2.2.2浸提时间对无核白葡萄PPO比活力的影响由图2可知,随着浸提时间的增长,无核白葡萄PPO比活力也随之增加。当浸提时间大于3 h时,随着浸提时间的增长,无核白葡萄PPO比活力随之降低。刚开始随着浸提时间的增长,无核白葡萄中更多的PPO溶解于提取液中,使得PPO比活力增加。当浸提时间大于3 h时,随着浸提时间的延长,由于酶蛋白在溶液中构象不稳定,以及无核白葡萄中酚类物质等流出,均易造成酶活降低[17]。
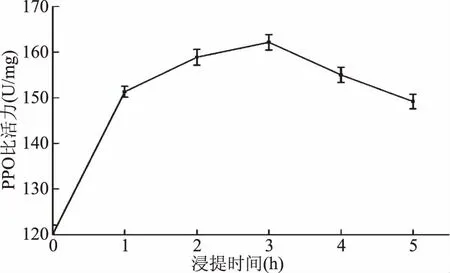
图2 浸提时间对无核白葡萄PPO比活力的影响Fig.2 Effects of leaching time on specific activity of PPO enzyme in seedless white grape
2.2.3缓冲液pH对无核白葡萄PPO比活力的影响由图3可知,当缓冲液pH小于6时,无核白葡萄PPO比活力随着缓冲液pH的增加而增加,这可能是因为酸性条件会引起酶蛋白的聚集、变性等,造成酶活力降低[18]。当缓冲液pH大于6时,无核白葡萄PPO酶比活力随着缓冲液pH的增加而降低。可能一方面是由于PPO酶的辅基是Cu2+,在酸性条件下,酶中的铜离子被解离出来,使酶失去活性。在碱性条件下,Cu2+转化为Cu(OH)2沉淀,脱离了酶蛋白,也能使酶失去活性;也有可能是由于反应体系的pH对底物的解离使之不能被催化反应[19]。

图3 缓冲液pH对无核白葡萄PPO比活力的影响Fig.3 Effects of buffer pH on specific activity of PPO enzyme in seedless white grape
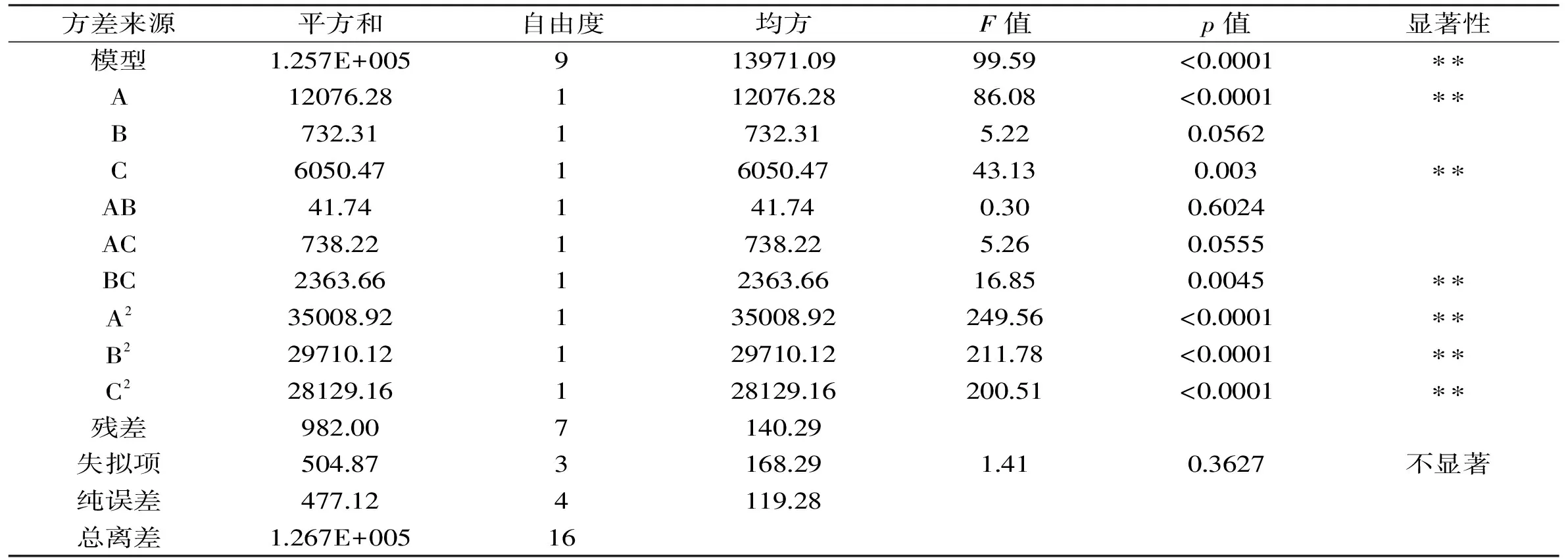
表4 响应面法实验结果方差分析Table 4 Variance analysis of response surface method test results
注:*差异显著,p<0.05,**差异极显著,p<0.01。
2.3 响应面实验
2.3.1回归模型的建立响应面实验设计方案如表3所示,每组实验进行3次平行实验取其平均值为实验结果。采用Design-Expert 8.06软件进行回归拟合分析,得到无核白葡萄PPO比活力对料液比、浸提时间和缓冲液pH的三元二次回归方程。Y=376.53-38.85A-9.57B-27.50C-3.23AB-13.59AC+24.31BC-91.18A2-84.00B2-81.74C2。
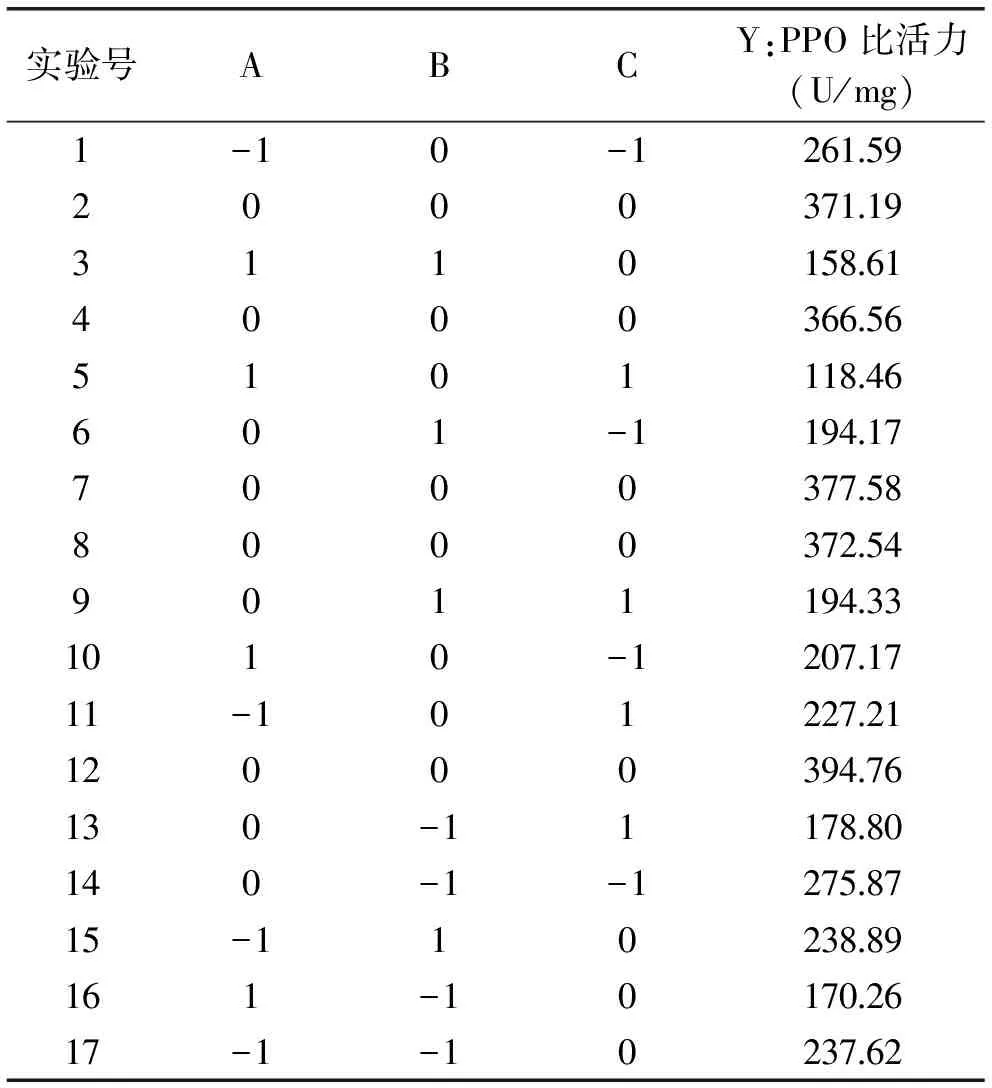
表3 Box-Behnken实验设计方案与结果Table 3 Box-Behnken experimental design and results
由表4响应面实验结果方差分析可以看出,该模型p<0.0001极显著,失拟项p=0.3627>0.05不显著。这表明建立的回归模型成立,可用于无核白葡萄PPO的提取结果的分析与预测。表3的分析结果还表明料液比和缓冲液pH都是影响无核白葡萄PPO提取效果的显著因素。
2.3.2无核白葡萄PPO提取条件的响应面分析模型中各因素交互作用对无核白葡萄PPO提取的影响,经软件分析得到交互因素的响应面和等高线图。
等高线的形状可反映交互作用的强弱大小,椭圆形表示两因素交互作用显著[20]。由图4可知,当料液比一定时,无核白葡萄PPO比活力随着缓冲液pH和浸提时间的增加呈现先增加后下降的趋势。当浸提时间一定时,无核白葡萄PPO比活力随着缓冲液pH和料液比的增加呈现先增加后下降的趋势。当缓冲液pH一定时,无核白葡萄PPO比活力随着浸提时间和料液比的增加呈现先增加后下降的趋势。浸提时间和缓冲液pH交互作用显著,料液比和缓冲液pH交互作用不显著,料液比和浸提时间交互作用不显著。
根据回归方程分析计算,无核白葡萄PPO最佳提取工艺条件为料液比1∶1.8 (g/mL),浸提时间2.92 h,缓冲液pH5.84,在此条件下无核白葡萄PPO酶比活力为(383.02±1.6) U/mg。
2.3.3验证实验为了检验该模型的可行性,在优化提取条件下进行无核白葡萄PPO的提取,根据实际操作,采用料液比为1∶1.8 (g/mL),浸提时间2.9 h,缓冲液pH5.8为最佳提取条件,进行3次实验,所得无核白葡萄PPO比活力平均值为(378.12±1.3) U/mg,与模型预测值较接近。说明该模型优化无核白葡萄PPO提取条件具有可行性。

图4 浸提时间、缓冲液pH和料液比交互作用的响应面和等高线图Fig.4 The response surface and contour map of the interaction between the extraction time,the buffer pH and material ratio
3 结论
在单因素实验的基础之上,通过响应面实验设计确定了无核白葡萄PPO提取的最佳工艺为料液比1∶1.8 (g/mL),浸提时间2.9 h,缓冲液pH5.8。在此条件下,无核白葡萄PPO比活力为(378.12±1.3) U/mg,与模型预测值非常接近。采用响应面法分析,能较为准确的预测实验结果,以期为无核白葡萄多酚氧化酶纯化、性质、结构研究提供基础。
[1]唐莎莎. 无核白葡萄果实品质评价研究[D]. 乌鲁木齐:新疆农业大学,2013.
[2]张利娟. 葡萄干的抗氧化特性及防褐变工艺研究[D]. 杨凌:西北农林科技大学,2013.
[3]林向东,李冀新. 无核白葡萄荫干过程中褐变原因探析[J].食品科学,1999,20(6):72-74.
[4]Zhang Yongju,Shi Junling. Biochemical characteristics and thermal inhibition kinetics of polyphenol oxidase extracted from Thompson seedless grape[J]. European Food Research and Technology,2012,234:607-616.
[5]Queiroz C,Da Silva A J R,Lopes M L M,et al. Polyphenol oxidase activity,phenolic acid composition and browning in cashew apple after processing[J]. Food Chemistry,2011,125(1):128-132.
[6]Ramsden C A,Riley P A. Tyrosinase:the four oxidation states of the active site and their revelance to enzymatic activation,oxidation and inactivation[J]. Bioorganic and Medicinal Chemistry,2014,22(8):2389-2395.
[7]粟银,胡南. 新疆马乳葡萄中多酚氧化酶性质的研究[J].湘潭师范学院学报:自然科学版,2007,29(4):120-123.
[8]Zhou Dan,Li Lin,Wu Yanwen,et al. Salicylic acid inhibits enzymatic browning of fresh-cut Chinese chestnut(Castaneamollissima)by competitively inhibiting polyphenol oxidase[J]. Food Chemistry,2014,171:19-25.
[9]Ming Ting,Xie Jun,ZhengMenglin,et,al.The effect of different temperatures on browning incidence and phenol compound metabolism in fresh-cut lotus root[J].Postharvest Biology and Technology,2016,123(2017):69-76.
[10]李全文.桑叶多酚氧化酶的提取、纯化及其固定化研究[D]. 南宁:广西大学,2012.
[11]林向东,张琪,李冀新,等. 无核白葡萄多酚氧化酶特性研究[J].食品科学,2000,21(12):43-45.
[12]吴继红,蔡同一. 新疆无核白葡萄多酚氧化酶特性的研究[J].食品工业科技,2003,24(12):35-37.
[13]王文平,郭祀远,李琳,等. 考马斯亮蓝法测定野木瓜多糖中蛋白质含量[J]. 食品研究与开发,2008,29(1):115-117.
[14]周燕燕. 金银花多酚氧化酶提取纯化、酶学性质及抑制效应研究[D]. 洛阳:河南科技大学,2014.
[15]侯杰. 木薯叶多酚氧化酶的分离纯化及其应用[D].南宁:广西大学,2014.
[16]Bibhuti B Mishra,Satyendra Gautam,Arun Sharma. Purification and characterization of polyphenol oxidase from eggplant[J]. Food Chemistry,2012,134:1855-1861.
[17]Sun Xiaohong,Zhu Kexue,Zhou Huiming. Optimization of a novel backward extraction of defatted wheat gem protein from reverse micelles[J].Innovative Food Science and Emerging Technologies,2009,10:328-333.
[18]王磊.马铃薯酶促褐变机理研究[D]. 南昌:南昌大学,2012.
[19]张百刚.红枣多酚氧化酶(PPO)特性及抑制其酶促褐变的研究[D]. 西安:陕西师范大学,2006.
[20]刘玉芬,夏海涛. 响应面法优化碱蒿黄酮提取工艺及其体外抗氧化作用[J].食品科学,2012,33(12):63-68.

