葡聚糖-大豆分离蛋白耦联接枝工艺优化及接枝产物理化特性研究
,,,
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北武汉 430070)
大豆分离蛋白(soy protein isolate,SPI)是以大豆粕为原料分离提取的一种含高蛋白、低胆固醇的植物蛋白质[1]。SPI营养资源丰富,具有乳化性、凝胶性、起泡性等良好的功能性质,作为功能性食品添加剂被广泛应用[2]。但单一的SPI无法兼具良好的溶解性、乳化稳定性、热稳定性,且具有抗原性、过敏源性等缺陷,因此致力于SPI改性,对其功能性和新用途进行开发是国内外学者研究的热点[3-4]。
多糖耦联接枝蛋白改性是基于美拉德(Maillard)反应的一种绿色的蛋白改性方法。改性后,蛋白的功能特性显著提高,抗原性降低,抗氧化性、抑菌性等增高[5]。作为中性多糖的葡聚糖(DEX)具有良好的水溶性、安全稳定性及良好的生理功能[6]。布冠好等[7]研究了葡聚糖-SPI对大豆蛋白抗原性的影响,得到糖基化产物中β-伴大豆球蛋白和大豆球蛋白的抗原性分别降低了36.90%和18.12%。葡聚糖与蛋白耦联后,可在水中组装为两亲性接枝共聚物,潘晓云等[8]人制备得到酪蛋白-葡聚糖共价结合物的天然高分子胶束,该胶束可包埋芘、β-胡萝卜素等疏水化合物。因此,糖接枝蛋白的研究为开发新型食品添加剂提供了一条新的途径。
目前传统的糖接枝工艺存在接枝效率低、反应时间长、褐变程度大等问题,且干热法由于对温度、湿度要求严格等不适于大规模生产[9],故寻找条件温和、高接枝度、低褐变程度的工艺是急需解决的热点问题。已有学者研究过湿法糖基化改性,但葡聚糖接枝蛋白工艺研究甚少。因此本研究以SPI为研究对象,以葡聚糖对其进行糖接枝改性,分析了相关因素对SPI-葡聚糖接枝度(degree of grafting,DG)和褐变度(A420 nm)的影响,利用Box-Behnken实验设计和响应面分析,确定最佳工艺条件,从而为糖接枝蛋白的实际生产提供技术依据。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白蛋白含量≥95%;葡聚糖分子量50 kDa,上海源叶生物科技有限公司;邻苯二甲醛(OPA)、β-巯基乙醇分析纯,美国Sigma公司;十二烷基硫酸钠(SDS)、氢氧化钠、盐酸、硼砂、甲醇、四硼酸钠、磷酸氢二钠、磷酸二氢钠、考马斯亮蓝等均为分析纯。
DK-98-IIA恒温数显水浴锅天津市泰斯特仪器有限公司;PB-10 pH计德国Sartorius;DF-101S集热式恒温加热磁力搅拌器郑州长城科工贸有限公司;CR21GIII低温高速离心机日本日立公司;UV-1800 UV-Vis分光光度计日本岛津;AvantiJ-E超速冷冻离心机美国Beckman;S-433 氨基酸分析仪德国Sykam;Direct8超纯水系统美国Millipore;PowerPacTM通用电泳仪美国伯乐公司。
1.2 实验方法
1.2.1SPI-葡聚糖接枝物的制备将葡聚糖与SPI按照不同物质的量之比,以去离子水配制成蛋白质量浓度为1.4%的混合液;以0.1 mol/L HCl/NaOH调节,使混合液pH为7.0,用磁力搅拌器低速搅拌2 h;将混合液放入恒温水浴摇床中初步温浴,调节温度为50 ℃、温浴30 min;置于恒温水浴锅中,在一定反应温度下接枝反应一定时间后,冰浴5 min,结束反应即得到葡聚糖-大豆蛋白接枝物。分别以SPI、恒温加热SPI、SPI与葡聚糖物理混合物为对照,进行相关指标的对比检测。
1.2.2工艺优化设计
1.2.2.1单因素实验在蛋白质量浓度为1.4%、初步温浴温度为50 ℃、时间为30 min条件下(这些条件在预实验中已经确定),改变参数,研究反应温度、反应时间、蛋白与糖物料比对糖接枝蛋白接枝度与褐变程度的影响。
在反应温度为85 ℃、反应时间7.0 h的条件下,物料比(蛋白∶糖)分别为1∶1、1∶2、1∶3、1∶4、1∶5,研究物料比对共价接枝物制备的影响。
在物料比(蛋白∶糖)为1∶2,反应时间7.0 h的条件下,反应温度分别为75、80、85、90、95 ℃,研究反应温度对共价接枝物制备的影响。
在物料比(蛋白∶糖的比例)为1∶2、反应温度为85 ℃的条件下,反应时间分别为4.0、5.0、6.0、7.0、8.0、9.0 h,研究反应时间对共价接枝物制备的影响。
1.2.2.2响应面实验依据单因素实验结果,进行响应面法Box-Behnken Design实验设计。以反应温度、反应时间、蛋白与糖物料比为独立变量(A、B、C),以接枝度为响应值,实验因素水平设计见表1。

表1 响应面因素水平编码表Table 1 Variables and levels in response surface
1.2.3接枝度(DG)的测定样品中游离氨基的含量通过OPA方法检测[10-12]。配制OPA试剂:将40 mg OPA溶解于1 mL甲醇溶液中,加入25 mL 0.1 mol/L的四硼酸钠、2.5 mL十二烷基磺酸钠(20% SDS)、100 μLβ-巯基乙醇、去离子水,以量筒将最终体积定容为50 mL。将200 μL的样品溶液(蛋白含量为2 mg/mL)加入到4 mL OPA试剂中涡旋振荡,35 ℃下反应2 min,在340 nm下检测吸光值,来计算游离氨基含量。样品接枝度的计算如式(1)。
式(1)
其中:At代表大豆分离蛋白与多糖共价交联产物所测得的吸光值;A0代表大豆分离蛋白与多糖物理混合物所测定的吸光值。
1.2.4褐变程度(A420 nm)测定取3.0 mL 样品液加入1.0 mL 稀释液(含10%(w/w)SDS及0.05 mol/L 硼砂),以稀释液作空白,在420 nm下测定吸光值A420 nm[13-15]。
1.2.5聚丙烯酰胺凝胶电泳(SDS-PAGE)以优化工艺制备的接枝物参照LaemmLi[16]法进行SDS-PAGE分析。样品蛋白浓度为2 mg/mL,上样量10 μL。分离胶和浓缩胶质量分数分别为12%和3%,分别设定电压为120 V和80 V进行电泳,以考马斯亮蓝R-250染色。
1.2.6氨基酸分析以优化工艺制备的接枝物进行氨基酸分析,参照LaemmLi[16]的方法并作适当改进。将样品分别置于消解管中,以6 mol/L HCl溶液水解,抽真空,110 ℃下水解24 h;冷却、定容、过滤、蒸干后加入0.02 mol/L的HCl 溶液,上样氨基酸自动分析仪中真空放置30 min,对氨基酸含量进行测定。
1.2.7溶解度的测定以优化工艺制备的接枝物进行蛋白质溶解能力的测量,参考胡昊等[17]的方法并做适当修改。混合物在摇床中室温振荡1 h后,在4 ℃、20000×g下离心20 min。上清液中的蛋白含量通过Lowry法测定[18],样品溶解度的计算参见式(2)。

式(2)
1.2.8乳化性的测定以优化工艺制备的接枝物进行乳化性的测定,参照Pearce[19]的方法并作适当改进。以0.2 mol/L、pH7.0的磷酸缓冲液配制蛋白浓度为0.5%(w/v)的样品溶液。取3 mL样品液与1 mL玉米油,用均质机均质1 min,分别于0、10 min从底部取样50 μL,以0.3%(w/v)SDS溶液稀释200倍后,在500 nm处测吸光值。样品乳化活性(EAI)的计算参见式(3)、乳化稳定性(ESI)的计算参见式(4)。
式(3)
式(4)
其中:A0和A10分别为0 min和10 min时样品稀释液所测得的吸光值;DF为稀释倍数;c为蛋白浓度(g/mL);Φ为乳状液中油所占比例(v/v)。
1.2.9数据处理采用Design-Expert V8.0.6对实验数据进行回归分析及响应曲面绘制,多项式模型方程拟合由决定系数R2表达,利用F检验分析显著性。
2 结果与分析
2.1 单因素实验
2.1.1物料比对接枝度、褐变程度的影响物料比对接枝度、褐变程度的影响如图1。随SPI与葡聚糖的比例由1∶1增加到1∶5,接枝度呈现先增加后减小的趋势,在1∶2处得到最大接枝度43.31%,这是因为在一定配比范围内,随葡聚糖增加,产生“大分子拥挤效应”,利于糖接枝反应的进行,但葡聚糖浓度继续增大,体系粘度上升,分子流动性和扩散性变差,蛋白与多糖空间阻碍变大,反应程度降低,接枝度变小[20]。褐变程度变化趋势与接枝度相同,在1∶2处取得最大褐变值0.043,但体系总体褐变程度极低,可忽略不计,因此选择反应物料比为1∶2比较好。

图1 物料比对糖接枝蛋白接枝度、褐变程度的影响Fig.1 Effect of material ratio on degree of grafting and browning degree of SPI-DEX conjugates
2.1.2反应温度对接枝度与褐变程度的影响随温度由75 ℃升至95 ℃,接枝度由27.94%升高至48.81%,后降低至36.76%,呈现先上升后下降的趋势,并在85 ℃取得峰值(图2)。提高反应温度使蛋白结构疏松,增加蛋白分子中的自由氨基与还原糖羰基的热运动,利于接枝反应的进行。但过高的温度会导致蛋白的热变性和凝聚现象,自由氨基减少,导致接枝度下降。褐变程度随温度升高,呈现不断增大的趋势,95 ℃条件下的褐变程度最高,为0.058。高温促使体系向美拉德反应的高级阶段进行,形成棕色色素,使褐变程度增加,但从褐变值来看,体系总体褐变程度仍然较低。因此,选择85 ℃为反应温度较好。

图2 反应温度对糖接枝蛋白接枝度、褐变程度的影响Fig.2 Effect of reaction temperature on degree of grafting and browning degree of SPI-DEX conjugates
2.1.3反应时间对接枝度、褐变程度的影响图3中显示的是反应时间对接枝度、褐变程度的影响。随反应时间由4 h 增加到7 h,接枝度由20.56%增至47.68%,在反应7 h取得最大接枝度,因为蛋白分子逐渐展开、解聚,分子内部氨基与多糖反应,接枝度增加;但继续延长反应时间至9 h,接枝度明显降低至21.40%,因为随反应时间延长,蛋白水解,自由氨基含量增多,导致计算出的接枝度减小。褐变指数随时间的延长不断增大至0.056,但从褐变指数来看,体系褐变程度仍然很低。因此,选择7 h为反应时间比较合适。

图3 反应时间对糖接枝蛋白接枝度、褐变程度的影响Fig.3 Effect of reaction time on degree of grafting and browning degree of SPI-DEX conjugates
2.2 响应面实验分析
2.2.1方差分析及回归方程由于所得糖接枝蛋白总体褐变程度很低(Amax≤0.06),为得到高接枝度的最佳优化工艺,故只以接枝度(DG)为响应值,结果见表2。

表3 回归方程方差分析Table 3 Variance analyses of regression equation
注:“**”表示差异极显著(p<0.01);“*”表示差异显著(p<0.05);“-”表示差异不显著。
根据表2结果,通过Design-Expert软件分析获得回归方程为:糖接枝蛋白接枝度DG(%)=51.77-5.71A-8.26B+4.58C+2.31AB-2.61AC-7.27BC-6.99A2-16.19B2-5.51C2。回归方程决定系数为0.959。从方差分析(表3)可看出,模型失拟项p=0.5218>0.05,不显著,说明响应面分析对实验拟合性好,实验误差小,可分析和预测糖接枝蛋白制备效果。其中,变量A、B、二次项B2均达到极显著水平,变量C、二次项A2、C2均达到显著水平,AB、AC交互项不显著,BC达到极显著水平。
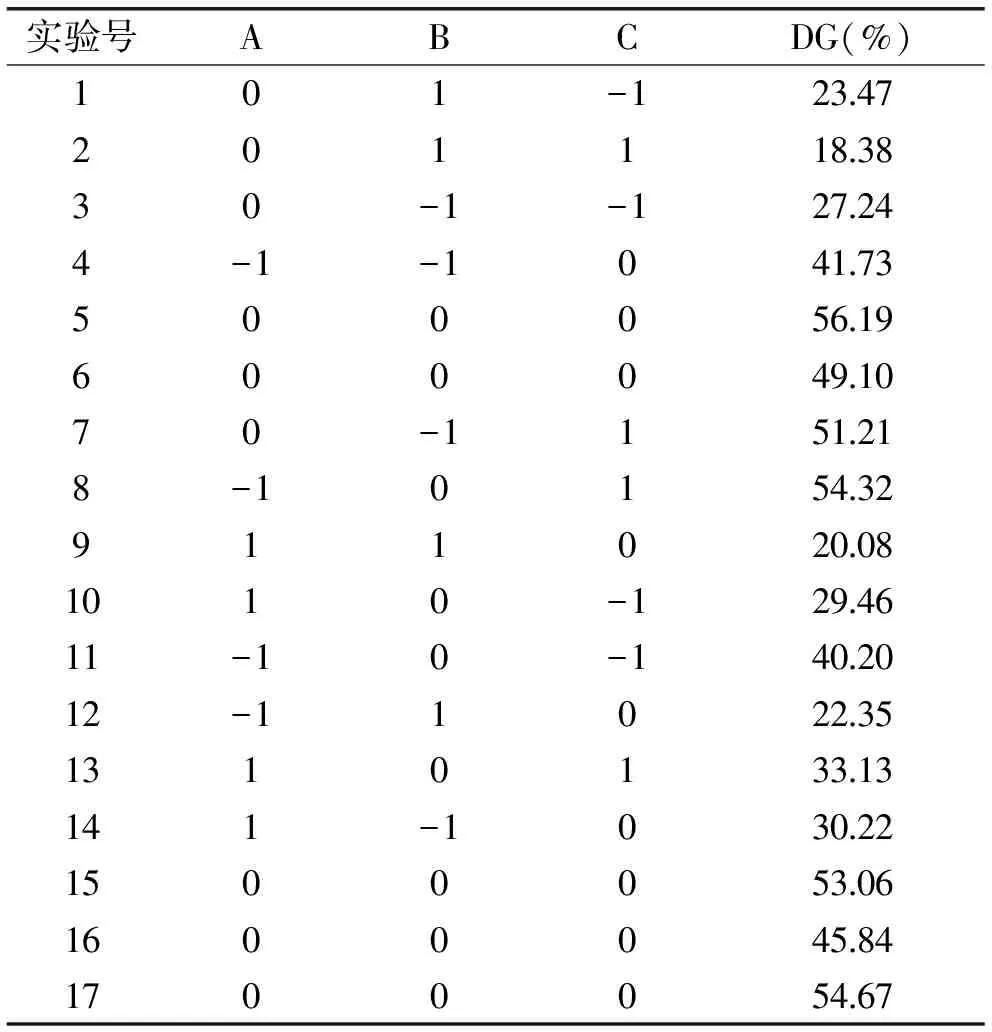
表2 响应面实验设计及结果Table 2 Box-Behnken design and experimental results
2.2.2响应曲面分析与优化响应曲面及等高线见图4~图6。蛋白质、多糖都是生物大分子,反应速度与底物浓度、温度关系比较密切,物料比的主效应比较显著,而与反应温度、反应时间的交互作用不显著,物料比过大或过小均对接枝度有负面影响。反应温度与反应时间的交互作用达到极显著水平,随着反应时间和反应温度的增加,糖接枝蛋白的接枝度迅速提高,然后趋于稳定,再逐渐减小。三个变量中,反应温度对响应值的影响最大,物料比次之,反应时间最小。对回归模型进行分析,得到最大响应值所对应的因素水平分别为:A=1∶1.15,B=82.89 ℃,C=7.33 h,但从仪器的真实状况与操作的实用性考虑,最优条件确定为:物料比1∶1.2、反应温度为83 ℃、反应时间为7.3 h,并预测接枝度最高达56.90%。

图4 Y=f(A,B)响应曲面及等高线 Fig.4 Response surface and contour for Y=f(A,B)
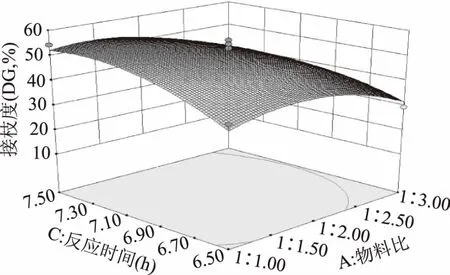
图5 Y=f(A,C)响应曲面及等高线 Fig.5 Response surface and contour for Y=f(A,C)

图6 Y=f(B,C)响应曲面及等高线 Fig.6 Response surface and contour for Y=f(B,C)
为验证回归模型,在最优工艺下进行3次重复实验,接枝度分别为55.96%、56.73%、56.45%,平均56.38%±0.23%。回归方程的最大预测值与实验数值接近,说明回归方程较真实地反映了各因素对响应值的影响。利用响应面分析法优化糖接枝蛋白制备的技术参数,效果较理想。最优工艺制备接枝物的褐变程度A420 nm为0.041。
2.3 接枝物的聚丙烯酰胺凝胶电泳分析
图7为接枝度为52.54%的SPI-DEX与不同对照的电泳图谱。由图7可看出,SPI和SPI、DEX物理混合物条带较为完整,而83 ℃处理7 h的SPI因热解为多肽,故其亚基条带(α,β亚基)逐渐消失。与对照相比,高接枝度的糖蛋白样品图谱上基本看不到亚基的谱带,是因为考马斯亮蓝在酸性条件下通常与蛋白质分子上的自由氨基、巯基等活性基团以静电相交互作用而结合,从而显蓝色谱带。而蛋白与糖接枝后,自由氨基减少,故减少了染色剂与蛋白分子的结合,从而高接枝度样品电泳凝胶不显色,因此证明SPI与DEX以共价键结合。其中最末端条带的存在,可能是因为样品中含有未能参与接枝反应的游离氨基酸残基,此电泳结果与Safoura[13]、穆利霞[21]研究结果相同。

图7 分子量标记的聚丙烯酰胺凝胶电泳图谱Fig.7 SDS-PAGE pattern of molecular weight注:M:标准蛋白;1:SPI;2:83 ℃加热7 h SPI;3:未反应SPI、DEX物理混合物;4:SPI-DEX接枝物。
2.4 接枝物的氨基酸组分的变化

表4 SPI与SPI-DEX接枝物的氨基酸含量Table 4 Amino acid content analysis of SPI and SPI-DEX conjugates
蛋白与多糖的耦联接枝反应是基于蛋白的ε-氨基与多糖的还原性末端之间的美拉德反应。如表4可知,SPI与葡聚糖经热处理后,赖氨酸和精氨酸均发生显著下降,而赖氨酸和精氨酸是参与接枝反应的主要游离氨基酸,这一结果证明葡聚糖确实与SPI发生了接枝反应。
2.5 接枝物的溶解性分析
图8为SPI和SPI-DEX接枝物的溶解度曲线,由图8可看出,接枝物的溶解度随pH增大逐渐上升,到pH为7.0处溶解度为99.85%,比原蛋白提高40.48%不受蛋白等电点的影响;而SPI在接近等电点(pH为4.5)处溶解度急速降低为3.59%,在pH为7.0处为59.43%,受等电点影响明显。SPI-DEX溶解度均明显高于SPI,t检验表明,与对照差异极显著(t=7.67,p=0.00013),这可能是因为亲水性葡聚糖接枝在蛋白上,受到亲水羟基和电位等因素影响,使SPI溶解度提高。

图8 SPI与SPI-DEX接枝物的溶解度曲线Fig.8 Solubility curve of SPI and SPI-DEX conjugates
2.6 接枝物的乳化性分析
乳化活性与稳定性分别表示蛋白质参与形成乳浊液的能力与保持乳液稳定,在一定时间内未出现分层絮凝的能力。由表5可看出,接枝物的乳化活性与乳化稳定性分别比原蛋白提高69.76%和62.11%。具有较好的乳化性是蛋白质与多糖共价交联产物显著的特征。

表5 SPI与SPI-DEX接枝物的乳化性Table 5 Emulsifying property of SPI and SPI-DEX conjugates
3 讨论
接枝温度与时间是影响接枝产物功能特性的关键因素,穆利霞等[21]以大豆分离蛋白为原料,与阿拉伯胶混合反应16 h制备接枝改性大豆分离蛋白,所得产物褐变指数为0.7。孙炜炜等[22]以乳清分离蛋白与葡聚糖的混合物在干热条件下处理7 d,得到接枝度为35.77%、褐变指数为0.517的接枝产物,因接枝反应时间过长,反应向高级阶段进行,生成类黑精色素、不饱和的棕色含氮聚合体等复杂产物,使褐变程度增大,产物提纯困难。纪崴等[23]在100 ℃条件下制备乳化性优良的大米蛋白-乳糖接枝物,产物褐变程度达1.254,表明两者反应剧烈。Kim等[24]研究了在100 ℃,初始pH7.8,葡萄糖与甘氨酸、二甘氨酸、三甘氨酸反应所得复合物的特性。研究发现:随反应时间的延长,所有的美拉德反应产物在240 min时褐变程度达到最大。因此,选择较低反应温度、合适反应时间有利于糖与蛋白接枝反应的进行。本研究中,在反应温度为83 ℃,反应时间为7.3 h的条件下,进行大豆分离蛋白与葡聚糖的接枝反应,条件比较温和,时间较短,接枝度较高,而褐变指数较低;同时,接枝物的理化特性如:溶解度、乳化性及稳定性均有明显改善。
4 结论
以接枝度、褐变程度为指标,利用响应面实验设计对SPI-DEX接枝蛋白制备的工艺参数进行优化。结果表明,SPI-DEX制备的最佳工艺条件为:物料比(蛋白∶糖)1∶1.2,反应温度83 ℃,反应时间7.3 h,此条件下接枝度为56.38%,与理论值56.90%接近,A420 nm为0.041,褐变程度极低,说明采用响应面法优化糖接枝蛋白的制备工艺参数的效果比较好。
分别以聚丙烯酰胺电泳、氨基酸分析鉴定糖接枝蛋白,证明葡聚糖确实以共价键接枝在蛋白上;糖接枝蛋白在pH为7.0处的溶解度为99.85%,与原蛋白相比提高了40.48%;乳化性、乳化稳定性分别比原蛋白提高69.76%和62.11%。
[1]于莉萍,迟玉杰,刘红玉.糖基化提高大豆分离蛋白凝胶性的工艺条件[J]. 食品与发酵工业,2012,38(3):100-104.
[2]布冠好,张楠,陈复生.大豆蛋白-木糖复合物的抗原性、致敏性及结构特性研究[J]. 现代食品科技,2015,31(11):33-38,91.
[3]徐真真,黄国清,肖军霞.干热条件下大豆分离蛋白-木糖美拉德反应研究[J]. 粮油食品科技,2015,23(2):26-30.
[4]Comas D I,Wagner J R,Tomas M C. Creaming stability of oil in water(O/W)emulsions:Influence of pH on soybean protein-lecithin interaction[J]. Food Hydrocolloids,2006,20(7):990-996.
[5]Corzo-Martinez M,Soria A C,Belloque J,et al. Effect of glycation on the gastrointestinal digestibility and immunoreactivity of bovineβ-lactoglobulin[J]. International Dairy Journal,2010,20(11):742-752.
[6]Chen S N,Jiang L Z,Li Y,et al. Ultrasound-assisted enzymatic extraction of dietary fiber from pods[J]. Procedia Engineering,2011,15:5056-5061.
[7]布冠好,朱婷伟,陈复生.糖基化改性对大豆蛋白抗原性及结构特性的影响[J].中国粮油学报,2017,32(1):35-39.
[8]Pan X Y,Mu M F,Hu B,et al. Micellization of casein-graft-dextran copolymer prepared through Maillard reaction[J]. Biopolymers,2006,81(1):29-38.
[9]何晓叶,邰克东,高彦祥,等.美拉德反应制备蛋白质-多糖共价复合物的研究进展[J].食品工业科技,2016,37(6):377-382.
[10]Lydia J Campbell. Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J]. Food Hydrocolloids,2009,23:314-326.
[11]Chevalier F,Hobert J M,Popineau Y,et al. Improvement of functional properties ofβ-Lactoglobulin glycated through the Maillard reaction is related to the nature of the sugar[J]. International Dairy Journal,2001(11):145-152.
[12]夏秀芳,洪岩,郑环宇,等.湿法糖基化改性对大豆分离蛋白溶解性和乳化能力的影响[J]. 中国食品学报,2016,16(1):167-172.
[13]Safoura Pirestani,Ali Nasirpoura,Javad Keramata,et al. Preparation of chemically modified canola protein isolate with gum Arabic by means of Maillard reaction under wet-heating conditions[J]. Carbohydrate Polymers,2017,155:201-207.
[14]赖颖,李青芝,钟可.糖基化大豆分离蛋白制备工艺优化及对其性质的影响[J]. 大豆科学,2016,37(6):452-458.
[15]袁旦,秦新光,刘刚,等.美拉德反应制备等电点澄清透明的乳清分离蛋白研究[J]. 现代食品科技,2017,36(3):160-166,122.
[16]Laemmli U K. Cleavage of structural proteins during the assembly of thehead of bacteriophage T4[J]. Nature,1970,227:680-685.
[17]Hu Hao,Fan Xin,Zhou Zhi,et al. Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pre-treatments[J]. Ultrasonics Sonochemistry,2013,20(1):187-195.
[18]Yin Shouwei,Tang Chuanhe,Wen Qibiao,et al. Properties of cast films from hemp(CannabissativaL.)and soy protein isolates. A comparative study[J]. Journal of Agricultural & Food Chemistry,2007,55(18):7399-7404.
[19]Pearce K N,Kinsella J E. Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry,1978,26:716-723.
[20]Zhu D,Damodaran S,Lucey J A. Formation of whey protein isolate(WPI)-dextran conjugates in aqueous solutions[J]. Journal of Agricultural and Food Chemistry,2008,56(16):7113-7118.
[21]穆利霞,崔春,赵谋明,等.阿拉伯胶-大豆分离蛋白接枝工艺优化及产物理化特性的研究[J]. 农产品加工,2016(8):174-177.
[22]孙炜炜,于淑娟,杨晓泉,等.乳清分离蛋白-葡聚糖接枝物性质的荧光光谱法分析[J]. 光谱学与光谱分析,2011,31(12):3307-3310.
[23]纪崴,麻建国,李玥,等.限制性水解大米蛋白-不同多糖复合产物的制备及功能性质的研究[J]. 食品科学,2010,31(5):30-34.
[24]Kim J S,Lee Y S. Study of Maillard reaction products derived from aqueous model systems with different peptide chain lengths[J]. Food Chemistry,2009,116(4):846-853.

