乙酸肉桂酯在固定化脂肪酶反应器中的合成
周美娟,张莹,丛方地,,通信作者,张树林,刘黎瑶,罗巍
乙酸肉桂酯在固定化脂肪酶反应器中的合成
周美娟1,张莹1,丛方地1,2,通信作者,张树林2,刘黎瑶1,罗巍1
(1. 天津农学院 基础科学学院,天津 300384;2. 天津市水产生态与养殖重点实验室,天津 300384)
为提高乙酸肉桂酯的酶促合成效果,在柱形玻璃瓶中,将脂肪酶(lipase)固定在脱脂棉上,形成一种简易的生物反应器,用于催化肉桂醇与乙酸乙烯酯发生转酯反应。结果表明:在37℃、160 r/min条件下,12 h后,反应器中的固定化酶可使92%的底物转化,而酶粉仅能转化35%的底物。在静置条件下,分别在37、25和4 ℃保温12 h,底物转化率分别为88%、84%和44%。在每次6 h的重复催化试验中,固定化酶和酶粉转化底物能力每小时降低率分别为0.3%、0.5%。可见,反应器中的固定化酶相对于酶粉,其催化活性和非水稳定性明显提高,即使在室温和静置条件下,这种固定化酶反应器也表现出较高的催化活性,是一种低碳、高效的固定化酶反应器。
乙酸肉桂酯;脂肪酶;脱脂棉;酶活性;酶稳定性
食用香精是食品工业不可或缺的成分,大多食用香精的分子是酯类化合物,广泛存在于自然界中,具有浓郁的花香、果香[1]。乙酸肉桂酯是我国规定可以使用的一种食用香精,具有甜香、花香,并伴有浓郁的又辣又甜的菠萝味道[2]。其制备方法有多种,起初只能从天然植物中提取,但提取量极少且纯度较低,不能满足市场需要[3]。而后,采用化学法合成纯度相对较高的乙酸肉桂酯,但常伴有副反应发生,且后续分离提纯工艺繁琐,对设备要求高,易造成环境污染[4]。目前,工业上更多地使用微生物脂肪酶来催化合成重要的酯类化合物,特别是非水相中的酶促合成酯类的反应[5-6]。非水酶促合成方法,不仅反应条件温和、效率高、专一性强,而且不易造成环境污染,可极大程度地克服化学合成法的缺点[7]。但酶催化过程中的酶活性和稳定性,仍然需要进一步的提高。本文基于脂肪酶的界面活化机制,选用假单胞菌脂肪酶(lipase,PCL)为生物催化剂,通过物理吸附,在柱形玻璃瓶中将PCL固定在脱脂棉上,形成一种简易的固定化酶生物反应器,用于催化肉桂醇与乙酸乙烯酯发生转酯反应。相对于脂肪酶粉,这种生物反应器表现出较好的非水催化活性。
1 材料与方法
1.1 材料与仪器
假单胞菌脂肪酶(PCL,33 U/mg)购于杭州创科生物科技有限公司,肉桂醇为化学纯试剂(≥98%),乙酸乙烯酯、石油醚和正己烷皆为分析纯,医用脱脂棉购于市场。固定化操作和催化反应在摇床(HZQ-X恒温摇床,哈尔滨)中进行。反应动力学分析使用气相色谱法(GC,仪盟A90,上海),色谱仪配有氢火焰检测器和毛细管柱(SE-30,30 m×0.32 mm×0.33 µm)。酶构象分析使用红外光谱分析仪(I R Affinity-1,苏州)。
1.2 脱脂棉预处理
取约5 g脱脂棉置于100 mL的干净烧杯中,加入无水乙醇将脱脂棉完全浸没,在室温下放置1~2 d后,将脱脂棉取出并置于干净的烧杯中,用纱布将烧杯口封住,自然晾干,晾干后用镊子将其撕成蓬松状备用。
1.3 PCL的固定化
参考以前的研究[8-9],PCL 用量为10 mg。选用10 mL 的柱形玻璃瓶作为固定化容器。加入10 mg PCL 酶粉和0.2 mL 的蒸馏水,待酶粉完全溶解后,加入脱脂棉,使脱脂棉充分吸附酶液,再将柱型玻璃瓶固定在摇床中,敞口,在37 ℃和160 r/min下保持6 h,恰好可以使酶吸附在脱脂棉上,得到脱脂棉固定化酶PCL,简称脱脂棉固定化PCL,它和柱形瓶一起形成一个简易的脱脂棉固定化酶反应器。
1.4 酶促转酯反应
在脱脂棉固定化PCL酶反应器中,加入肉桂醇(1.34 g,10 mol)与乙酸乙烯酯(2 mL,21.6 mol),盖上盖子,封口膜密封,在37 ℃、160 r/min的条件下催化反应。PCL酶粉催化反应时,在10 mL柱型玻璃瓶中,加入10 mg酶粉,其他反应条件相同。如果重复使用酶催化反应,可以将反应液倒出,用少许正己烷清洗,后加入新的反应液,在上述反应条件下反应。
1.5 酶动力学分析
定期量取2 μL反应液,用1 mL正己烷稀释,0.25 μm 滤膜过滤,进行GC 分析。色谱条件为:氮气(0.4 MPa,分流比1∶1),130 ℃,保留1 min;20 ℃/min,210 ℃,保留5 min;60 ℃/min,280 ℃,保留2 min。进样和检测温度分别为280 ℃和 300 ℃。通过比较肉桂醇和乙酸肉桂酯的峰面积得出。底物的摩尔转化率[10],肉桂醇和乙酸肉桂酯的保留时间分别为3.8 min、4.7 min。
1.6 红外光谱分析
采用溴化钾压片法[11],PCL与溴化钾混合压片,若是使用过的PCL,用正己烷洗涤,待溶剂挥发后,再与溴化钾混合压片,用于红外分析。如果是固定化酶,先将固定有PCL的棉纤维在溴化钾中研磨,后将棉纤维取出,再做压片。红外光谱使用IRsolution 1.50SU1软件解卷积,用Origin 8.5分析酰胺Ⅰ带,采用二次导数自动寻峰和Gaussian曲线拟合。
2 结果与分析
2.1 最适脱脂棉用量
为确定脱脂棉的最佳用量,PCL为10 mg时,分别称取不同质量的脱脂棉,在10 mL柱型玻璃瓶中进行PCL的固定化,用于催化肉桂醇与乙酸乙烯酯的转酯反应,通过GC分析,得出酶促转酯反应的动力学,如图1。结果发现,脱脂棉用量为15 mg时,酶促催化转酯反应效果相对较好。脱脂棉用量不足时,转化底物的能力相对较低,原因是没有足量的棉纤维充分分散酶蛋白。而脱脂棉用量过多,棉纤维会阻碍底物分子的运动,导致底物分子不能充分与酶蛋白接触。所以,在后续试验中,选用15 mg脱脂棉进行固定化并进行相应的研究。制备的脱脂棉固定化酶PCL与柱形玻璃瓶一起形成了一种简易的固定化酶生物反应器,如图2。
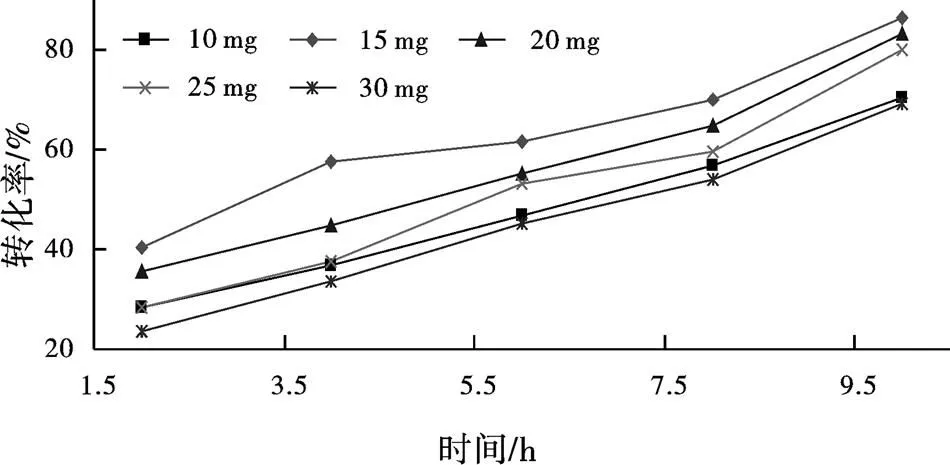
图1 不同脱脂棉用量下的酶促反应动力学
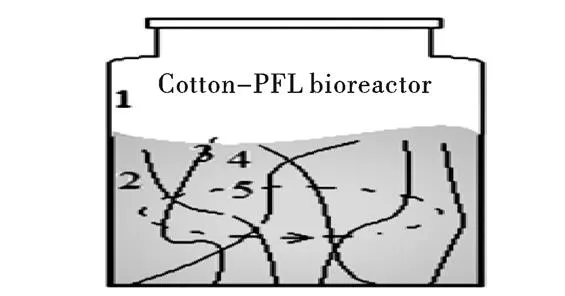
图 2 固定化酶PCL生物反应器示意图
注:1:瓶壁;2:吸附在瓶壁上的少量PCL;3:脱脂棉固定化PCL(表面吸附PCL的脱脂棉);4:棉纤维间间隙;5:摇动条件下流动的反应液
2.2 固定化酶与酶粉的活性比较
与酶粉相比较,脱脂棉固定化PCL的催化动力学曲线明显较高,如图 3。催化反应初期,2 h后,固定化酶和酶粉催化的转酯反应的转化率分别为40.1%和15.2%,前者是后者的2.6倍。12 h后,转化率分别为92.0%和35.3%,前者仍然是后者的2.6倍。表明固定化PCL酶反应器的催化活性不仅显著高于PCL酶粉,而且随着时间的延长,固定化酶反应器的活性没有明显降低,说明反应器中的脱脂棉固定化酶在有机相中是比较稳定的[12 ]。
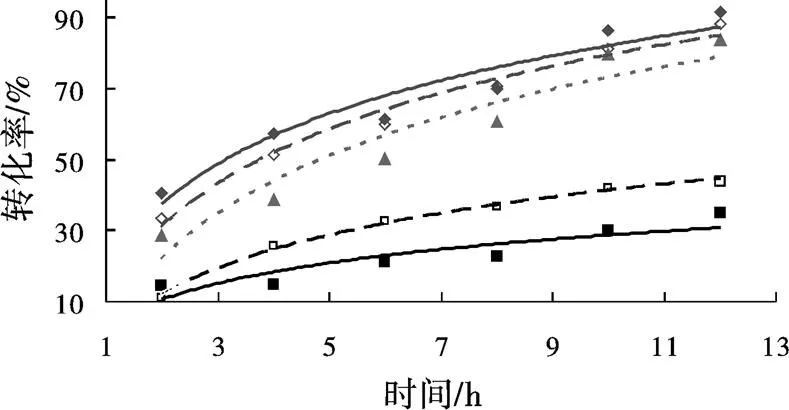
图 3 脱脂棉固定化PCL酶与PCL酶粉在不同条件下的动力学
注:◆脱脂棉固定化PCL,37 ℃、160 r/min;◇脱脂棉固定化PCL,37 ℃、0 r/min;▲脱脂棉固定化PCL,25 ℃、0 r/min;□脱脂棉固定化PCL,4 ℃、0 r/min;■PCL酶粉,37 ℃、160 r/min
2.3 静置和低温下酶反应器活性
加入反应液的脱脂棉固定化PCL反应器,在37、25、4 ℃下,保持静置,仍然保持优良的催化活性(图3)。在37 ℃,静置条件与160 r/min条件相比,静置时的脱脂棉固定化PCL的催化活性几乎没有明显的降低,这可能是因为脱脂棉纤细的纤维状结构使之有较大的比表面积,非常有利于PCL酶蛋白的分散,有效地降低了酶的扩散限制。加之棉纤维的柔韧性,有利于与液相充分接触。因此,在静置时,这种固定化PCL依然有很高的催化活性。在25 ℃室温静置条件下,这种反应器的活性依然比较理想。反应12 h后反应液的GC显示,静置条件下,在温度为37 ℃和25 ℃时,反应器中底物已经绝大部分被转化,转化率分别为88%和84%,与37 ℃和160 r/min条件下转化率(92%)相比,静置条件没有对转化率产生较大影响,而且都明显高于37 ℃和160 r/min条件下酶粉催化反应的转化率(35%)。
如图4显示,催化12 h后,37(25)℃和静置条件,与37 ℃和160 r/min相比较,固定化酶依然能将绝大部分肉桂醇转化为乙酸肉桂酯。即使在4 ℃,静置的这种反应器的催化活性仍高于酶粉在37 ℃、160 r/min条件的活性(图3)。可见,脱脂棉固定化PCL酶反应器是一种低碳生物反应器,有较大的潜在应用价值。
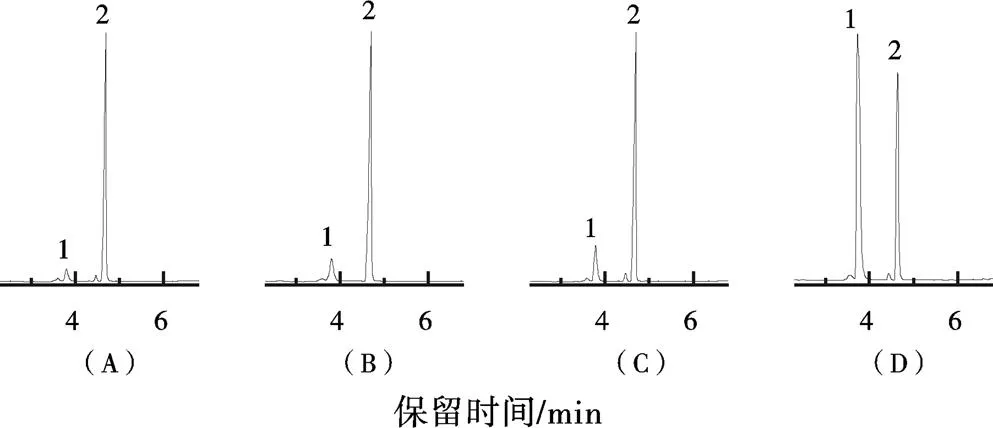
图 4 酶促转酯反应12 h后反应液的色谱图
注:1:肉桂醇;2:乙酸肉桂酯;A:脱脂棉固定化PCL,37 ℃、160 r/min;B:脱脂棉固定化PCL,37 ℃、0 r/min;C:脱脂棉固定化PCL,25 ℃、0 r/min;D:脱脂棉固定化PCL,4 ℃、0 r/min
2.4 固定化酶非水稳定性
脱脂棉固定化PCL和PCL酶粉的重复催化反应试验表明,再次使用时,它们的催化活性有所降低,见表 1。在重复使用3次,每次6 h,共18 h,比较反应的转化率降低值,脱脂棉固定化PCL催化的反应中,转化率平均每小时降低0.3%,PCL酶粉催化反应中,转化率平均每小时降低0.5%。说明固定化酶的非水稳定性较好。
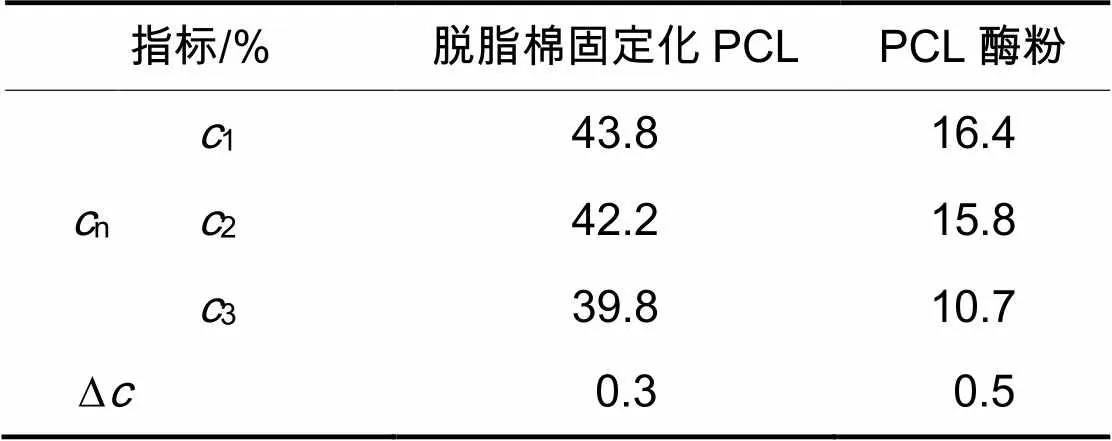
表1 脱脂棉固定化PCL和PCL酶粉转化底物的能力(使用3次,每次6 h)
注:n:转化率;:每小时转化降低率;=(13)/12
通过对PCL酶粉和脱脂棉固定化PCL的红外光谱的去卷积处理,再用origin 8.5软件进行二次求导寻峰,并用Gaussian方程曲线拟合,得出如图5所示的拟合曲线。从图5可以看出,代表蛋白质二级结构的酰胺I带[5,13-15]在有机体系中有明显的变化。
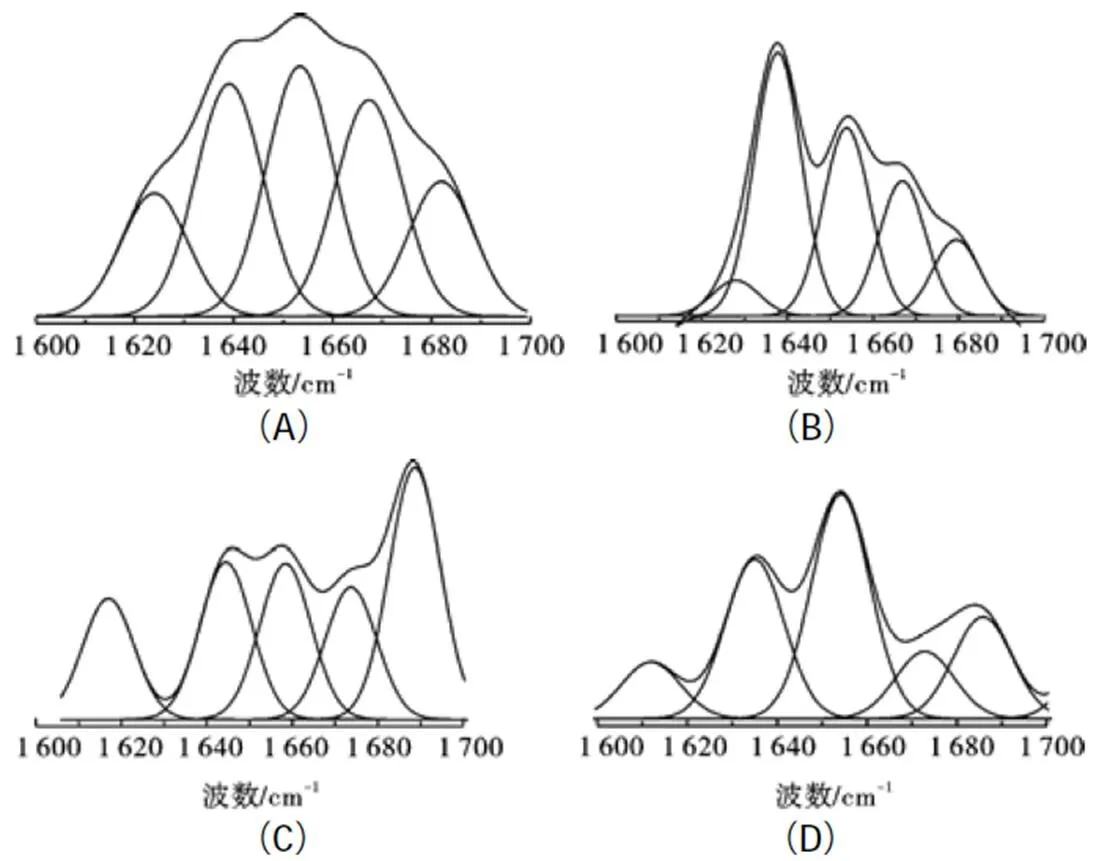
图 5 PCL酰胺I带(1 600~1 700 cm-1)Gaussian拟合曲线
注:A:PCL酶粉使用前酰胺I带拟合曲线;B:PCL酶粉使用18 h后酰胺I带拟合曲线;C:固定化酶使用前酰胺I带拟合曲线;D:固定化酶使用18 h后酰胺I带拟合曲线
在有机反应体系中使用18 h后,PCL酶粉的-螺旋含量变化较小,-折叠含量明显降低,降低10.8%,转角含量也降低约3.3%,无规卷曲含量增加了约13.5%;脱脂棉固定化PCL在使用前,相对于酶粉构象发生了明显的变化,-螺旋和-折叠的总量有所增加,在使用18 h后,虽然无规卷曲含量增加了6.9%,转角含量降低了5.3%,-折叠含量降低了19.1%,但-螺旋含量增加了17.5%,(表 2)。上述构象的变化,说明PCL酶粉的构象不够稳定,而脱脂棉固定化PCL的构象,在使用中虽然有较大变化,但有序构象却保持了较高的含量,说明脱脂棉有助于维持脂肪酶的有序结构,增强酶抗有机溶剂的变性作用。因而,在重复使用过程中,固定化酶的活性降低较少,表现出较好的非水催化活性和稳定性。
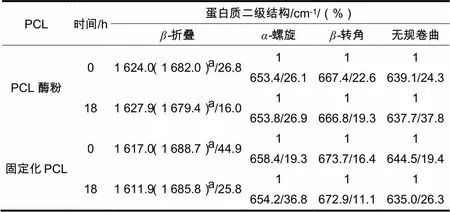
表2 有机体系对脱脂棉固定化PCL构象的影响
注:表中小写字母a表示平行式折叠(反平行式折叠)
3 结论
研究证明,相对于酶粉,脱脂棉固定化PCL酶反应器非水催化活性有明显提高。说明脱脂棉是一种较为理想的固定化载体,它如同水/油界面上的水分子,可以在非水条件下有效地稳定酶蛋白,使其保持优势蛋白构象,表现出优良的非水催化活性和较好的稳定性。静置条件下,脱脂棉固定化PCL酶反应器仍然保持优良的催化活性,说明棉纤维的结构非常有利于降低酶的扩散限制,这种酶反应器具有低碳条件催化特性。固定化酶的重复应用表明,相对于酶粉,其非水稳定性有所增加。红外光谱酰胺Ⅰ带的分析显示,脱脂棉固定化脂肪酶的二级结构相对于酶粉,其有序性较高,在有机体系中使用18 h后,虽然二级结构有较大改变,但二级结构的有序性依然较高,说明脱脂棉固定化酶PCL有较大的非水稳定性。
[1] Selvam K,Vishnupriya B,Maanvizhi M. Enzymatic synthesis of fragrance textile industry[J]. International Journal of Engineering and Advanced Technology,2013,3(2):91-96.
[2] 耿博. 脂肪酶催化合成乙酸肉桂酯的应用研究[D]. 天津:天津大学,2012.
[6] 姚侠,郑建永,应向贤,等. 有机相脂肪酶催化合成乙酸肉桂酯[J]. 生物加工过程,2012,10(3):12-16.
[3] 张玉姣,方岩雄,杨祖金,等. 水蒸气蒸馏提取桂叶精油中组分的分布规律[J]. 精细化工,2014,31(1):51-53.
[4] 刘昱杉,胡兴超,丛方地,等. 荧光假单胞菌脂肪酶(PFL)的固定化及催化合成乙酸肉桂酯[J]. 中国食品添加剂,2015(6):140-144.
[5] 王岁迪,王双双,丛方地,等. 丙烯酸树脂调节假单胞菌脂肪酶(PCL)的催化作用[J]. 食品科技,2015,40(10):211-215.
[6] 陈林林,李伟,辛嘉英. 非水相中酶促合成阿魏酸酯及其对自由基的清除[J]. 中国粮油学报,2016,31(7):120-125.
[7] 姜佳雯. 非水相脂肪酶催化合成萘普生油酸甘油酯的研究[D]. 哈尔滨:哈尔滨商业大学,2016.
[8] 李玲玲,闫倩玉,丛方地,等. 器壁固定化脂肪酶(lipase)的非水活性与稳定性[J].中国生物化学与分子生物学报,2014,30(10):1025-1030.
[9] 闫倩云,李玲玲,丛方地,等. 固定化脂肪酶生物反应器催化合成乙酸正己酯[J]. 食品工业科技,2015,36(9):171-174,183.
[10] Herbst D,Peper S,Niemeyer B. Enzyme catalysis in organic solvents:influence of water content,solvent composition and temperature onlipase catalyzed transesterification[J]. Journal of Biotechnology,2012,162:398-403.
[11] 刘成成,卜路霞,赵爽,等. 氯化胆碱-丙二酸离子液体的制备及性能研究[J]. 天津农学院学报,2016,23(3):20-22.
[12] Zhang B,Weng Y,Xu H,et al. Enzyme immobilization for biodiesel production[J]. Applied Microbiology and Biotechnology,2012,93(1):61-70.
[13] 阎波. Cu(Ⅱ)、Zn(Ⅱ)水溶液的微观结构及其对牛血清白蛋白构象的影响[D]. 天津:天津大学,2009.
[14] 高铮亚. 水溶液中蛋白质二级结构红外分析方法的建立及cAMP受体蛋白构象研究[D]. 上海:复旦大学,2012.
[15] 刘永春,齐慧丽,魏晓霞,等. 静注免疫球蛋白与盐酸伊立替康的相互作用[J]. 化学研究与应用,2015,27(12):1841-1848.
责任编辑:宗淑萍
Synthesis of cinnamyl acetate in an immobilized-lipase bioreactor
ZHOU Mei-juan1, ZHANG Ying1, CONG Fang-diCorresponding Author, ZHANG Shu-lin2,LIU Li-yao1, LUO Wei1
(1. College of Basic Sciences, Tianjin Agricultural University, Tianjin 300384, China; 2. Tianjin Key Lab of Aqua-ecology and Aquaculture, Tianjin 300384, China)
To improve the synthetic effect of cinnamyl acetate,lipase was immobilized on cotton fibers in a column glass bottle to form a facile bioreactor and used to catalyze transesterification between cinnamyl alcohol and vinyl acetate. The results were that the bioreactor could transform 92% of substrate after 12 h at 37 ℃ and 160 r/min while native lipase only gave a conversion of 35% under the same reaction conditions. Even at static state, the bioreactor brought high conversions, which were 88%, 84% and 44% after 12 h at 37, 25 and 4 ℃, respectively. In repeated 6 h catalysis, the immobilized and native lipases exhibited that the decrease rates in ability of transforming substrate were 0.3% and 0.5% per hour. It showed that the immobilized lipase in bioreactor behaved activity and stability higher than native lipase in the non-aqueous phase, which was also so at static state. This meant that it was a type of effectively low-carbon immobilized lipase bioreactor.
cinnamyl acetate; lipase; absorbent cotton; enzyme activity; enzyme stability
TS 201.3
A
1008-5394(2018)01-0064-04
10.19640/j.cnki.jtau.2018.01.014
2017-05-31
国家级大学生创新创业训练计划项目(201410061136);天津市水产生态及养殖重点实验室开放基金项目(TJAE201502);国家自然科学基金项目(31170442)
周美娟(1993-),女,本科在读,从事非水相酶催化方面的研究。E-mail:1138816897@qq.com。
丛方地(1968-),男,教授,博士,从事生物催化方面的研究。E-mail:congfangdi@163.com。

