微生物降解甲基磺草酮的量子化学研究
朱华玲,吕丽娟,黄治强
微生物降解甲基磺草酮的量子化学研究
朱华玲,吕丽娟,黄治强
(天津农学院 基础科学学院,天津 300384)
甲基磺草酮是重要的玉米田除草剂,主要降解途径是微生物降解。本文采用量子化学从头算法在HF/6-31G(d)水平上对甲基磺草酮分子进行了结构优化和频率分析,分析了化合物可能发生氧化、还原反应的位点,比较了不同氧化还原过程中焓变及吉布斯自由能变的大小,分析了各反应途径的热力学可能性。计算结果表明,在微生物体内氧化酶的催化作用下,甲基璜草酮会优先发生加氧氧化生成pro6,这有助于进一步认识甲基磺草酮在环境微生物作用下的降解行为。
甲基磺草酮;氧化还原;量子化学
作为阿特拉津的替代品,甲基磺草酮是由先正达公司开发的抑制对羟基苯基丙酮酸双氧化酶(HPPD)的一种新型三酮类玉米除草剂,具有杀草谱广、活性高、可混性强、对后茬作物安全、使用灵活、环境相容性强等特点,尤其是对磺酰脲类除草剂产生抗性的杂草有特效,因而从2012年开始在我国得到大规模生产及推广应用[1]。
开发甲基磺草酮除草剂的目的是为了减少对环境的不利影响,然而研究发现事实并非如此,这些化合物及其降解产物对藻类、鱼类、无脊椎动物等有明显的毒性和内分泌干扰作用,同时,还能改变河口地区底栖生态群落结构[2-4]。研究发现,微生物降解是甲基磺草酮在土壤中主要降解模式之一,其中微生物主要降解产物为MNBA和AMBA(图1),且AMBA比甲基磺草酮的毒性更高[5-11]。
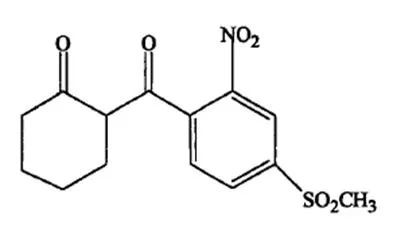
图1 甲基磺草酮(左)及主要降解产物MNBA(中)和AMBA(右)
目前,关于甲基磺草酮在土壤微生物降解过程中降解可能性和降解位点的研究还未见文献报道。本文采用量子化学从头算法对甲基磺草酮在微生物参与下可能发生的氧化、还原反应位点和反应途径进行分析,并通过统计热力学方法比较分析各种途径的反应可能性,旨在为消除除草剂甲基磺草酮可能产生的环境污染提供一定的参考。
1 计算方法
运用Gamess程序包[12],采用从头算法(Hartree-fock)在6-31G(d)基组下对甲基磺草酮进行结构优化和频率分析,获得了该化合物的电荷分布和成键情况,根据化合物的电荷分布和成键情况分析该化合物可能发生氧化还原反应的位点和可能的氧化还原反应产物。在1个大气压、25 ℃下对氧化还原反应过程中的各反应物、中间体和产物等进行结构全优化和振动频率分析。根据计算得到各化合物的焓()、熵()和吉布斯自由能()等热力学参数,进一步计算各氧化还原反应的自由能变()和焓变(),以此来判断反应的可能性。
2 结果与分析
2.1 甲基磺草酮分子的电荷分布与前沿轨道
对甲基磺草酮进行结构优化时的原子编号如图2所示,计算得到化合物中各原子的电荷数值如表1所示,前沿轨道的分布及能量如图3和表2所示。对图1和表1的数据进行分析发现,甲基磺草酮分子中带有正电荷的原子依次是S15、C1、C23、C24、N12,表明这些原子比较容易与带负电的氢化酶活性中心结合[13],在微生物体内这些原子往往比较容易在氢化酶的催化作用下发生催化加氢的还原反应。甲基磺草酮分子中带有负电荷的非氧原子依次是C18、C22、C25、C26和C8,表明这些原子较易与带正电的氧化酶活性中心结合[14],在微生物体内这些原子的位置是较易在氧化酶的催化作用下发生加氧氧化的位置。
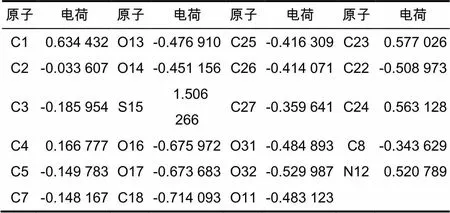
表1 甲基磺草酮分子中各原子的电荷分布
分子的前沿轨道是化学反应进行的重要场所,原子轨道在前沿分子轨道中占有比例越大,表明该原子发生某一类型化学反应的概率越大。通过对表2和图3的分析发现,甲基磺草酮的5条前沿高占有轨道(HOMO)中贡献比较高的原子依次是O32、O31、C8、C22、C2、O11、C3、C4、C7、C5、O16和C18,在前沿的5条低空轨道(LUMO)中贡献比较高的原子依次是C24、N12、C3、C5、C7、C4、C2、H36、C8、O13、O14、O11、C23、C22,这表明在相同条件下甲基磺草酮发生化学反应时,O32、O31、C8、C22、O11、C24、N12、C3、C5、C7、C4、C2、H36、O13、O16、C18、C23、C22和O14等原子会具有更大的优先权。
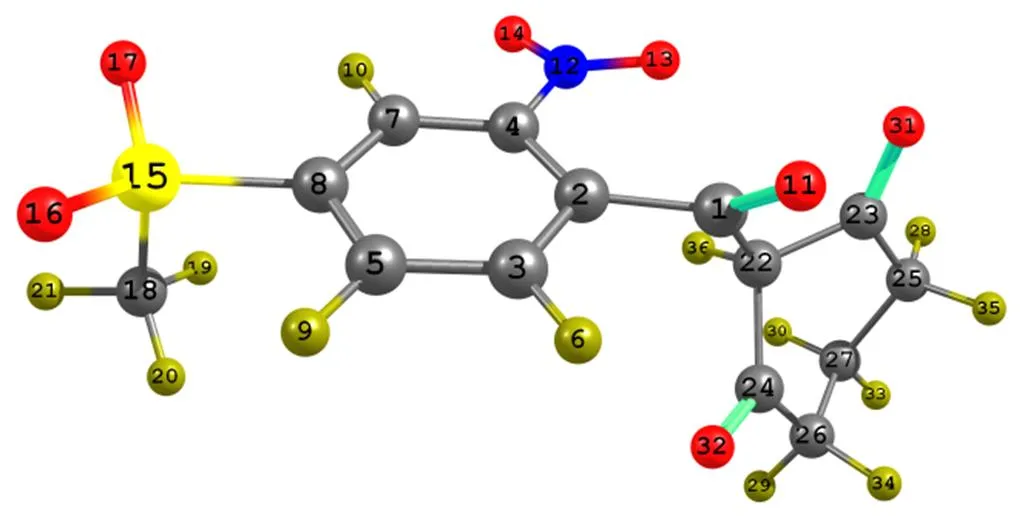
图2 甲基磺草酮结构优化时的原子编号
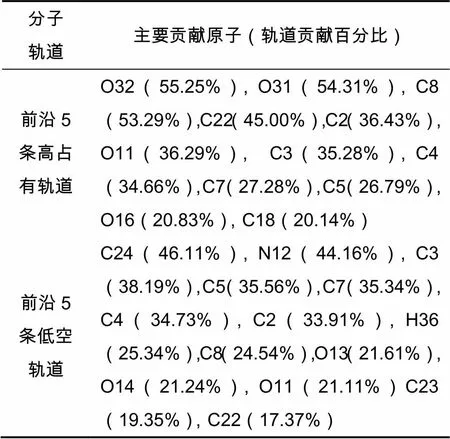
表2 甲基磺草酮的各原子对前沿轨道的贡献
将电荷分布和前沿轨道分布情况汇总不难发现,甲基磺草酮在微生物体内发生氧化还原反应时是有选择性的。由于催化加氧氧化反应的氧化酶,其活性中心多数带正电,更易与分子中带负电荷的碳原子结合,故甲基磺草酮在微生物体内与氧化酶结合发生加氧氧化反应的位点主要集中在C8、C18和C22等原子上。相应地,甲基磺草酮在微生物体内与氢化酶结合发生加氢还原反应的位点主要集中在N12、C23、C24等原子上。结合上述分析,甲基磺草酮在微生物体内可能的加氧氧化和加氢还原产物主要有6种,如图4所示。
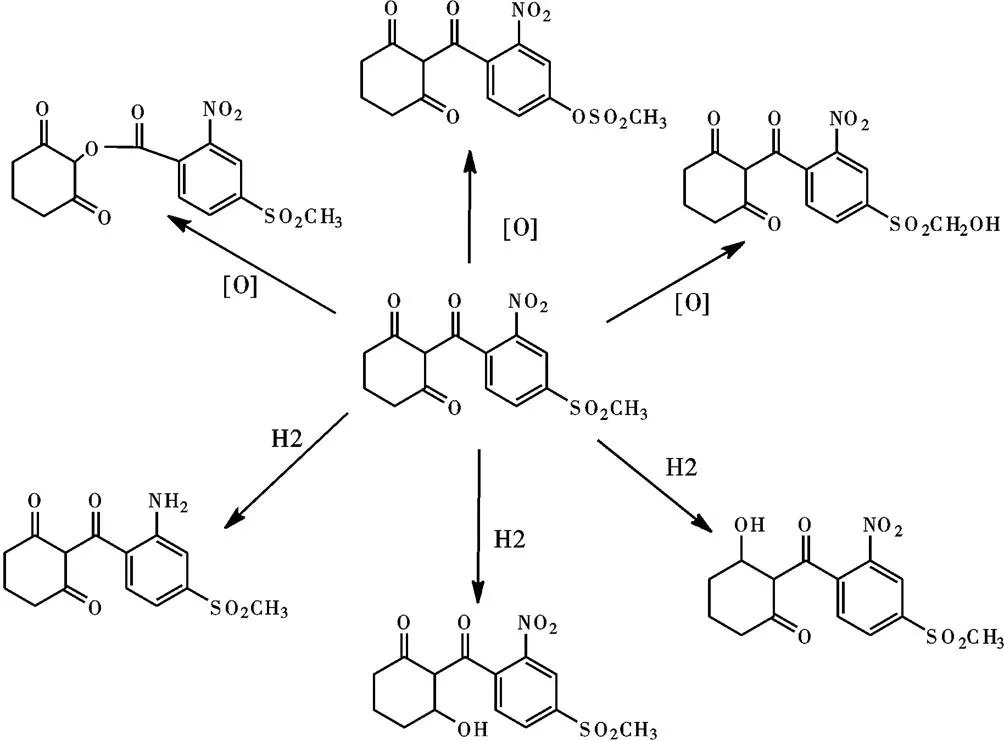
图4 甲基磺草酮可能的加氧氧化和加氢还原反应的产物
2.2 氧化还原反应的热力学可能性
考虑到微生物体内生物化学反应的实际过程多数是在酶和辅酶的催化作用下进行的,例如在细胞色素P450酶和NADPH催化下可以实现烃的羟基化过程,在脱氢酶和NADPH催化下可以实现酮的加氢还原反应等。但从化学热力学的角度看,化学反应过程中热力学函数的改变值只与反应的始、终态有关,与具体的反应历程无关[15]。
鉴于此,为简化计算过程,降低计算量,用普通的有机化学反应代替酶催化反应,计算甲基磺草酮在生物体内发生加氧氧化和加氢还原反应过程的热力学函数改变值。结合图4所示甲基磺草酮可能的6种氧化还原降解产物,最终确定6个具体的化学反应,如图5所示。对这6个反应的反应物、产物进行结构优化和频率分析,可以计算得到各化合物的焓()、熵()和吉布斯自由能()等热力学参数,如表3所示。根据表3的热力学数据,结合化学热力学第一、第二以及第三定律,对甲基磺草酮可能发生的6种化学反应进行相应热力学函数改变值的运算,得到对应过程的焓变()、吉布斯自由能变()及热力学能的改变值(),具体结果如表4所示。
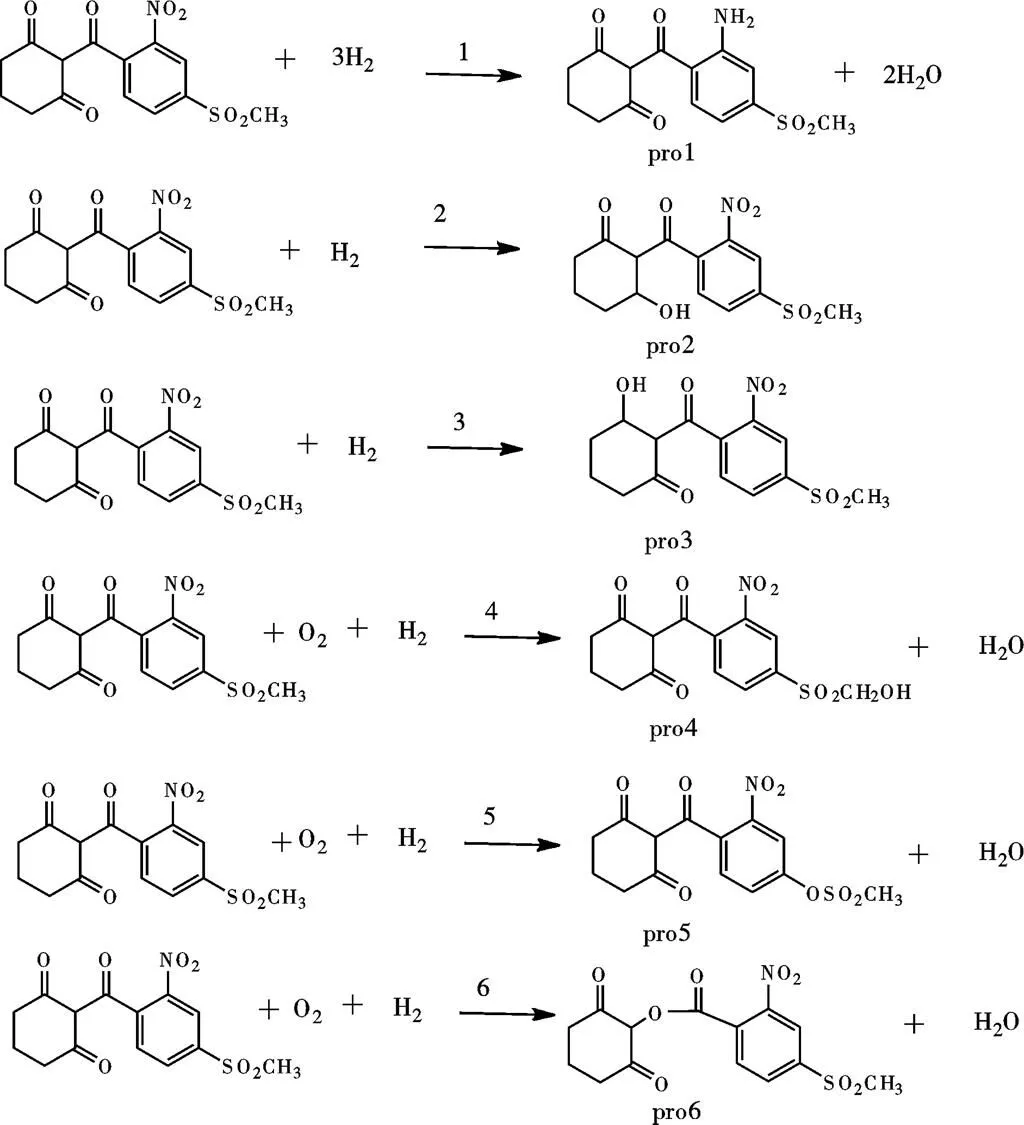
图5 甲基磺草酮可能发生的加氧氧化和加氢还原反应示意图
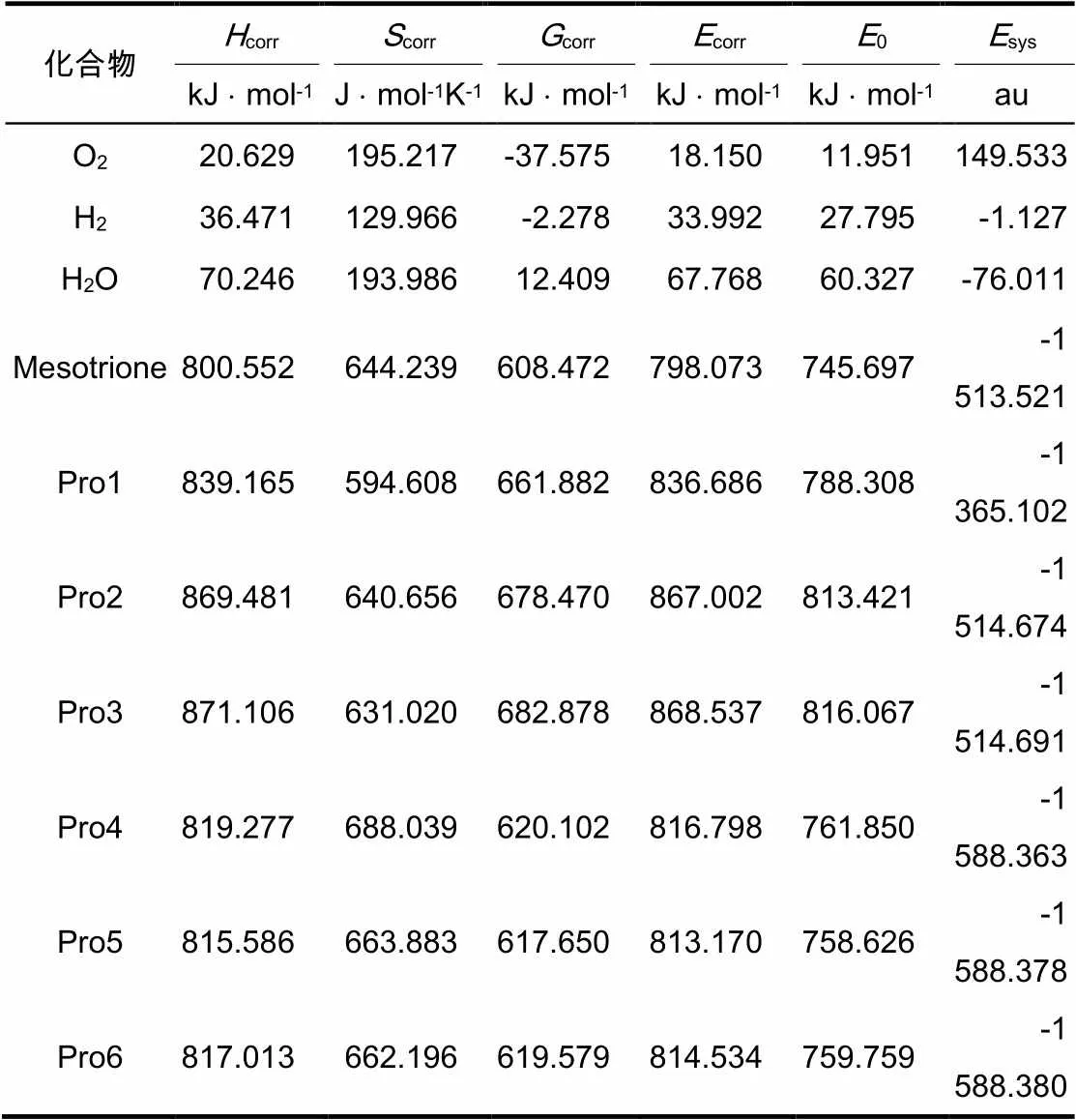
表3 氧化还原反应中各物质的热力学参数
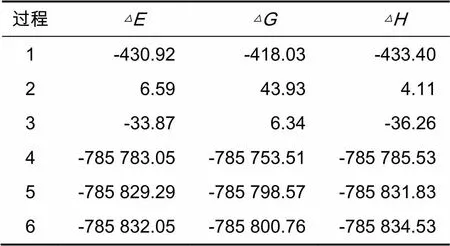
表4 各氧化还原反应过程的热力学函数改变值kJ·mol-1
根据化学热力学吉布斯函数判据,结合表4的计算结果可以看出:
对于还原反应1、2、3而言,2和3的均为正值,表明在25 ℃、1个大气压条件下这两个还原反应较难发生。虽然还原反应1的为负值,但其值较大,表明该反应在25 ℃、1个大气压条件下能发生,不过进行程度不高。反应1和3的焓变<0,是放热反应,而反应2的焓变>0,是吸热反应。
对于氧化反应4、5、6而言,其焓变<0,是放热反应。反应4、5、6的△均为负值,表明在25 ℃、1个大气压条件下,4、5、6三个氧化反应发生的可能性都比较大。这3个反应的存在如下关系:(6)<(5)<(4),表明在1个大气压、25 ℃及同种氧化酶催化下,反应6发生的可能性最大,其次为反应5,较难反应的是反应4。换言之,甲基磺草酮在微生物体内氧化酶的催化作用下,优先发生加氧氧化生成产物pro6,这是降解反应的第一步。而pro6可在水解酶的作用下进一步水解得到主要降解产物MNBA,MNBA在脱氢酶的作用下还原加氢可得到另一主要降解产物AMBA,这一可能降解途径与殷春涛等[5]研究的结果一致。
3 结论
微生物降解是甲基磺草酮在土壤中降解的最主要渠道,而甲基磺草酮在微生物体内氧化还原酶的催化作用下,可以发生加氧氧化和加氢还原两种降解途径。通过对这两种途径中各反应位点的确定和反应可能性的分析,发现甲基磺草酮最主要的降解途径是在微生物体内氧化酶的催化作用下优先发生加氧氧化生成产物pro6,这是降解反应的第一步。
[1]陈天明. 典型有机农药在沿海滩涂湿地中的环境行为[D].北京:中国矿业大学,2016.
[2] Barchanska H,Kluza A,Krajczewska K,et al. Degradation study of mesotrione and other triketone herbicides on soils and sediments[J]. Journal of Soils & Sediments,2016,16(1):125-133.
[3] Barchanska H,Kowalska A,Poloczek B. Extraction procedures for the study of phytotoxicity and degradation processes of selected triketones in a water ecosystem[J]. Environmental Science & Pollution Research International,2014,21(6):4751-4758.
[4]Mountacer H,Atifi A,Wong-Wah-Chung P,et al. Degradation of the pesticide carbofuran on clay and soil surfaces upon sunlight exposure[J].Environ Sci Pollut Res,2014,21(5):3443–3451.
[5] 殷春涛. 土壤中甲基磺草酮的迁移行为和降解特性[D]. 淮南:安徽理工大学,2014.
[6] Bonnet J L,Bonnemoy F,Dusser M,et al. Toxicity assessment of the herbicides sulcotrione and mesotrione toward two reference environmental microorganisms:and[J]. Arch Environ Contam Toxicol,2008,55:576–583
[7] Batisson I,Crouzet O,Besse-Hoggan P,et al. Isolation and characterization of mesotrione-degradingsp. from soil[J]. Environmental Pollution,2009,157(4):1195- 1201.
[8] Shaner D,Brunk G,Nissen S,et al. Role of soil sorption and microbial degradation on dissipation of mesotrione in plant-available soil water [J]. Journal of Environmental Quality,2012,41(1):170-178.
[9]Su W,Hao H,Wu R,et al. Degradation of mesotrione affected by environmental conditions[J]. Bulletin of Environmental Contamination & Toxicology,2016,98(2):212-217.
[10]Olchanheski L R,Dourado M N,Beltrame F L,et al. Mechanisms of tolerance and high degradation capacity of the herbicide mesotrione bystrain DH5-α[J]. Plos One,2014,9(6):e99960.
[11] Durand S,Sancelme M,Delort A M,et al. Study by NMR and LC/ESI-MS of the biodegradative pathway of mesotrione[C]// Symposium Pesticide Chemistry,Piacenza,Italy,2007.
[12] Schmidt M W,Baldridge K K,Boatz J A,et al. General atomic and molecular electronic structure system[J].J Comput Chem,1993,14,1347-1363
[13]赵斌,程鹏. 镍铁氢化酶活性中心的结构、催化机理及化学模拟[J].无机化学学报,2002,18(1):8-16.
[14] 李任强,谢丽思. 生物体激活利用氧分子的机理[J]. 生命的化学,2010,30(4):603-607.
[15]印永嘉.物理化学简明教程[M]. 3版. 北京:高等教育出版社,1992.
责任编辑:宗淑萍
Quantum chemistry study on microbial degradation of mesotrione
ZHU Hua-ling, LÜ Li-juan, HUANG Zhi-qiang
(College of Basic Science, Tianjin Agricultural University, Tianjin 300384, China)
Mesotrione is an important herbicide in maize field, and one of its main degradation pathways is microbial degradation. HF/6-31G(d)was used to perform the structural optimization and frequency analysis of mesotrione. The possible oxidation and reduction reactions in micro-organisms of the compound were studied. The entropy and Gibbs free energy of different redox processes were compared. The calculation results showed that mesotrione will give priority to produce pro6 with the catalytic effect of enzymes in microorganisms, which helps us to further understand the degradation behavior of mesotrione by microorganisms in environment.
mesotrione; redox reaction; quantum chemistry
X592
A
1008-5394(2018)01-0068-04
10.19640/j.cnki.jtau.2018.01.015
2017-07-04
天津市自然科学基金项目(14JCQNJC06300)
朱华玲(1975-),女,副教授,硕士,主要从事功能化合物的合成与活性研究。E-mail:zhuhualing2004@126.com。

