STAT3磷酸化与白塞病临床活动性的关系
鲍华芳 蔡剑飞 陈 永 罗 丹 申 艳 邹 峻 管剑龙
(复旦大学附属华东医院免疫风湿科 上海 200040)
白塞病(Behcet’s disease,BD)是一种原因不明的,以血管炎为病理基础的多系统损害性疾病[1]。临床上以复发性口腔溃疡、生殖器溃疡、葡萄膜炎和结节性红斑为主要特征,并可累及胃肠道、心血管、神经、血液等多系统。尽管世界各地均有BD报道,但BD在沿古丝绸之路的中东、地中海和远东国家发病率更高,如中国、韩国、日本、土耳其和伊朗。其中,土耳其报告的发病率最高,为80~370/10 万人[2-3]。
Janus激酶/信号转导及转录激活因子(signal transducer and activator of transcription,STAT)(JAK/STAT 通路)对Th1、Th17细胞分化具有重要作用[4-7]。而T细胞免疫紊乱,特别是Th1和Th17活化和Treg调节减弱被认为是BD发病机制的基石[7-10]。近年研究提示,BD 人群存在STAT3、STAT4基因突变。Hu等[4]研究发现,与健康对照相比,BD患者STAT3的rs2293152基因型显著增多。已有研究证明类风湿关节炎、炎症性肠病、脊柱关节病和银屑病等自身免疫病与JAK/STAT 通路相关[7,11]。少量研究提示JAK/STAT3 参与BD发病过程。Hamedi等[1]发现,负调节JAK/STAT信号通路的细胞因子信号转导抑制蛋白(suppressor of cytokine signaling,SOCS)在BD中表达上调。Tulunay等[7]通过通路富集分析发现,JAK/STAT3 通路在BD患者的CD14+单核细胞和CD4+淋巴细胞中激活。但目前缺乏有关STAT3磷酸化在BD发病机制中作用的报告。
本研究应用STAT3磷酸化特异性抑制剂Stattic,以活动期和缓解期BD患者为研究对象,探讨STAT3磷酸化在BD发病机制中的作用及其与BD活动的关系,以期为BD治疗寻找新靶点。
资 料 和 方 法
研究对象纳入BD患者均符合2013国际白塞病诊断标准(the International Study Group for Behcet’s Disease),排除伴有其他疾病后入组。BD患者的下列症状≥3个则定义为BD活动期(BD -active,BD -A)患者:口腔溃疡、生殖器溃疡、针刺反应阳性、结节性红斑、眼葡萄膜炎、关节炎以及心脏、肠道、血管、血液和神经系统累及。若BD患者症状<3个则定义为BD缓解期(BD -remission,BD -R)[1,7]。健康对照(healthy control,HC)为与患者无亲属关系的健康成人。BD患者和健康对照均于2016年3月至8月期间在复旦大学附属华东医院风湿科门诊及病房募集。本研究通过复旦大学附属华东医院伦理委员会批准(批件编号 20140100),所有参与对象均已签署知情同意书。
标本采集采集每位实验对象全血样本,统计汇总临床资料包括病史、体征、实验室和影像学检查及治疗经过。
细胞实验
外周血单个核细胞的分离与培养无菌条件下抽取BD -A患者、BD -R患者和HC静脉血15 mL (EDTA抗凝),混匀,2 h内处理。采用Ficoll密度梯度离心法提取PBMC。D -Hank’s液稀释PBMC细胞,制成PBMC细胞悬液,并调整浓度至细胞2×106/mL。取PBMC悬液加入T25培养瓶内,每瓶3 mL。BD -A、BD -R和HC组内进一步均分为Stattic抑制剂亚组和空白对照(blank control)亚组。Stattic抑制剂亚组加入2.5 μmol/L Stattic[12]及1 640培养基共5 mL,空白对照亚组中仅加1 640培养基共5 mL。将PBMC细胞板放置于 37 ℃、5% CO2培养箱(日本Sanyo公司)培养72 h备用。
荧光定量聚合酶链反应(reverse transcription-PCR)提取总RNA;按照cDNA第一链合成试剂盒说明书合成cDNA;参照Genbank中人TNF-α、IFN-γ和IL-17基因序列设计合成,所用引物见表1。按逆转录M-MLV1试剂盒(TAKARA公司)说明书依次加入以下试剂建立20 μL PCR反应体系:10 μL Subgreen mix (2×),正、反义引物各0.5 μL,1 μL RT反应液,8 μL的DEPC dH2O。于Applied Biosystems 7900HT荧光定量PCR仪(加拿大Funglyn Biotech公司)上进行扩增反应,绘制扩增曲线,通过2-△△Ct计算目的基因表达水平。

表1 TNF-α、IFN-γ和IL-17实时PCR引物序列Tab 1 Sequence of TNF-α,IFN-γ and IL-17 primers used in RT-PCR
Western blot (WB)检测提取适量PBMC标本总蛋白;将蛋白质样品变性后以10% SDS-PAGE电泳分离,再将蛋白质条带转印至同相支持物上(PVDF膜),然后分别用一抗pSTAT3抗体、STAT3抗体及二抗羊抗兔IgG抗体(均为美国Abcam公司)孵育,采用UVP分析仪对胶片进行扫描,系统按预先设定参数,自动生成蛋白质条带的灰度值。
流式细胞术(flow cytometry,FCM)检测使用移液器轻轻吹匀培养后的PBMC,将细胞混合液移入15 mL离心管中,500×g离心10 min,离心结束后,弃培养液上清,重复上述离心过程1次。用500 μL PBS悬浮细胞沉淀,以4%PFA固定2 h之后分别加入pSTAT3抗体和STAT3抗体,室温条件下孵育30 min,500×g离心5 min,PBS悬浮细胞进行流式细胞术分析(美国BD Biosciences公司FACS Calibur流式细胞仪)。
ELISA检测细胞培养上清液-80 ℃保存,按照ELISA试剂盒(美国eBioscience公司)要求和步骤检测TNF-α、IFN-γ和IL-17蛋白质水平。
结 果
临床资料共纳入BD患者30例,健康对照10例。根据前述诊断标准,BD患者又分为BD -A和BD -R组。3组平均年龄(F=1.357,P=0.274)及性别(P=0.875)差异无统计学意义。BD -A组和BD -R组病程差异也无统计学意义(t=-1.294,P=0.212)。具体资料见表2。


ItemsBD-ABD-RMean(y)34.20±11.2040.10±11.78Male/Female(n)6/45/5Diseaseduration(y)6.53±6.0610.70±8.19Oralulcers9(90)4(40)Genitalulcers4(40)1(10)Ocularlesions2(20)2(20)Erythemanodosum6(60)5(50)Folliculitis3(30)2(20)Jointinvolvement2(20)1(10)Intestinalulceration2(20)0Cardiovascularinvolvement2(20)1(10)Centralnervoussystem2(20)1(10)Pathergytest01(10)
pSTAT3和STAT3蛋白质水平两因素方差分析显示,BD对pSTAT3蛋白质(FCM检测:F=84.83,P<0.000 1;WB检测:F=717.8,P<0.000 1)和STAT3蛋白质水平(FCM检测:F=41.03,P<0.000 1;WB检测:F=207.5,P<0.000 1)影响显著,BD活动性增加,蛋白质水平增加;STAT3磷酸化对pSTAT3蛋白质(FCM检测:F=41.84,P<0.000 1;WB检测:F=573.7,P<0.000 1)和STAT3蛋白质水平(FCM检测:F=16.55,P<0.000 1;WB检测:F=8.823,P=0.004 4)影响差异显著,磷酸化作用抑制时蛋白质水平减少。Bonferroni post hoc test事后检验结果显示,BD -A组与BD -R组相比,BD -A组中空白对照亚组和Stattic抑制剂亚组pSTAT3蛋白质水平均高于BD-R组(FCM检测:空白对照亚组,t=4.228,P<0.001;Stattic抑制亚组,t=3.668,P<0.01;WB检测:空白对照亚组,t=6.922,P<0.001;Stattic抑制亚组:t=3.595,P<0.01);BD -A组中空白对照亚组STAT3蛋白质水平显著高于BD -R组(FCM检测:t=4.015,P<0.01;WB检测:t=2.758,P<0.05),BD -A组中Stattic抑制亚组较BD -R组有上升趋势(FCM检测:t=1.783,P>0.05,BD -Rvs.BD -A,19.28±1.071vs.21.54±3.498;WB检测:t=3.595,P<0.01,BD -Rvs. BD -A,0.447 3±0.008 6vs.0.455 3±0.019 8)(图1和图2)。
TNF-α、IFN-γ及IL-17mRNA和蛋白质水平BD和STAT3磷酸化对TNF-α、IFN-γ和IL-17 mRNA和蛋白质水平有显著影响。BD活动性增加,TNF-α mRNA (F=20.60,P<0.000 1)和蛋白质(F=28.89,P<0.000 1)、IFN-γ mRNA (F=39.17,P<0.000 1)和蛋白质(F=5.437,P=0.023 6)、IL-17 mRNA(F=13.42,P=0.000 7)和蛋白质(F=16.93,P=0.000 2)水平显著增加。STAT3磷酸化作用被抑制时,TNF-α mRNA(F=66.46,P<0.0001)和蛋白质(F=22.11,P<0.000 1)、IFN-γ mRNA (F=44.54,P<0.000 1)和蛋白质(F=17.40,P<0.000 1)、IL-17 mRNA(F=30.48,P<0.000 1)和蛋白质(F=15.50,P<0.000 1)水平显著减少。Bonferroni post hoc test事后检验结果显示:BD-A组中TNF-α mRNA水平在空白对照亚组(t=8.180,P<0.001)和Stattic抑制剂亚组(t=3.736,P<0.01)中均显著高于BD -R组;BD -A组TNF-α蛋白质(t=2.644,P<0.05)和IFN-γ蛋白质(t=2.668,P<0.05)水平在空白对照亚组中显著高于BD -R组,在Stattic抑制剂亚组差异无统计学意义;BD -A组的Stattic抑制剂亚组中,IFN-γ mRNA (t=4.289,P<0.001)、IL-17 mRNA(t=3.921,P<0.001)和IL-17蛋白质(t=3.004,P<0.01)水平表达较BD -R组显著升高,而在空白对照亚组中差异无统计学意义(图3)。
讨 论
STAT3即信号转导子及转录激活子通过JAK/STAT3 通路磷酸化,pSTAT3表达可作为STAT3通路激活的直接检测指标[13]。酪氨酸激酶(janus activated kinase,JAK)可磷酸化细胞因子受体和多个含特定SH2结构域的信号分子。细胞因子与相应受体结合后引起受体分子二聚化,使与受体偶联的JAK活化。JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰,进而使STAT3磷酸化。pSTAT3随即二聚化并进入细胞核,与相关 DNA 结合,促进转录,并合成相关蛋白质[7,11,14]。
本文研究STAT3磷酸化特异性抑制剂Sattic对BD患者PBMC细胞STAT3、pSTAT3以及Th1、Th17相关细胞因子TNF-α、IFN-γ和IL-17水平的影响。Stattic为卟啉类非肽小分子,是STAT3磷酸化的特异性[15-16],通过与STAT3的SH2功能区结合,抑制STAT3在Tyr705位点磷酸化,以抑制STAT3基因表达、蛋白质活化、二聚体形成而抑制STAT3核转运。近来研究提示,STAT3磷酸化作用增强可能与BD免疫应答相关,Wang等[17]研究发现,与免疫应答相关的芳烃受体基因(aryl-hydrocarbon receptor,AhR)基因在BD-A患者PBMC中表达比BD-R患者和HC减低,同时STAT3和STAT5的磷酸化作用增强。本研究结果显示,与HC比较,BD -A、BD -R组pSTAT3、STAT3蛋白质水平均升高;BD活动性增加,pSTAT3和STAT3蛋白质水平均增加;磷酸化作用被抑制时总体STAT3和pSTAT3蛋白质水平均减少;且BD -A患者的pSTAT3和STAT3蛋白质水平显著高于BD -R组。研究结果说明,STAT3通路在BD中激活且与BD活动性相关。

A:pSTAT3 and STAT3 expression analyzed by flow cytometry;B:Relative protein expression of pSTAT3;C:Relative protein expression of STAT3.HC:Health control;BD -R:BD -remission;BD -A:BD -active.(1)P<0.01.
图1pSTAT3和STAT3在3组的空白对照亚组和Stattic抑制剂亚组PBMC细胞内蛋白质水平流式细胞术检测结果
Fig1pSTAT3andSTAT3proteinexpressionlevelsinPBMCoftheblankcontrolsubgroupandtheStatticsubgroupfromthethreegroupsbyflowcytometry
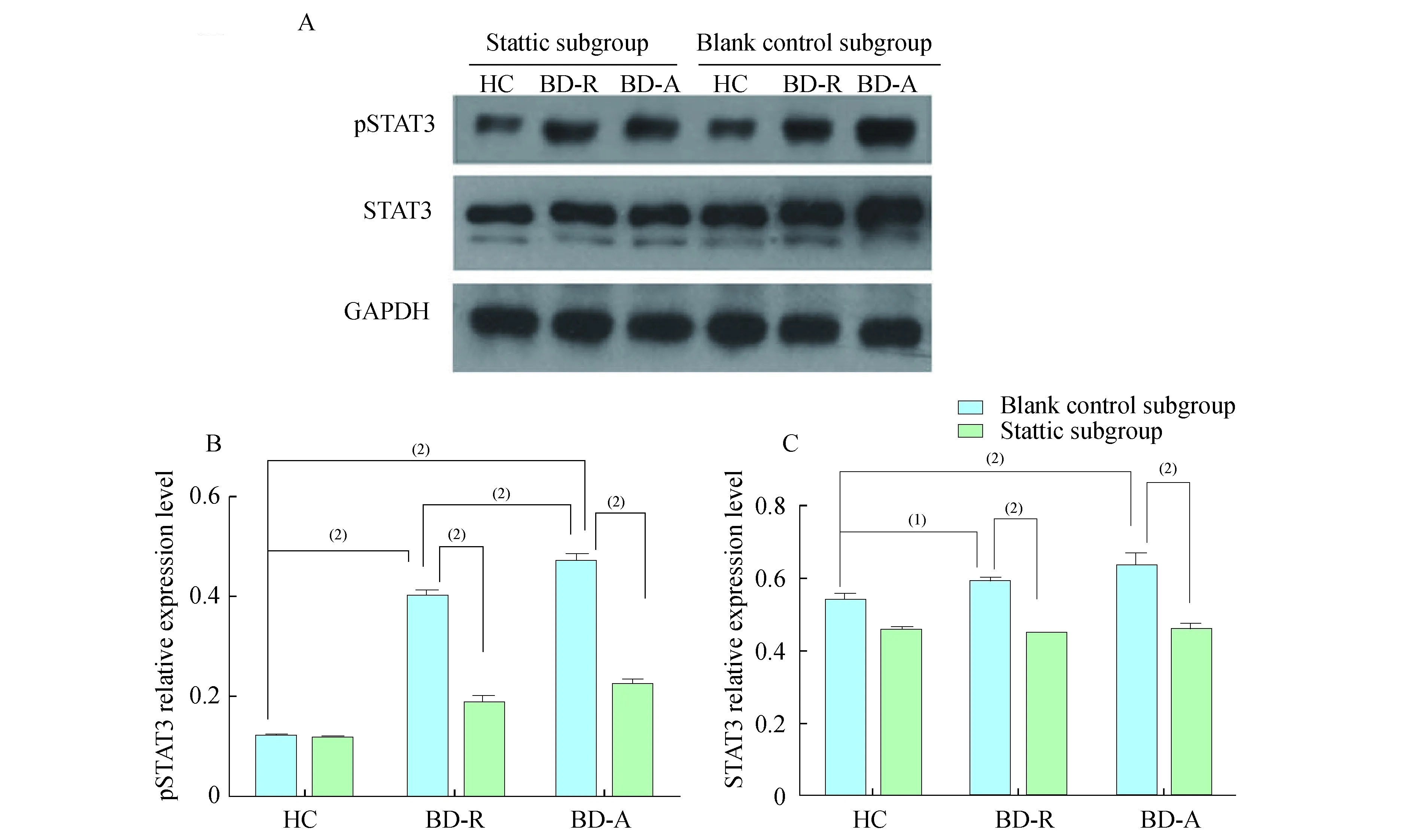
A:The protein bands of pSTAT3 and STAT3;B:Relative protein expression of pSTAT3;C:Relative protein expression of STAT3.HC:Health control; BD -R:BD -remission; BD -A:BD -active.(1)P<0.05,(2)P<0.01.
图2pSTAT3和STAT3在3组的空白对照亚组和Stattic抑制剂亚组PBMC细胞内蛋白质水平Westernblot检测结果
Fig2pSTAT3andSTAT3proteinexpressionlevelsinPBMCoftheblankcontrolsubgroupandtheStatticsubgroupfromthethreegroupsbyWesternblot
JAK/STAT 通路对Th1和Th17细胞分化具有重要作用[4-7]。而既往研究提示Th1和Th17细胞在BD中表达均增强,并与BD疾病发生与活动性相关[7,9,18-20],且Th1和Th17相关细胞因子如IL-17、IL-23和TNF-a在BD发病机理中起关键作用[9,21-22]。Tulunay等[7]发现,STAT3信号通路在BD中的激活可能是通过上调Th1 / Th17相关细胞因子(如IFN-γ、IL-6、IL-17 和IL-23)的水平。IFN-γ是经典的Th1类细胞因子。Zhou等[9]研究表明,BD葡萄膜炎患者房水中的IFN-γ水平显著高于白内障等疾病引起的葡萄膜炎患者。IL-17是Th17细胞最具代表性的细胞因子,在BD-A患者血清中显著升高,可通过诱发T细胞黏附而导致炎症反应和组织损伤[10]。TNF-a主要由Th1细胞和巨噬细胞产生,通过诱导促炎因子和黏附分子表达而导致局部炎症,且TNF-a升高与BD活动性相关。近年来,TNF-α抑制剂已应用于难治性BD的临床治疗[22]。本研究中,BD-A和BD-R组TNF-α、IFN-γ、IL-17蛋白质和mRNA水平均高于HC;Stattic抑制剂则下调TNF-α、IFN-γ和IL-17水平。其中BD-A组TNF-α和IFN-γ水平在空白对照亚组显著高于BD-R组,抑制STAT3磷酸化后与BD-R组相比差异无统计学意义;IL-17蛋白质则在空白对照亚组中差异无统计学意义,而Stattic抑制亚组中BD-A组显著高于BD-R组。IFN-γ是经典的Th1类细胞因子,TNF-a主要由Th1细胞和巨噬细胞产生;IL-17是Th17细胞相关细胞因子。由此,STAT3通路激活时Th1细胞相关细胞因子在BD-A组中水平较BD-R组高;STAT3通路抑制后,Th17细胞相关细胞因子在BD-A组中水平高于BD-R组。本文结果提示,STAT3磷酸化可能对Th1和Th17细胞活化均有促进作用,且对Th1细胞活化影响较大。抑制STAT3磷酸化可降低BD患者Th1、Th17相关细胞因子水平,STAT3通路激活可能介导BD患者Th1、Th17活化且与BD活动性相关。由此推测,抑制BD患者STAT3磷酸化可延缓BD进程,改善患者症状。
抑制IL-6、JAK等上游信号通路、干扰STAT3二聚体形成、阻碍STAT3核内转移、干扰STAT3对靶基因启动子结合均能有效抑制STAT3的转录活性[23]。JAK3抑制剂托法替布(Tofacitinib)为STAT3信号通路的间接抑制剂[24],目前,托法替布已用于类风湿关节炎和炎症性肠病的治疗,并在2015年首次纳入美国风湿协会类风湿关节炎治疗指南[25]。推测以托法替布为代表的STAT3通路间接抑制剂可应用于BD治疗。本研究提示,STAT3通路激活介导BD患者TH1、TH17活化且与BD活动性相关,STAT3磷酸化有望成为BD治疗研究新靶点。
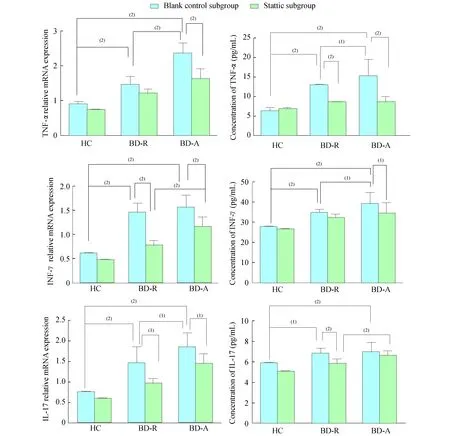
HC:Health control;BD -R:BD -remission;BD -A:BD -active.(1)P<0.05,(2)P<0.01.
图3TNF-α、IFN-γ、IL-17蛋白质和mRNA水平在3组的空白对照亚组和Stattic抑制剂亚组PBMC细胞内的表达
Fig3TNF-α,IFN-γandIL-17proteinandmRNArelativeexpressionlevelsinPBMCoftheblankcontrolsubgroupandtheStatticsubgroupfromthethreegroups
[1]HAMEDI M,BERGMEIER LA,HAGI-PAVLI E,etal.Differential expression of suppressor of cytokine signalling proteins in Behcet’s disease[J].ScandJImmunol,2014,80(5):369-376.
[2]CANSU DÜ,KASIFOGLU T,KORKMAZ C.Do clinical findings of Bahcet’s disease vary by gender?A single-center experience from 329 patients[J].EurJRheumatol,2016,3(4):157-160.
[3]BALTA I,AKBAY G,KALKAN G,etal.Demographic and clinical features of 521 Turkish patients with Bahcet’s disease[J].IntJDermatol,2014,53(5):564-569.
[4]HU K,HOU S,JIANG Z,etal.JAK2 and STAT3 polymorphisms in a Han Chinese population with Behcet’s disease[J].InvestOphthalmolVisSci,2012,53(1):538-541.
[5]MATHUR AN,CHANG HC,ZISOULIS DG,etal.Stat3 and Stat4 direct development of IL-17-secreting Th cells[J].JImmunol, 2007,178(8):4901-4907.
[6]SHIM J,BYUN HO,LEE YD,etal.Interleukin-6 small interfering RNA improved the herpes simplex virus-induced systemic inflammationinvivoBehcet’s disease-like mouse model[J].GeneTher,2009,16(3):415-425.
[7]TULUNAY A,DOZMOROV MG,TURE-OZDEMIR F,etal.Activation of the JAK/STAT pathway in Behcet’s disease[J].GenesImmun,2015,16(2):170-175.
[8]PINETON DE CHAMBRUN M,WECHSLER B,GERI G,etal.New insights into the pathogenesis of Behcet’s disease[J].AutoimmunRev, 2012,11(10):687-698.
[9]ZHOU ZY,CHEN SL,SHEN N,etal.Cytokines and Behcet’s disease[J].AutoimmunRev,2012,11(10):699-704.
[10]HAMZAOUI K,BOUALI E,GHORBEL I,etal.Expression of Th-17 and RORγt mRNA in Behcet’s disease[J].MedSciMonit,2011,17(4):CR227-CR234.
[11]O′SHEA JJ,HOLLAND SM,STAUDT LM.JAKs and STATs inimmunity,immunodeficiency,and cancer[J].NEnglJMed,2013,368(2):161-170.
[12]SCUTO A,KUJAWSKI M,KOWOLIK C,etal.STAT3 inhibition is a therapeutic strategy for ABC-like diffuse large B-cell lymphoma[J].CancerRes, 2011,71(9):3182-3188.
[13]FUKUDA S,ABEMATSU M,MORI H,etal.Potentiation of astrogliogenesis by STAT3-mediated activation of bone morphogenetic protein-Smad signaling in neural stem cells[J].MolCellBiol,2007,27(13):4931-4937.
[14]IHLE JN.Cytokine receptor signalling[J].Nature,1995,377(6550):591-594.
[15]UEHARA Y,MOCHIZUKI M,MATSUNO K,etal.Novel high-throughput screening system for identifying STAT3-SH2 antagonists[J].BiochemBiophysResCommun, 2009,380(3):627-631.
[16]SCHUST J,SPERL B,HOLLIS A,etal.Stattic:a small-molecule inhibitor of STAT3 activation and dimerization[J].ChemBiol,2006,13(11):1235-1242.
[17]WANG C,YE Z,KIJLSTRA A,etal.Decreased expression of the aryl hydrocarbon receptor in ocular Behcet’s disease[J].MediatorsInflamm, 2014,2014:195094.
[18]WU L,WEN H,ZHOU Y,etal.Activation of the liver X receptor inhibits Th17 and Th1 responses in Behcet’s disease and Vogt-Koyanagi-Harada disease[J].CurrMolMed,2014,14(6):712-722.
[19]SHIMIZU J,TAKAI K,FUJIWARA N,etal.Excessive CD4+ T cells co-expressing interleukin-17 and interferon-γ in patients with Behcet’s disease[J].ClinExpImmunol,2012,168(1):68-74.
[20]YE Z,WANG C,KIJLSTRA A,etal.A possible role for interleukin 37 in the pathogenesis of Behcet’s disease[J].CurrMolMed,2014,14(4):535-542.
[21]JIANG Z,HENNEIN L,TAO Y,etal.Interleukin-23 receptor gene polymorphism may enhance expression of the IL-23 receptor,IL-17,TNF-α and IL-6 in Behcet’s disease[J].PLoSOne,2015,10(7):e0134632.
[22]DEUTER CM,KÖTTER I,WALLACE GR,etal.Behcet’s disease:ocular effects and treatment[J].ProgRetinEyeRes,2008,27(1):111-136.
[23]FURTEK SL,BACKOS DS,MATHESON CJ,etal.Strategies and approaches of targeting STAT3 for cancer treatment[J].ACSChemlBiol,2016,11(2):308-318.
[24]SMOLEN JS,ALETAHA D,GRUBEN D,etal.Brief report:remission rates with tofacitinib treatment in rheumatoid arthritis:a comparison of various remission criteria[J].ArthritisRheumatol,2017,69(4):728-734.
[25]SINGH JA,SAAG KG,BRIDGES SL,etal.2015 American college of rheumatology guideline for the treatment of rheumatoid arthritis[J].ArthritisRheumatol,2016,68(1):1-26.

