大鼠肾系膜细胞饰胶蛋白聚糖乙酰化可增强其蛋白质稳定性和功能
李元臣 徐玉音 刘 曦 丁心怡 吴慧娟,3 张志刚,3
(1复旦大学基础医学院病理学系 上海 200032; 2复旦大学上海医学院2008级临床医学八年制 上海 200032;3上海市肾脏疾病与血液净化重点实验室 上海 200032)
乙酰化作为蛋白质翻译后修饰的一种方式,在参与染色体结构、DNA损伤修复、维持蛋白质的稳定,以及在蛋白质相互作用中具有十分重要的功能[1-3]。其主要修饰形式是在乙酰基转移酶的作用下将乙酰基添加到蛋白质分子中赖氨酸残基的ε-NH2上。研究显示,由于同样作用于蛋白质的赖氨酸,乙酰化还与蛋白质泛素化修饰有交叉作用或竞争作用,从而影响蛋白质的代谢和活性[4]。如在信号分子Smad7乙酰化研究中发现,Smad7 的K64和K70位点的赖氨酸发生乙酰化后,可阻断Smad7 的泛素化降解,并影响smad7 的作用[5]。
饰胶蛋白聚糖(decorin,DCN)是一类相对分子质量较小的蛋白聚糖,广泛分布于细胞外基质中[6]。研究发现DCN参与多种细胞生长调控过程,DCN的高表达可以抑制肿瘤细胞生长,促进肿瘤细胞凋亡、抑制肿瘤血管生成等[7]。在肾脏疾病研究中发现,DCN是肾系膜细胞 (mesangial cell,MsC) 分泌的重要分子,可以通过拮抗转化生长因子-β1 (transforming growth factor-β1,TGF-β1)的作用,抑制肾MsC生长和基质合成[8]。动物试验证明,肾动脉注射外源性DCN可拮抗大鼠抗Thyl.1肾炎模型中的病变,抑制MsC增生及肾小球纤维化的程度和进展[9],提示DCN是重要的抗肾炎因子。
本实验室前期研究发现肾系膜细胞DCN可通过泛素化修饰,并经蛋白酶体(proteasome)途径降解[10]。此外,Lundby等[11]在研究细胞中蛋白质的乙酰化修饰位点时发现,在DCN中存在着潜在的乙酰化修饰位点。然而迄今为止尚未有实验报道DCN乙酰化修饰。本文研究了大鼠肾系膜细胞DCN的乙酰化修饰及其对MsC生物学功能的影响。通过免疫共沉淀等实验发现,在肾MsC中存在DCN乙酰化修饰,且DCN的乙酰化修饰可抑制DCN泛素化降解,促进了DCN蛋白质的稳定。增强DCN的乙酰化修饰可促进TGF-β1以及Ⅳ型胶原的下调,同时抑制肾MsC的生长。上述结果表明,系膜细胞DCN乙酰化修饰可增强DCN抗肾炎的作用。
材 料 和 方 法
抗体试剂鼠抗DCN单抗(美国R&D公司);p300抗体(美国Abcom公司);兔抗乙酰化多克隆抗体、鼠抗ubiquitin抗体(缩写为抗Ubi,下文同)、鼠抗β-actin单抗,去乙酰化酶抑制剂(trichostatin A,TSA;nicotinamide,NAM)以及蛋白酶体阻断剂MG-132 (美国Sigma-Aldrich公司);DCN-siRNA由上海拓然生物科技有限公司合成;放线菌酮(cycloheximide,CHX)购于上海生工公司,PCR引物由苏州金唯致生物科技有限公司合成;免疫共沉淀试剂盒Protein-A Sepharose CL-4B购自美国Amersham Biosciences公司。
正常MsC培养体外培养的大鼠肾MsC为本实验室分离保存,实验用细胞为6~15代。细胞贴壁生长,采用含10% 小牛血清的DMEM 培养基,37 ℃、5%CO2、95% 空气饱和湿度培养箱培养,适时传代。
免疫共沉淀上述细胞抽提蛋白质。细胞蛋白质提取液中分别加入1 mg 抗DCN 抗体、抗乙酰化蛋白质抗体、抗Ubi,4 ℃摇床过夜孵育,次日于蛋白质提取液与抗体混合物中加入30 μL Protein-A Sepharose CL-4B (按试剂盒说明操作),4 ℃摇床继续孵育2 h,TBS清洗珠子5次,清洗后的珠子最后加入60 μL的TBS进行重悬,加入6×SDS 加样缓冲液煮沸5 min,使蛋白质变性并从珠子上脱落下来,取上清进行Western blot,检测目标蛋白之间是否存在着相互结合的作用。
Westernblot收集及裂解细胞后,离心提取细胞总蛋白。蛋白收集后经BCA方法进行定量,每组取约70 μg蛋白,煮沸变性。经8%SDS-PAGE分离,并电转到PVDF膜,含5%脱脂奶粉的PBS封闭30 min,加相应一抗4 ℃摇床过夜孵育。第二天加入HRP标记的二抗,再由ECL 化学发光法进行检测,以β-actin 为内参进行分析。为检测经去乙酰基酶抑制剂NAM+TSA处理后,MsC 内DCN 半衰期的改变检测,采用Time-course Western blot法,采用10 μg/L蛋白质合成抑制剂( CHX) 处理MC后,分别于0、6、12、24 和48 h 终止培养并提取细胞总蛋白,其余步骤同Western blot。
总RNA提取和RT-PCR总RNA 提取按照Trizol 试剂盒说明书进行。逆转录反应为25 μL 反应体系,包含2 μg的总RNA,1 μL M-MLV (200 U/μL)逆转录酶和3 μL Oligo ( dT)18(100 μg/μL)。PCR条件为95 ℃变性12 min,95 ℃变性30个循环45 s,56 ℃( DCN) 和58 ℃ ( β-actin) 退火30 s,72 ℃延伸40 s,72 ℃延伸10 min。取PCR产物5 μL,进行1% 琼脂糖凝胶电泳。DCN PCR引物如下:5′-TGGCAGTCTGGCTAATGT-3′ 和5′-ACTCAC-GGCAGTGTAGGA-3′;β-actin引物:5′-AGGA-TGCAGAAGGAGATTACTGC-3′ 和5′-AAAAC-GCAGCTCAGTAACAGTGC-3′。DCN和β-actin的PCR产物大小分别为199和220 bp。
流式细胞仪分析收集细胞,并用预冷的PBS洗2遍后转移至EP管中,清洗后的细胞用预冷的柠檬酸钠固定液重悬,混匀后-20 ℃过夜固定细胞。第2天将固定过的细胞经1 700 r/min (离心半径r=8 cm)离心12 min后,缓慢吸出柠檬酸钠,保留细胞沉淀并用PBS清洗细胞2次,清洗后保留约100 μL的细胞悬液体系。于细胞悬液中加入约20 μL RNase酶,37 ℃水浴1~1.5 h后,加入100 μL稀释好的1×PI染液,避光染核30 min,染核后,2 h内进行流式细胞术检测,每个样本分析10 000个核,并分析每个样本中G0/G1期、S期、G2/M期细胞的数目,计算出细胞在各时期所占百分比,并对细胞周期进行分析。

结 果
肾MsC中DCN的泛素化修饰应用免疫共沉淀检测MsC中泛素与DCN的结合情况,正常MsC总蛋白经用DCN单抗免疫沉淀,Ubi单抗检测,结果如图1A所示,实验组1在130 000位置及以上出现间断性蛋白质拖带,提示为泛素化DCN的条带,下图用DCN抗体证实DCN被抗体沉淀。反向,MsC总蛋白IP利用Ubi单抗免疫沉淀,IB用DCN单抗检测,如图1B所示,在130 000也可见泛素化DCN的条带,表明DCN经泛素化修饰调节。
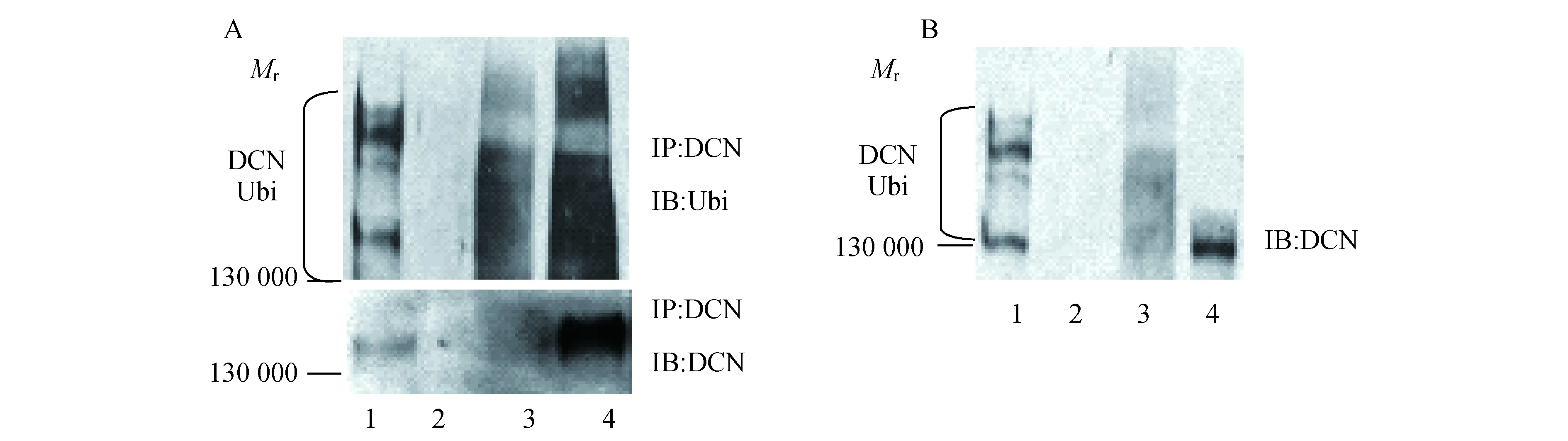
A:1,Test group,there is intermittent smearing bands in about 130 000;2,IgG antibody negative control group;3,IP:DCN supernatant control group;4,Normal MsC total protein (Western blot) positive control group.B:1,Test group,a band in 130 000 appeared too;2,IgG antibody negative control group;3,IP:Ubi supernatant control group;4,Normal MsC total protein (Western blot) positive control group.Ubi:Ubiquitin.
图1免疫共沉淀检测DCN泛素化
Fig1DCNubiquitinationdetectedbyimmunoprecipitation
DCN乙酰化修饰为了验证大鼠肾MsC内的DCN是否存在乙酰化,我们应用DCN抗体进行免疫共沉淀,再用抗乙酰化抗体和抗DCN抗体电泳进行分析。结果表明:实验组正常MsC在130 000位置可以检测到乙酰化修饰的DCN表达(图2);MsC经用去乙酰基酶抑制剂NAM和TSA处理后,乙酰化修饰的DCN表达量有明显的上调(图2A)。同时,再通过反向免疫沉淀来进行验证,结果显示,正常MsC与用去乙酰基酶抑制剂NAM和TSA处理后,细胞的提取蛋白质经乙酰化抗体免疫共沉淀后,通过使用DCN的抗体也可以明显检测到DCN的表达(图2B)。表明大鼠肾MsC DCN存在乙酰化修饰。
P300质粒转染肾MsC促进DCN乙酰化P300是组蛋白乙酰转移酶,可促进组蛋白和非组蛋白的乙酰化,从而在多种细胞生命活动中起重要作用[12]。为观察P300促进DCN乙酰化作用后的改变,我们采用脂质体转染重组P300质粒到MsC中过表达,增强细胞蛋白质的乙酰化程度。结果显示,在P300质粒转染肾MsC后,P300蛋白表达增强(图3A)。同时,与对照组相比,DCN的水平也增加(图3 B),提示增强乙酰化修饰可以促进 DCN的稳定性,减少降解。
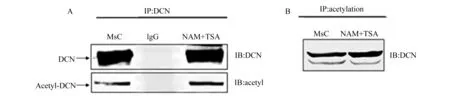
A:IP,DCN;IB,anti-DCN and anti-acetyl antibody;MsC,normal mesangial cell;IgG,Negative control;NAM+TSA,MsC treated with NAM+TSA.B:IP,anti-acetyl;IB,anti-DCN .
图2免疫共沉淀检测MsC中DCN乙酰化修饰
Fig2AcetylationofDCNdetectedbyimmunoprecipitationinmesangialcell

A:The P300 protein level increased in MsC/P300 cell which was transfected by P300 plasmid.B:Acetylation of DCN was increased in MsC/P300 cell which was transfected by P300 plasmid.C:Statistichistogram of the acetyl-DCN expression in MsC and MsC/P300 cells of Fig3 B.MsC:Normal MsC group;MsC/P300:MsC transfected by P300.
图3P300质粒转染后DCN的乙酰化检测
Fig3AcetylationofDCNwasdetectedinmesangialcellstransfectedbyP300plasmid
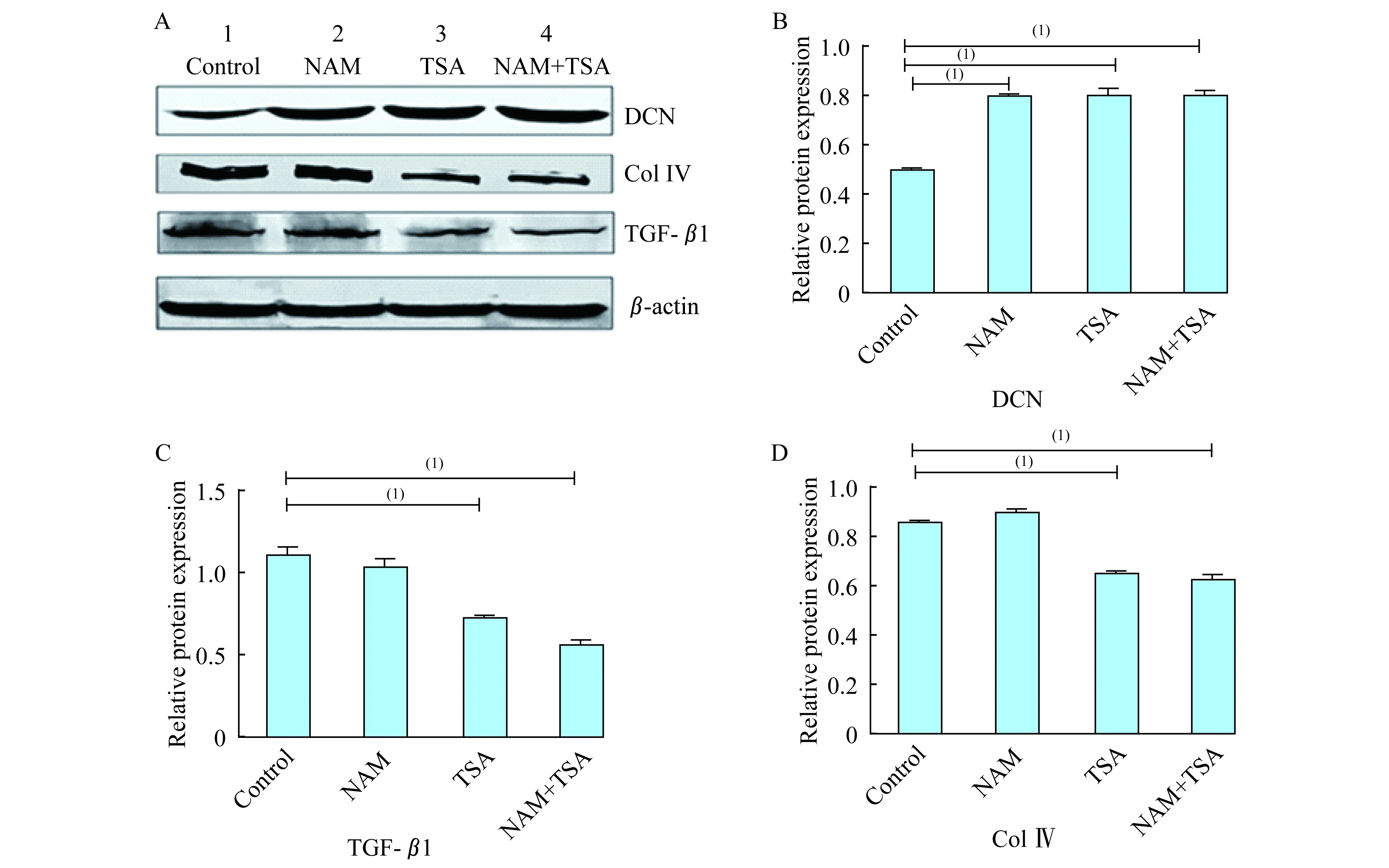
去乙酰基酶抑制剂促进了DCN蛋白质的稳定进一步采用去乙酰基酶抑制剂NAM和TSA处理,发现也可促进蛋白质的乙酰化修饰,因二者抑制去乙酰基酶的途径不同,实验使用NAM和TSA分别处理大鼠肾MsC。通过Western blot检测DCN蛋白质的表达变化。实验结果如图4所示,与对照组相比,NAM和TSA单独处理均可以增加DCN的蛋白质水平,且DCN的蛋白质水平在NAM处理4 h后显著高于8 h,而TSA单独处理细胞后DCN蛋白质水平在12 h达到最大值。该结果表明NAM和TSA均可促进DCN乙酰化修饰和蛋白质的稳定(图4A)。同时应用蛋白酶体抑制剂处理后显示DCN水平升高(图4B),提示乙酰化作用与MG132的作用有一致性。但两者作用机制不同,表明DCN的乙酰化可能抑制了DCN的泛素化降解过程,而达到稳定性提高。
去乙酰基酶抑制剂延长DCN的半衰期为了进一步证明DCN的乙酰化可以抑制其蛋白的降解,促进其蛋白质稳定性,我们检测了DCN的半衰期,比较增强DCN乙酰化后的降解速度。实验结果如图5所示,在蛋白质合成抑制剂CHX处理后,正常对照组中DCN在180 min衰减至半数水平,但经NAM+TSA处理后,DCN蛋白的降解速度明显减慢,半衰期显著延长。结果表明DCN的乙酰化修饰减慢了DCN蛋白降解的速度,延长了DCN的半衰期,促进了DCN的蛋白稳定性。

A:Detection of the DCN protein levelin mesangial cells treated with TSA and NAM at different times.B:Detection of the DCN protein level in mesangial cells treated with TSA+NAM and MG 132.(1)P<0.01.
图4去乙酰化酶抑制剂或MG132处理MsC后DCN蛋白的表达
Fig4DetectiontheDCNproteinlevelinmesangialcellstreatedwithdeacetylaseinhibitororMG132

A:The mesingial cells was treated by CHX for stopping protein synthesis,then the expression of DCN was determined in mesangial cells treated with or without TSA+NAM (reference:β-actin).B:The degradation rate of DCN protein in mesangial cells treated with or without TSA+NAM showed by statistic histogram.
图5DCN蛋白质乙酰化抑制了其蛋白质的降解速度
Fig5DCNacetylationinhibitedthedegradationrateofDCNprotein
去乙酰基酶抑制剂不影响DCN的转录水平为了明确DCN蛋白质水平的升高是由DCN蛋白质翻译后修饰调节所造成,而不是由转录水平提高引起,我们使用RT-PCR检测对照组、NAM处理组、TSA处理组和NAM+TSA处理组中DCN的转录水平。结果表明,各组之间DCN的转录水平差异无统计学意义(图6)。该结果表明NAM和TSA处理没有影响DCN的转录水平,其所引起的DCN蛋白质水平的升高,是通过转录后的调节改变所引起。
DCN乙酰化下调MsC中TGF-β1和Ⅳ型胶原表达本课题组前期实验表明DCN过表达可以明显抑制TGF-β1和Ⅳ型胶原的表达。为了验证DCN的乙酰化修饰对其蛋白质活性的影响,实验检
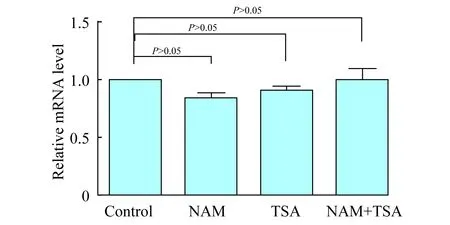
图6 NAM和TSA处理后MsCDCN的mRNA水平检测Fig 6 Detection of DCN mRNA level in mesangialcells treated by NAM and TSA
测了NAM和TSA处理MsC后,TGF-β1以及Ⅳ型胶原的表达情况。结果表明,与对照组相比,在NAM和TSA刺激组中,DCN的蛋白质水平有明显的上调,同时TGF-β1以及Ⅳ型胶原的表达也有明显下降(图7)。该结果表明乙酰化修饰不仅稳定MsC的DCN蛋白质,也增强DCN对TGF-β1以及Ⅳ型胶原表达的调控。
DCN的乙酰化修饰抑制肾MsC的增殖为进一步检测DCN的乙酰化修饰是否对大鼠肾MsC的生长产生影响,我们通过NAM或TSA单独处理细胞后,用流式细胞仪技术检测大鼠肾MsC的细胞周期变化情况。实验结果如图8A所示,与对照组相比,在NAM或TSA处理组中,细胞停滞在G1期的比例明显增加,G2/M期比例明显减少(表1)。结果表明DCN的乙酰化修饰不仅抑制DCN泛素化降解,还保持了DCN抑制肾MsC生长的作用。同时,为确定影响MsC 生长受DCN调节的特异性,我们进一步用DCN-siRNA 敲低细胞的DCN表达(图8 B),则MsC的生长重新加快,G2/M期比例发现开始增加(表2)。进一步证实上述增强乙酰化导致MsC生长抑制是增强了DCN的作用所致。
A:Western blot detected the proteinlevels of TGF-β1 and type IV collagen in mesangial cells treated by NAM and TSA.B:Statistical graph showed DCN level increasing in NAM and TSA group.C:Statistical graph showed TGF-β1 level decreasing in NAM and TSA group.D:Statistical graph showed Type IV collagen level decreasing in NAM and TSA group.(1)P<0.01.
图7DCN的乙酰化修饰对TGF-β1以及Ⅳ型胶原表达的影响
Fig7TheeffectofDCNacetylationontheexpressionofTGF-β1andtypeⅣcollagen


GroupG0/G1G2/MControl54.86±1.7945.14±2.68NAM62.31±0.6037.69±5.07(1)TSA61.98±1.74(1)39.02±9.31(1)
vs.control group,(1)P<0.05.

A:Flow cytometry detected the cell cycle of mesangial cells treated by NAM and TSA.B:The detection of DCN expression in MsC after being transfected by DCN-siRNA.
图8DCN的乙酰化抑制肾MsC的增殖
Fig8TheacetylationofDCNinhibitstheproliferationofMsC


GroupG0/G1G2/MMsC70.33±3.1529.67±1.63MsC/DCN-siRNA67.43±4.2732.57±3.29(1)
vs.normal control,(1)P<0.05.
讨 论
蛋白质的功能不仅由其基因水平决定,蛋白质翻译后的修饰对其也具有十分重要的调节作用[1,4]。本实验前期研究发现在大鼠肾MsC质中DCN可被泛素化修饰并通过蛋白酶体途径降解[10]。Lundby等[11]在蛋白质乙酰化调节位点的研究中发现,蛋白质质谱学证实了DCN蛋白质存在多个乙酰化修饰位点。但有关DCN的乙酰化还未见报道。已知泛素化以及乙酰化修饰都发生在赖氨酸的残基上,特别在某些蛋白质的K64位和K70位赖氨酸残基是结合泛素分子的重要位点,也是容易被乙酰化的部位。因此,同一蛋白质的乙酰化和泛素化修饰之间存在着一定的竞争关系[5,13]。乙酰化修饰常可引起靶蛋白泛素化作用抑制,使底物蛋白减少降解,如Smad7乙酰化可阻断Smad7 的泛素化降解[5]。如果增强蛋白质泛素化调节,也会影响乙酰化的作用,已知p53主要通过乙酰化进行调节,而近来研究发现,通过增强p53泛素连接酶Mdm2的表达,可促进p53泛素化,抑制p53 的乙酰化修饰[13]。类似现象出现在许多蛋白质分子调节作用中,如Runx3[14]、p73[15]等。因此我们假设MsC中泛素化的DCN可能也存在着乙酰化,并与 DCN泛素化之间存在竞争调节,从而影响MsC的生物学表型的调节。
为了进一步验证在大鼠肾MsC中DCN是否也受到乙酰化调控,本研究通过免疫共沉淀、Western blot等实验,对细胞中乙酰化的DCN进行检测。正常时,MsC分泌的DCN水平较低,在炎症或纤维组织增生的条件下DCN分泌增多,并很快与基质中的胶原成分结合沉积。为了避免大鼠肾MsC中DCN乙酰化水平过低而不能被抗体很好检测到,实验中还通过添加去乙酰基酶抑制剂NAM和TSA来促进细胞中蛋白的乙酰化水平。结果显示在大鼠肾MsC中存在着乙酰化修饰的DCN,且去乙酰基酶抑制剂可促进DCN的乙酰化修饰,此外,DCN的乙酰化修饰抑制了DCN在细胞中的降解速度,增强了DCN在细胞中的稳定。
DCN因其分子结构与TGF-β1相似,可以竞争结合TGF-β1受体,从而拮抗TGF-β1的刺激作用,抑制大鼠肾MsC生长和基质合成[16]。同时有报道显示在人肾小球MsC中过表达外源性的DCN,可下调TGF-β1和Ⅳ型胶原及纤连蛋白在转录水平的表达[17]。本研究发现,NAM和TSA可促进DCN的乙酰化修饰,同时下调TGF-β1和Ⅳ型胶原的表达。该结果表明DCN的乙酰化修饰不仅可抑制DCN的降解代谢,而且可增强DCN的功能,从而影响MsC的基质合成等功能。
Isaka等[18]曾经用病毒载体将DCN质粒注入大鼠的大腿肌肉中,使血液DCN含量增加,从而抑制了大鼠肾炎MsC增生及肾炎病理改变。本课题组也曾报道,肾脏MsC中过量表达DCN蛋白质时可以抑制肾脏MsC的生长,促进细胞的凋亡[19]。本文采用流式细胞术检测DCN的乙酰化对细胞周期的影响,结果显示DCN的乙酰化使大鼠肾MsC进入G1期的比例明显增多,G2/M期比例明显减少。而用DCN的RNA干扰减少DCN的表达,又可促进MsC的生长,表明增强DCN乙酰化可以通过竞争DCN的赖氨酸残基,减少蛋白质的泛素化调节和降解,从而促进DCN蛋白的稳定和活性,抑制MsC的生长,拮抗肾炎病变发展。该实验结果提示增强DCN乙酰化调节在防治MsC增生性肾炎的研究中可作为潜在的干扰靶点。
综上所述,DCN是一种重要的抗肾炎因子。本研究结果表明DCN的乙酰化可抑制DCN的泛素化降解,增进了DCN蛋白质的稳定和活性,在抑制MsC的基质合成及细胞增生的过程中发挥一定的作用。因此,研究DCN乙酰化对于更深入研究DCN的功能以及DCN在治疗肾病过程中的作用提供了新的思路。
[1]CHOUDHARY C,KUMAR C,GNAD F,etal.Lysine acetylation targets protein complexes and co-regulates major cellular functions[J].Science,2009,325(5942):834-840.
[2]ANSARI A,RAHMAN MSC,SAHA SK,etal.Function of the SIRT3 mitochondrial deacetylase in cellular physiology,cancer,and neurodegenerative disease[J].AgingCell,2017,16(1):4-16.
[3]SALMINEN A,KAUPPINEN A,KAARNIRANTA K.AMPK/Snf1 signaling regulates histone acetylation:impact on gene expression and epigenetic functions[J].CellSignal,2016,28(8):887-895.
[4]CARON C,BOYAULT C,KHOCHBIN S.Regulatory cross-talk between lysine acetylationand ubiquitination:role in the control of proteinstability[J].Bioessays, 2005,27(4):408-415.
[5]GRONROOS E,HELLMAN U,HELDIN CH,etal.Control of Smad7 stability by competition between acetylation and ubiquitination[J].MolCell,2002,10:483-493.
[6]冯秀艳,张志刚,郭慕依.饰胶蛋白聚糖的多种生理功能及其作用机制[J].国际病理科学与临床杂志,2005,25(5):434-437.
[7]AUGOFF K,GRABOWSKI K,RABCZYNSKI J,etal.Expression of decorin in esophageal cancer in relation to the expression of three iso for MsC of transforming growth factor-beta (TGF-beta1, -beta2,and -beta3) and matrix metalloproteinase-2 activity[J].CancerInvest, 2009,27(4):443-452.
[8]王慧君,张志刚,刘学光,等.饰胶蛋白聚糖基因转染对大鼠肾MsC生长及表型改变的影响[J].复旦学报(医学版),2003,30(2):414-417.
[9]WANG HJ,CHEN L,ZHANG ZG,etal.Exvivotransfer of the decorin gene into rat glomerulus via a mesangial cell vector suppressed extracellular matrix accumulation in experimental glomerulonephritis [J].ExperMolPathol,2005,78(1):17-24.
[10]WU HJ,JIANG WN,ZHANG Y,etal.Regulation of intracellular decorin via proteasome degradation in rat mesangial cells[J].JCellBiochem, 2010,111(4):1010-1019.
[11]LUNDBY A,LAGE K,WEINERT BT,etal.Proteomic analysis of lysine acetylation sites in rat tissues reveals organ specificity and subcellular patterns[J].CellRep,2012,2(2):419-431.
[12]常锐,谈娟,王荣敏,等.重组p300 组蛋白乙酰转移酶结构域的表达及应用[J].中国生物化学与分子生物学报,2011,27(5) :452 -458.
[13]LI M,LUO J,BROOKS CL,etal.Acetylation of p53 inhibits its ubiquitination by Mdm2[J].JBiolChem,2002,277(52):50607-50611.
[14]JIN YH,JEON EJ,LI QL,etal.Transforming growth factor-beta stimulates p300-dependent RUNX3 acetylation,which inhibits ubiquitination-mediated degradation[J].JBiolChem,2004,279(28):29409-29417.
[15]BERNASSOLA F,SALOMONI P,OBERST A,etal.Ubiquitin-dependent degradation of p73 is inhibited by PML[J].JExpMed,2004,199(11):1545-1557.
[16]COSTACURTA A,PRIANTE G,D′ANGELO A,etal.Decorin transfection in human mesangial cells downregulates genes playing a role in the progression of fibrosis[J].JClinLabAnal,2002,16(4):178-186.
[17]冯秀艳,张志刚,赵仲华,等.饰胶蛋白聚糖基因转染对大鼠肾MsC转化生长因子β I、II型受体表达及IV型胶原合成的影响[J].中华肾脏病杂志,2005,21(5):27-31.
[18]ISAKA Y,BREES DK,IKEGAYA K,etal.Gene therapy by skeletal muscle expression of decorin prevents fibrotic disease in rat kidney[J].NatMed,1996,2(4):418-423.
[19]WU HJ,WANG SX,XUE AM,etal.Over-expression of decorin induces apoptosis and down-regulates TGF-β1 of cultured rat mesangial cellsinvitro[J].JNephol, 2008,13(7):607-615.

