在Sox2阳性细胞敲除β-catenin对小鼠内耳发育和极性的影响
钱晓青 任冬冬 丛 宁 赵 萌 迟放鲁
(1 复旦大学附属眼耳鼻喉科医院耳鼻喉科研究院,2耳鼻喉科,5实验中心 上海 200031;3上海市听觉医学临床中心 上海 200031; 4卫生部听觉医学重点实验室 上海 200031)
耳蜗和前庭分别是重要的听觉和位觉平衡觉器官,它们具有感知机械作用的毛细胞,通过其表面的静纤毛束来探测声音和位置信号。在此过程中,规律的内耳毛细胞极性排列对于听力的传导和平衡的维持必不可少。在内耳发育过程中,经典的Wnt/β-catenin信号通路参与调控细胞增殖、分化等重要环节[1],对诱导Pax2阳性的耳基板细胞形成听囊至关重要[2],并可介导感觉区和非感觉区前庭器的形成[3]。有研究发现,Atoh1是Wnt信号通路的直接靶点[4],而Atoh1是已知的在毛细胞发育过程中不可或缺的基因,其缺失将造成耳蜗和前庭无法形成[5]。Lgr5是Wnt信号增强正反馈调节回路上的一员,标记内耳干细胞,研究发现Lgr5在调控毛细胞增殖和分化过程中具有重要作用[6-8]。
耳蜗Corti’s器包含1排内毛细胞和3排外毛细胞,毛细胞顶端具有呈V型阶梯状排列的静纤毛束和一根居于一侧的动纤毛,V型的顶点指向动纤毛侧,从而形成亚细胞平面极性,而极化细胞的规律排列则构成平面细胞极性(planar cell polarity,PCP)[9]。Wnt5a通过非经典Wnt/PCP信号通路调节耳蜗感觉上皮的PCP及汇聚伸展作用[10]。前庭除了具有PCP之外,还具有整体组织极性,表现为具有一条极性分界线(line of polarity reverse,LPR)穿囊斑而过,将囊斑分为动纤毛方向相反的两个区,椭圆囊斑的动纤毛朝向LPR,球囊斑的动纤毛背离LPR[11]。在毛细胞成熟过程中伴随LPR的形成,此过程可被Wnt抑制剂干扰[10,12],从而推断该过程受到Wnt信号通路调节。
β-catenin作为经典Wnt/β-catenin信号通路的重要组成蛋白,对内耳毛细胞的排列和极性发育具体作用目前尚不知晓。本实验中,我们构造了在内耳感觉上皮的前体细胞(Sox2阳性细胞)条件敲除β-catenin的小鼠动物模型,在体研究β-catenin缺失对内耳发育,尤其是对毛细胞的排列和极性的影响。
材 料 和 方 法
实验动物β-cateninflox(exon2-6)小鼠[13]由李华伟教授(复旦大学附属眼耳鼻喉科医院)惠赠,Sox2CreERT小鼠[14]由柴人杰教授(东南大学)惠赠,两种小鼠均为C57BL/6小鼠。将以上两种小鼠杂交得Sox2CreERTβ-cateninf/flox(exon2-6)双阳性小鼠[15],再将β-cateninf/flox(exon2-6)雌鼠与Sox2CreERTβ-cateninf/flox(exon2-6)雄鼠杂交,对孕鼠行他莫昔芬(40 mg/mL溶解于玉米油,美国Sigma公司)腹腔注射(0.1 mg/g),7天后麻醉孕鼠,取出胚胎,解剖得听泡、耳蜗和前庭组织,解剖方法已有详述[16-18]。基因型为Sox2CreERTβ-cateninf/flox(exon2-6)的小鼠作为实验组,无Cre表达的同窝小鼠作为对照组。本实验通过了复旦大学伦理审查委员会的伦理审查。
基因型鉴定取5 mm鼠尾,溶于150 μL的Direct PCR试剂、Proteinase K试剂(美国Viagen Biotech公司)混合液(50∶1),55 ℃ 金属浴(北京天根公司)加热过夜,次日85 ℃ 金属浴加热45 min后,12 500×g快速离心2 min,吸出上层清亮液体100 μL,即为提取的DNA。取2.5 μL DNA,行PCR扩增DNA,通过电泳凝胶成像检测DNA片段长度。β-cateninflox(exon2-6)引物为5’-AAGGTAGAG-TGATGAAAGTTGTT-3’,5’-CACCATGTCCT-CTGTCTATTC-3’;Cre引物为5’-TGCCACGAC-CAAGTGACAGCAATG-3’;5’-ACCAGAGACG-GAAATCCATCGCTC-3’。检测β-cateninflox(exon2-6)片段长度为300 bp,β-catenin为223 bp,Cre为300~400 bp(图1)。
免疫荧光染色Corti’s器、椭圆囊斑、球囊斑从小鼠取出后,立即用4%多聚甲醛(美国Sigma-Aldrich公司)室温固定30 min,0.1%Triton X-100(溶于PBS,美国Sigma-Aldrich公司)通透30 min后,用10%的驴血清(溶于0.1% Triton X-100,美国Merkmilli Pore公司)封闭1 h,然后加一抗4 ℃过夜。第2天用0.1%Triton X-100漂洗3~5 h后,加二抗,置于室温2 h后用0.1% Triton X-100漂洗1 h,最后封片。本实验中用到的一抗有:山羊来源的抗β-catenin抗体(1∶200,美国Sigma公司),Arl13B (1∶200,美国Emory大学陈平教授惠赠),鼠来源的抗β-spectrin抗体(1∶200,美国BD Biosciences公司)。用到的二抗有:驴抗山羊-647 (1∶1 000),驴抗兔-647 (1∶1 000),驴抗鼠-555 (1∶1 000)。绿色荧光偶联phalloidin (1∶1 000)用于肌动蛋白染色,以上试剂均购自美国Jackson ImmunoResearch公司。共聚焦扫描显微镜(Leica SP8)用于免疫荧光染色标本的扫描。
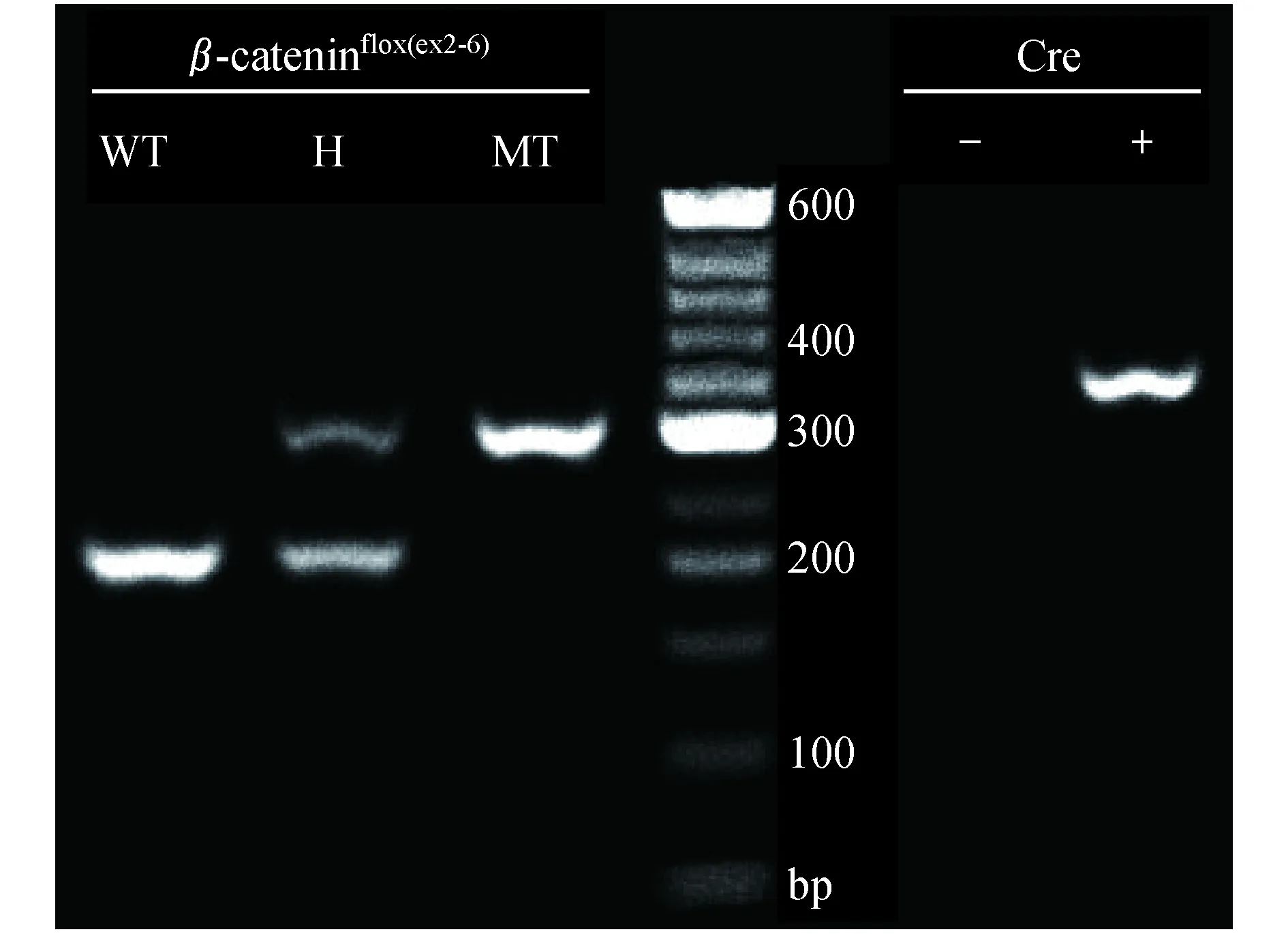
WT:Wild type;H:Heterozygous;MT:Mutant.
图1β-cateninflox(exon2-6)和CreDNA凝胶电泳图
Fig1β-cateninflox(exon2-6)andCreDNAgelelectrophoresis

结 果
β-catenin敲除影响内耳形态发育Atoh1作为经典Wnt/β-catenin通路的下游目的基因[4],在内耳毛细胞发育中不可或缺[18 - 22]。我们猜测经典Wnt/β-catenin信号通路对毛细胞发育极为关键。对怀有Sox2CreERTβ-cateninf/flox(exon2-6)胚胎的孕鼠行雌激素类似物他莫昔芬腹腔注射,至少2天后,激活的Cre重组酶切除2个LoxP位点之间的β-catenin外显子2-6,导致双阳性胚胎小鼠的Sox2阳性细胞的β-catenin基因被敲除[13]。取已激活Cre重组酶的Sox2CreERTβ-cateninf/flox(exon2-6)突变小鼠Corti’s器及前庭斑行β-catenin免疫荧光染色,在相同光强下行共聚焦显微镜扫描,因Sox2广泛分布,可观察到与对照组相比,β-catenin在Corti’s器和前庭的整个感觉上皮表达均明显下降,与对照组相同部位的细胞-细胞连接β-catenin染色在实验组中明显减弱(图2、3),验证了β-catenin基因在Sox2阳性细胞中被敲除。

The arrows in the boxes indicats the β-catenin-staining cell-cell connections.
图2对照组和β-catenin敲除组在Corti’s器的β-catenin免疫荧光染色
Fig2Theimmunofluorescencestainingofβ-cateninintheorganofCortiinthecontrolandtheβ-cateninknockoutgroup
前期研究发现,小鼠内耳的极性发育从胚胎13.5天(E13.5)开始[23]。我们在E11.5进行他莫昔芬诱导,48 h后即E13.5 Sox2阳性细胞的β-catenin被敲除,E18.5解剖胚胎小鼠,获取听泡。与对照组相比,实验组小鼠的听泡体积明显变小(图4)。为量化听泡体积,我们用Photoshop软件分别测量了对照组及实验组的听泡长径的相对长度(听泡顶端与底端连线,图4左图黄线),两者长径相对长度分别为732.16±3.31 (n=6)和675.09±7.78 (n=6),差异有统计学意义(图4,P<0.001)。进一步解剖听泡,得到耳蜗和前庭组织。从大体结构观察,在Sox2CreERTβ-cateninf/flox(exon2-6)小鼠中,Corti’s器明显变短、变小,前庭组织也整体变小(图5)。我们进一步定量测量解剖得到的Corti’s器相对长度以及椭圆囊斑、球囊斑相对面积,并将对照组与实验组数据进行了比较。测量得Corti’s器相对长度分别为1.79±0.04 (n=3)和1.57±0.08 (n=4),椭圆囊斑相对面积分别为39 615.67±1 808.66 (n=3)和33 371.72±679.64 (n=4),球囊斑相对面积分别为50 293.67±1 710.82 (n=3)和36 581.76±2 607.93 (n=4),差异均有统计学意义(图6,P<0.01、P<0.01、P<0.001),与定性观察结果一致。由此可见,在Sox2阳性细胞中敲除β-catenin对小鼠内耳的形态发育影响较大,β-catenin在内耳发育中具有重要作用。

SA:Saccule.The figures below are the amplified views of correspondent boxes above.
图3对照组和β-catenin敲除组球囊斑
β-catenin免疫荧光染色
Fig3TheImmunofluorescencestainingofβ-catenininthesaccularmaculaeinthecontrolandβ-cateninknockoutgroup
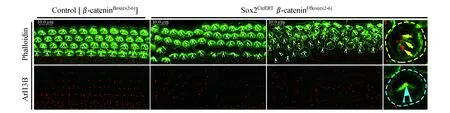
β-catenin敲除影响Corti’s器毛细胞的排列和极性E11.5注射他莫昔芬激活Cre重组酶,经极性蛋白染色我们发现,此时毛细胞发育尚在早期,许多极性蛋白尚未表达,无法观察极性情况。故我们推迟他莫昔芬注射时间至E15.5,48 h后即E17.5 Sox2阳性细胞中的β-catenin被敲除,此时细胞分化和极性建立尚未完全形成[23],以此进一步探究β-catenin敲除对Corti’s器以及前庭毛细胞极性形成的影响。我们取E15.5激活Cre重组酶、出生后2天(P2)解剖的小鼠Corti’s器,行Phalloidin染色。Phalloidin可以标记细胞骨架,同时可以染出毛细胞的表皮板和呈V型排列的静纤毛束。β-catenin突变小鼠Corti’s器Phalloidin染色显示出紊乱的毛细胞排列(图7),出现连续多个外毛细胞缺失(图7白色Δ标示),伴有或不伴有内毛细胞的插入(图7*标示)。中底圈毛细胞缺失或插入情况较多,但仍有清晰的内外毛细胞形态差异和两者的分界线。越接近顶圈,毛细胞排列越紊乱,甚至出现内外毛细胞混杂无法区分界限的情况(图7F)。值得一提的是,仍有部分区域,毛细胞排列较为规整,无毛细胞的缺失和插入(图7B)。毛细胞的极性方向通过标记静纤毛束的Phalloidin联合标记动纤毛的Arl13B来显示(图8白色箭头标示)。对照组毛细胞呈现出规律一致的V型静纤毛束和居于一侧的动纤毛(图8左),与此不同,β-catenin敲除小鼠的耳蜗毛细胞静纤毛束虽仍保持V型,但V型顶端朝向不再整齐划一。从底圈到顶圈,紊乱程度加强。在顶圈,我们观察到动纤毛出现在细胞中间(图8蓝色箭头指示居于表皮板中间位置的动纤毛);动纤毛数量也发生了变化,有些毛细胞具有2~3根动纤毛(图8黄色箭头指示单个毛细胞具有多根动纤毛)。由此可以发现β-catenin缺失干扰了Corti’s器毛细胞的排列和动、静纤毛的排布。
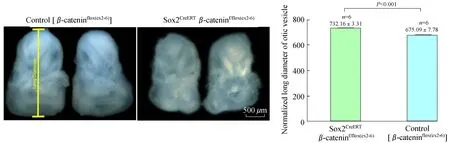
图4对照组和β-catenin敲除组的听泡长径比较
Fig4Thecomparisonofnormalizedlongdiameterofoticvesiclebetweenthecontrolandβ-cateninknockoutgroup

SA:Saccule;UT:Utricle;AC:Anterior cristae;LC:Lateral cristae;PC:Posterior cristae.
图5对照组和β-catenin敲除组的Corti’s器与前庭
Fig5ThevestibulesandCorti’softhecontrolandβ-cateninknockoutgroup
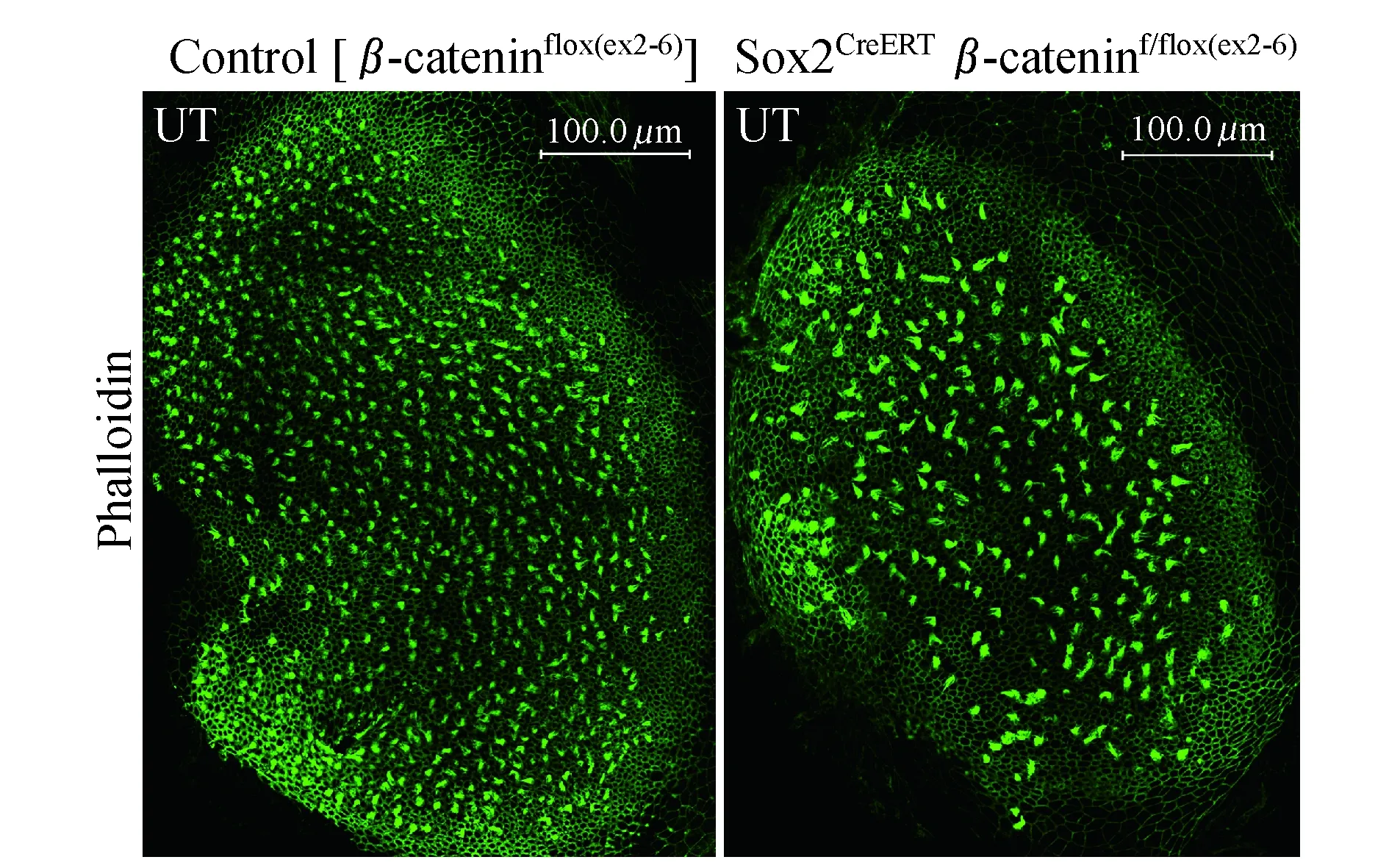
β-catenin敲除影响前庭毛细胞的数量和极性为了探讨β-catenin敲除对前庭毛细胞的数量和极性的影响,我们对E15.5行他莫昔芬诱导、P2解剖固定的小鼠椭圆囊斑进行了染色。Phalloidin染色后定性观察,可见椭圆囊毛细胞明显变稀疏(图9)。选取椭圆囊、球囊感觉上皮区100μm×100μm面积,统计其内毛细胞数。结果显示,对照组和实验组椭圆囊斑内毛细胞数分别为117.7±10.5(n=9)和101.4±10.3(n=14),球囊斑内毛细胞数分别为100.8±16.3 (n=6)和72.9±8.6 (n=9),Sox2CreERTβ-cateninf/flox (exon2-6)小鼠的椭圆囊和球囊毛细胞数均明显减少(图10,P<0.01、P<0.001)。毛细胞的静纤毛附着于表皮板上,动纤毛根部为基体,其所在处表皮板缺如。抗体β-spectrin可以染出毛细胞的表皮板,故在动纤毛根部染色呈空洞,我们用β-spectrin染出动纤毛所在的一侧来指示毛细胞的极性方向。已知椭圆囊斑和球囊斑各有1条LPR,其两侧毛细胞极性方向相反,椭圆囊斑毛细胞方向均指向LPR,球囊斑毛细胞则均背离LPR[11]。本实验中,与对照组一样,β-catenin敲除小鼠的椭圆囊斑和球囊斑仍均具有相对清晰的极性分界线,其两侧毛细胞指示方向大致正常(图11)。但值得注意的是,在椭圆囊,分界线两侧存在散在的毛细胞极性方向与其附近大多数毛细胞的极性方向相反。这种情况在突变小鼠的球囊也有出现。
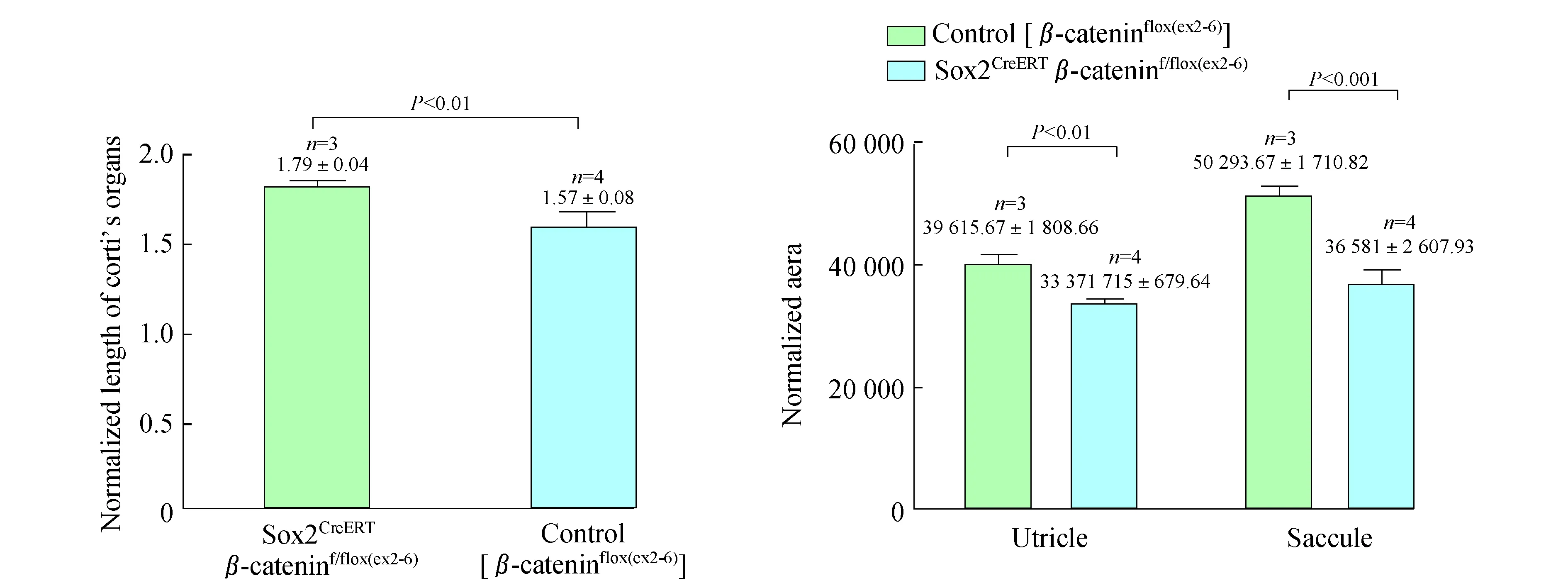
图6 对照组和β-catenin敲除组的Corti’s器长度、椭圆囊斑及球囊斑面积比较Fig 6 The comparison of normalized length of Corti’s organs area of utricular maculea and saccular maculeabetween the control and β-catenin knockout group
经典Wnt/β-catenin信号通路在调控细胞增生、定向、分化等步骤中具有重要作用[1]。Wnts是一种短距分泌糖肽,与frizzled受体相结合,通过激活细胞间的连锁瀑布反应来调控细胞生长、增殖以及细胞命运。β-catenin是经典Wnt信号通路的中介者,控制下游靶基因的表达。同时它也是一种结构蛋白,参与构成钙黏蛋白介导的细胞黏附连接及有丝分裂期的中心体[24]。
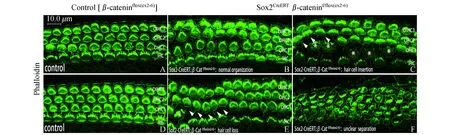
Δ:The missing outer HCs;*:The inserted inner HCs.
图7对照组和β-catenin敲除组的Corti’s器毛细胞排列
Fig7TheHCarrangementoftheorgansofCorti’sinthecontrolandβ-cateninknockoutgroup
White arrow heads indicate HC polarity orientation.White dashed line outlines the hair cells with more than one kinocilium indicated by yellow arrows.The hair cells with three kinoclia were circled by the yellow dashed line and amplified in the upper right.The hair cells with a kinocilium in the center of cell surface indicated by a blue arrowhead were circled by the blue dashed line and amplified in the lower right.
图8对照组和β-catenin敲除组的Corti’s器毛细胞极性
Fig8TheHCpolarityoftheorgansofCortiinthecontrolandβ-cateninknockoutgroup
UT:Utricle.
图9对照组和β-catenin敲除组的椭圆囊Phalloidin染色
Fig9Thephalloidinstainingofutriclesinthecontrolandβ-cateninknockoutgroup
本实验结果显示,Sox2CreERTβ-cateninf/flox (exon2-6)小鼠的Corti’s器变短变小,前庭器变小,前庭斑感觉上皮区毛细胞数减少。对毛细胞发育过程中经典Wnt活性的一系列研究表明,Wnt活性增加可以促进毛细胞的正常发育[8,25-26]。此外,Atoh1在启动毛细胞分化、促进毛细胞成熟等方面都有关键作用[5,27-28],并且已证实Atoh1是Wnt/β-catenin通路的下游直接靶基因[4]。本实验结果与上述实验结果相一致,我们推测β-catenin敲除能降低Wnt活性,抑制细胞增殖、分化,同时抑制Atoh1表达,进而抑制毛细胞产生,导致Corti’s器和前庭器变小,毛细胞减少。有研究发现,耳蜗感觉上皮的汇聚伸展作用受非经典Wnt/PCP信号通路调节[10]。本实验中,β-catenin敲除后Corti’s器变短,推测β-catenin依赖的经典Wnt信号通路共同参与调节耳蜗汇聚伸展,但其机制有待探究。
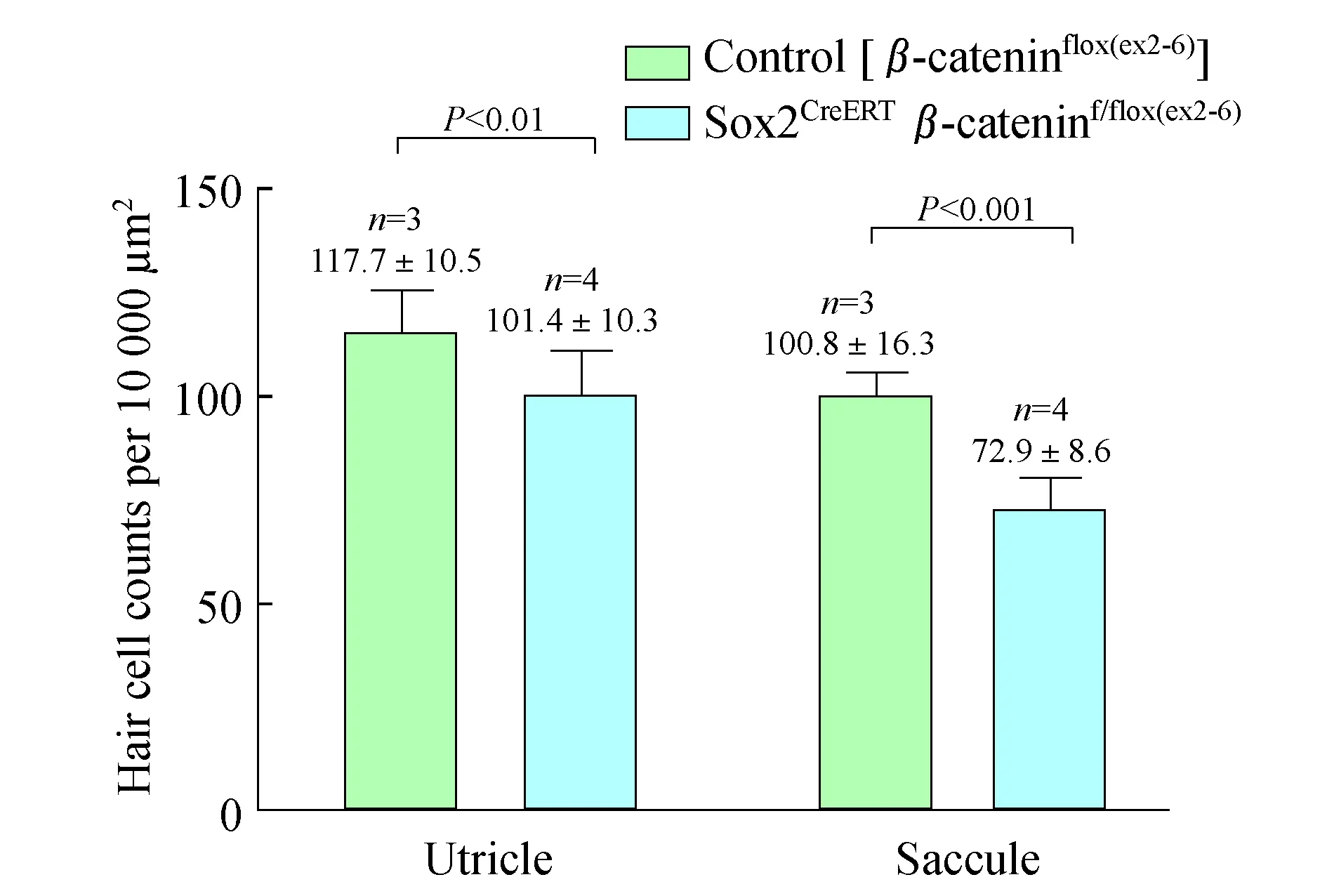
图10 对照组和β-catenin敲除组的椭圆囊、球囊 毛细胞计数比较Fig 10 The comparison of HC numbers in utricle and saccule
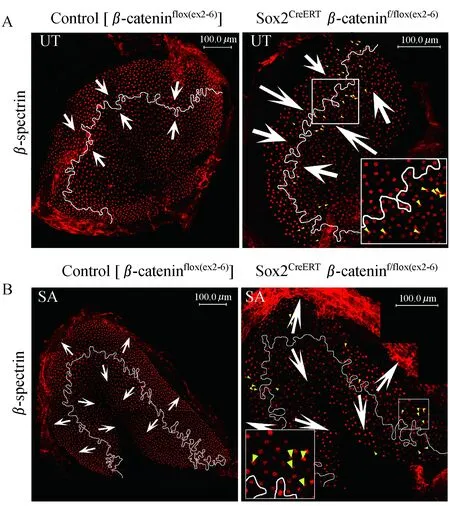
The white line indicates the line of polarity reverse (LPR).The white arrows and yellow arrows indicate the normal and abnormal HC orientation,respectively.
图11对照组和β-catenin敲除组的椭圆囊及球囊
β-spectrin染色和极性分界线
Fig11Theβ-spectrinstainingandLPRofutriclesandsacculesinthecontrolandβ-cateninknockoutgroup
我们发现,在Sox2阳性细胞条件性敲除β-catenin导致耳蜗毛细胞排列紊乱、极性改变,同时导致前庭斑毛细胞散在极性改变。Sox2主要在前体细胞中表达,β-catenin是细胞连接的重要组成部分。我们推测,在Sox2阳性细胞敲除β-catenin导致细胞之间连接作用减弱,从而毛细胞排布发生紊乱。发育中的Corti’s器由毛细胞的前体细胞(支持细胞)向毛细胞的分化开始于底圈,并向顶圈方向延伸进行[29-31]。因此,越接近顶圈,毛细胞的分化越不成熟,尚未分化的支持细胞越多。在接近顶圈的过程中,随着支持细胞数增多,β-catenin缺失导致的细胞连接减弱的作用便表现得越明显,细胞排列越加紊乱,甚至内外毛细胞界限无法区分。Vangl2是一种平面极性核心蛋白,受不依赖β-catenin的非经典Wnt/PCP通路调节,实验发现Vangl2条件敲除的小鼠耳蜗毛细胞的静纤毛束不再沿中间-外侧轴统一朝向[32]。本实验中,敲除β-catenin同样可以引起耳蜗毛细胞静纤毛束V型朝向紊乱,还导致前庭斑散在毛细胞极性改变,提示经典Wnt/β-catenin通路可能在毛细胞PCP建立过程中也起到作用。核心PCP基因突变并不影响单个静纤毛束的极化结构,PCP突变的小鼠毛细胞静纤毛束仍保持V形,动纤毛仍然在其顶端[33-37]。本实验中Sox2CreERTβ-cateninf/flox(exon2-6)小鼠的耳蜗毛细胞静纤毛束仍呈V型,但动纤毛位置发生改变,出现在细胞表皮板中央,以及出现一个毛细胞具有2~3根动纤毛的情况,表明单个毛细胞的内在极性受到影响,提示经典Wnt/β-catenin通路对亚细胞极性也有作用。
我们认为,经典Wnt/β-catenin信号通路是介导内耳感觉上皮发育的重要通路。同时,β-catenin对于稳定的细胞-细胞连接、规律的细胞排列很重要。我们还发现,经典Wnt/β-catenin信号通路可能与非经典PCP通路相似,不仅参与毛细胞PCP建立和耳蜗延伸过程,还可能在亚细胞层面上调控毛细胞的极性。
[1]AMERONGEN RV,NUSSE R.Towards an integrated view of Wnt signaling in development[J].Development,2009(19),136:3205-3214.
[2]OHYAMA T,MOHAMED OA,TAKETO MM,etal.Wnt signals mediate a fate decision between otic placode and epidermis[J].Development,2006,133(5):865-875.
[3]RAKOWIECKI S,EPSTEIN DJ.Divergent roles for Wnt/β-catenin signaling in epithelial maintenance and breakdown during semicircular canal formation[J].Development,2013,140(8):1730-1739.
[4]SHI F,CHENG Y,WANG X,etal.β-catenin up-regulatesAtoh1expression in neural progenitor cells by interaction with anAtoh1 3’enhancer[J].JBiolChem,2010,285(1):392-400.
[5]BERMINGHAM NA,HASSAN BA,PRICE SD,etal.Math1:an essential gene for the generation of inner ear hair cells[J].Science,1999,284(5421):1837-1841.
[6]CHAI R,KUO B,WANG T,etal.Wnt signaling induces proliferation of sensory precursors in the postnatal mouse cochlea[J].ProcNatlAcadSciUSA,2012,109(21):8167-8172.
[7]SHI F,KEMPFLE J,EDGE AS.Wnt-responsive Lgr5-expressing stem cells are hair cell progenitors in the cochlea[J].JNeurosci,2012,32(28):9639-9648.
[8]JACQUES BE,PULIGILLA C,WEICHERT RM,etal.A dual function for canonical Wnt/β-catenin signaling in the developing mammalian cochlea[J].Development,2012,139(23):4395-4404.
[9]GUBB D,GARCIA-BELLIDO A.A genetic analysis of the determination of cuticular polarity during development inDrosophilamelanogaster[J].JEmbryolExpMorph,1982,68(5):37-57.
[10]QIAN D,JONES C,RZADZINSKA A,etal.Wnt5a functions in planar cell polarity regulation in mice[J].DevBiol,2007,306(1):121-133.
[11]DEANS MR.A balance of form and function:planar polarity and development of the vestibular maculae[J],SeminCellDevBiol,2013,24(5):490-498.
[12]DABDOUB A,DONOHUE MJ,BRENNAN A,etal.Wnt signaling mediates reorientation of outer hair cell stereociliary bundles in the mammalian cochlea[J].Development,2003,130(11):2375-2384.
[13]BRAULT V,MOORE R,KUTSCH S,etal.Inactivation of the β-catenin gene byWnt1-Cre-mediated deletion results in dramatic brain malformation and failure of craniofacial development[J].Development,2001,128(8):1253-1264.
[14]ARNOLD K,SARKAR A,YRAM MA,etal.Sox2+ adult stem/progenitor cells are important for tissue regeneration and survival of mice[J].CellStemCell,2011,9(4):317-329.
[15]SHI F,HU L,JACQUES BE,etal.β-catenin is required for hair-cell differentiation in the cochlea[J].JNeurosci,2014,34(19):6470-6479.
[16]DABDOUB A,PULIGILLA C,JONES JM,etal.Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea[J].ProcNatlAcadSciUSA,2008,105(47):18396-18401.
[17]HAN Z,YANG J,CHI F,etal.Survival and fate of transplanted embryonic neural stem cells byAtoh1 gene transfer in guinea pigs cochlea[J].Neuroreport,2010,21(7):490-496.
[18]HUANG Y,CHI F,HAN Z,etal. New ectopic vestibular hair cell-like cells induced byMath1 gene transfer in postnatal rats[J].BrainRes,2009,1276:31-38.
[19]SHOU J,ZHENG JL,GAO W.Robust generation of new hair cells in the mature mammalian inner ear by adenoviral expression ofHath1[J].MolCellNeurosci,2003,23(2):169-179.
[20]WOODS C,MONTCOUQUIOL M,KELLEY MW.Math1 regulates development of the sensory epithelium in the mammalian cochlea[J].NatNeurosci,2004,7(12):1310-1318.
[21]YANG J,BOUVRON S,LV P,etal.Functional features of trans-differentiated hair cells mediated byAtoh1 reveals a primordial mechanism[J].JNeurosci,2012,32(11):3712-3725.
[22]ZHENG JL,GAO W.Overexpression ofMath1 induces robust production of extra hair cells in postnatal rat inner ears[J].NatNeurosci,2000,3(6):580-586.
[23]YANG X,QIAN X ,MA R,etal.Establishment of planar cell polarity is coupled to regional cell cycle exit and cell differentiation in the mouse utricle[J].SciRep,2017,7:43021.
[24]VALENTA T,HAUSMANN G,BASLER K.The many faces and functions of β-catenin[J].EMBOJ,2012,31(12):2714-2736.
[25]DASGUPTA R,FUCHS E.Multiple roles for activated LEF/TCF transcription complexes during hair follicle development and differentiation[J].Development,1999,126(20):4557-4568.
[26]SHI F,HU L,EDGE AS.Generation of hair cells in neonatal mice by β-catenin overexpression in Lgr5-positive cochlear progenitors[J].ProcNatlAcadSciUSA,2013,110(34):13851-13856.
[27]CAI T,SEYMOUR ML,ZHANG H,etal. Conditional deletion ofAtoh1 reveals distinct critical periods for survival and function of hair cells in the organ of Corti [J].JNeurosci,2013,33(24):10110-10122.
[28]CHONKO KT,JAHAN I,STONE J,etal.Atoh1 directs hair cell differentiation and survival in the late embryonic mouse inner ear[J].DevBiol,2013,381(2):401-410.
[29]LEE YS,LIU F,SEGIL N.A morphogenetic wave ofp27Kip1transcription directs cell cycle exit during organ of Corti development[J].Development,2006,133(15):2817-2826.
[30]CHEN P,SEGIL N.p27Kip1links cell proliferation to morphogenesis in the developing organ of Corti[J].Development,1999,126(8):1581-1590.
[31]CHEN P,JOHNSON JE,ZOGHBI HY,etal.The role ofMath1 in inner ear development:uncoupling the establishment of the sensory primordium from hair cell fate determination[J].Development,2002,129(10):2495-2505.
[32]COPLEY CO,DUNCAN JS,LIU C,etal.Postnatal refinement of auditory hair cell planar polarity deficits occurs in the absence ofVangl2[J].JNeurosci,2013,33(35):14001-14016.
[33]YIN H,COPLEY CO,GOODRICH LV,etal.Comparison of phenotypes between differentVangl2 mutants demonstrates dominant effects of theLooptailmutation during hair cell development[J].PLoSOne,2012,7(2):e31988.
[34]MONTCOUQUIOL M,RACHEL RA,LANFORD PJ,etal. Identification ofVangl2 andScrb1 as planar polarity genes in mammals[J].Nature,2003,423(6936):173-177.
[35]CURTIN JA,QUINT E,TSIPOURI V,etal. Mutation ofCelsr1 disrupts planar polarity of inner ear hair cells and causes severe neural tube defects in the mouse[J].CurrBiol,2003,13(13):1129-1133.
[36]WANG J,HAMBLET NS,MARK S,etal.Dishevelledgenes mediate a conserved mammalian PCP pathway to regulate convergent extension during neurulation[J].Development,2006,133(9):1767-1778.
[37]WANG Y,GUO N,NATHANS J.The role ofFrizzled3 andFrizzled6 in neural tube closure and in the planar polarity of inner-ear sensory hair cells[J].JNeurosci,2006,26(8):2147-2156.

