FHL1对肺腺癌细胞株A549生物学特性的影响
季春华 刘 辉 向 明
(复旦大学附属上海市第五人民医院胸外科 上海 200240)
目前肺癌的发病率及死亡率居所有恶性肿瘤之首。而且近些年来肺癌,尤其是晚期肺癌治疗后的5年生存率提高并不大,分子靶向药物在肺癌治疗中的地位逐年提高,因此,新的分子靶向基因及药物的研究十分必要。FHL1(four and a half LIM domain protein 1)是近年来研究发现的一种肿瘤抑制因子,表达于人体的多种正常细胞以及肿瘤细胞中[1]。FHL1在多种实体肿瘤细胞中呈低表达,而且其表达水平与肿瘤的进展呈负相关[2]。我们通过在体外细胞实验中改变FHL1在肺腺癌细胞株中的表达,研究其对肺腺癌细胞株生物学特性的影响,为进一步的实验研究提供基础,以期将来能为肺腺癌的诊断治疗提供新的思路。
材 料 和 方 法
材料和试剂本实验所用肺腺癌细胞株A549、人源FHL1-mRNA慢病毒及人源FHL1 shRNA慢病毒套装购自上海匠莱生物科技有限公司;FHL1抗体购自美国Abcam公司(批号ab58067);CCK8试剂盒、Takara逆转录试剂盒、SYBR Green Master Mixes 试剂盒、Transwell小室等实验试剂器材均购自上海丰能医药科技有限公司。
实验方法
FHL1在非小细胞肺癌中的本底表达选取A549细胞进行实验,检测FHL1基因在mRNA水平上的表达情况,即本底表达水平。接种细胞,取对数期A549细胞,用含10%胎牛血清的DMEM培养基配成单细胞悬液,计数,接种至6孔板中,于37 ℃,5% CO2细胞培养箱中预培养24 h。
收集细胞,使用Trizol/三氯甲烷/异丙醇法提取细胞总RNA,定量,将RNA逆转录成cDNA,以U6 为内参,以cDNA 为模板进行RT-PCR扩增FHL1。由PCR 反应曲线得到的Ct 值计算,按公式2-△△Ct计算细胞株中FHL1 mRNA 相对表达量。
FHL1稳转过表达和低表达细胞株构建及鉴定针对之前的结果,我们设计过表达和低表达实验,合成FHL1 mRNA慢病毒过表达载体和FHL1 shRNA慢病毒低表达载体,分别以空载体和shRNA-NC为空白对照,侵染A549细胞,侵染方法按照说明书进行,侵染4~6 h后更换新鲜培养液。72 h后于荧光显微镜下观察并拍摄荧光图片,然后收集细胞,通过RT-PCR及Western blot检测FHL1基因的过表达情况和不同低表达片段的低表达效率,刷选出FHL1-shRNA稳转表达细胞株备用。
Western blot方法细胞裂解匀浆液在4 ℃离心(13 000×g,15 min)。离心后吸取上清液转移至另一个EP管中,BAC法测蛋白浓度。向EP管中按4∶1的比例加变性蛋白上样缓冲液,95 ℃水浴箱内变性5 min。变性后的样品在4 ℃保存备用或立即进入下一步实验。SDS-PAGE法电泳。将漂洗后的膜置于含5%BSA的封闭液中,室温下摇床轻摇1~2 h。然后TBST液中轻摇洗4次,每次10 min。一抗孵育:将膜按照marker指示带位置裁剪目标条带和内参相应条带,分别置于稀释好的一抗中,FHL-1抗体稀释浓度为1∶1 000;β-actin抗体(CST,4967)稀释浓度1∶4 000。4 ℃孵育过夜。TBST液轻摇洗4次,每次10 min。将膜放于二抗中(IRDye羊抗鼠或羊抗兔抗体,1∶10 000),室温下摇床轻摇1 h。TBST液轻摇4次,每次10 min。将膜用LI-COR Odyssey系统扫描获取图像,用Image J软件分析目标带的净光密度值,内参为β-actin。
CCK-8实验检测FHL1在过表达和低表达情况下对A549细胞增殖的影响接种稳转FHL1低表达和过表达慢病毒载体的A549细胞,分别以稳转shRNA-NC和空载体的A549细胞为对照,将细胞用含10%胎牛血清的DMEM培养基配成单细胞悬液,以每孔5 000~8 000细胞量接种到96孔板中,每个时间点设6个平行复孔,每孔100 μL,于细胞培养箱(37 ℃,5%CO2)中预培养。
设置时间梯度,分别于固定的培养时间点6、12、24、48、72、96 h 向每孔中加入10 μL CCK-8溶液,37 ℃细胞培养箱中共孵育1~4 h后终止培养,然后测定各孔450 nm下的吸光度(D450)值。采集数据后,绘制A549细胞的增殖曲线。
流式实验检测FHL1在过表达和低表达情况下对A549细胞凋亡和周期的影响常规消化稳转低表达载体和过表达慢病毒载体的A549细胞,制备悬液,以稳转shRNA-NC和空载体的A549细胞为对照,计数,接种等量细胞至6孔板中,培养48 h,弃培液,用不含EDTA的胰蛋白酶消化贴壁的4组细胞。弃胰蛋白酶,加入2 mL细胞培养液,混匀,转移到离心管内,300×g离心5 min,弃上清,收集细胞,用预冷的PBS洗涤细胞2次,每次均在300×g、4 ℃离心5 min。收集1~5×105细胞。 加入100 μL 1×缓冲液重悬细胞。加入5 μL Annexin V-FITC和5 μL PI染液,轻轻混匀。避光室温静置孵育10 min。
加入400 μL 1×缓冲液,混匀,随即样品在1 h内用流式细胞仪检测,分析低表达对细胞的影响。
Transwell实验检测FHL1在过表达和低表达情况下对A549细胞迁移的影响所有细胞培养试剂和Transwell小室放在37 ℃温育;待稳转过表达载体和低表达慢病毒载体的A549细胞培养至对数生长期,常规消化细胞,用PBS和无血清培养基先后洗涤1次,用无血清培养基重悬细胞,计数,调整浓度为2×105/mL,以稳转空载体的A549细胞为对照;在下室(即24孔板底部)加入600~800 μL 含10%胎牛血清的培养基,上室加入100~150 μL 上述4种细胞悬液,继续在温箱培养24 h;取出小室,吸干上室液体,移到预先加入约800 μL甲醇的孔中,室温固定30 min;取出小室,吸干上室固定液,移到预先加入约800 μL 0.1%结晶紫染液的孔中,室温染色15~30 min;用清水冲洗浸泡数次,取出小室,吸去上室液体,用湿棉棒擦去上室底部膜表面上未迁移的细胞;用小镊子揭下膜,底面朝上晾干,移至载玻片上用中性树胶封片;于400倍显微镜下取5个随机视野计数,统计结果。
细胞集落形成实验检测FHL1在过表达和低表达情况下对A549细胞克隆形成的影响分别取稳转FHL1过表达和低表达慢病毒载体及空载对照的A549细胞,用胰蛋白酶常规消化,吹打成单细胞悬液,调整细胞悬液密度为1×103个/mL,计数后接种于6孔培养板中,每孔接种1 mL细胞悬液,置于37 ℃、5%CO2细胞培养箱中培养2周,每48 h更换新鲜培养基,至细胞形成典型集落(多数集落细胞数在50个以上),然后弃去培养基,分别经甲醇固定10 min和0.1%结晶紫染色15 min后,计数集落数,拍照并保存图像。
统计学方法运用SPSS 22.0统计软件进行统计学分析。实验结果中,两组比较采用t检验方法,多组比较采用单因素方差分析,P<0.05为差异具有统计学意义。
结 果
慢病毒载体转染后的细胞株首先,我们利用免疫荧光技术观察了各组转染后细胞的形态,FHL1 shRNA低表达组(图1A)相对FHL1 shRNA空白组(图1B)细胞数量较多,提示干扰FHL1蛋白表达后可能减少细胞凋亡,进而细胞存活增加。而FHL1过表达组(图1D)相比FHL1本底表达(空白组)组(图1C)细胞数量减少,提示过表达FHL1蛋白后可能通过促进细胞凋亡,进而导致细胞数量减少。
FHL1的过表达及低表达的验证
RT-PCR检测结果(图2)我们利用RT-PCR技术验证病毒转染的效率,FHL1 shRNA-1、2低表达组FHL1 mRNA表达水平分别为0.015±0.002、0.017±0.003,FHL1 shRNA空白组表达为0.999±0.083,差异具有统计学意义(P<0.000 1),说明两个干扰病毒转染后均可以明显降低FHL1 mRNA水平,干扰病毒作用可靠。FHL1过表达组FHL1 mRNA表达水平为5.330±0.578,明显高于FHL1空白组(0.545±0.016,P<0.000 1),说明过表达组可以提高FHL1 mRNA水平,病毒效果可靠。
Western blot检测结果(图3)利用Western blot技术在蛋白表达水平上检测了干扰组和过表达组的FHL1蛋白表达,FHL1 shRNA-1、2低表达组相对FHL1 shRNA空白组FHL1蛋白表达显著减少(图3A)。FHL1过表达组相比FHL1本底表达(空白组)组FHL1蛋白表达明显增加(图3B)。进一步从蛋白表达水平上验证了干扰与过表达病毒的效率。
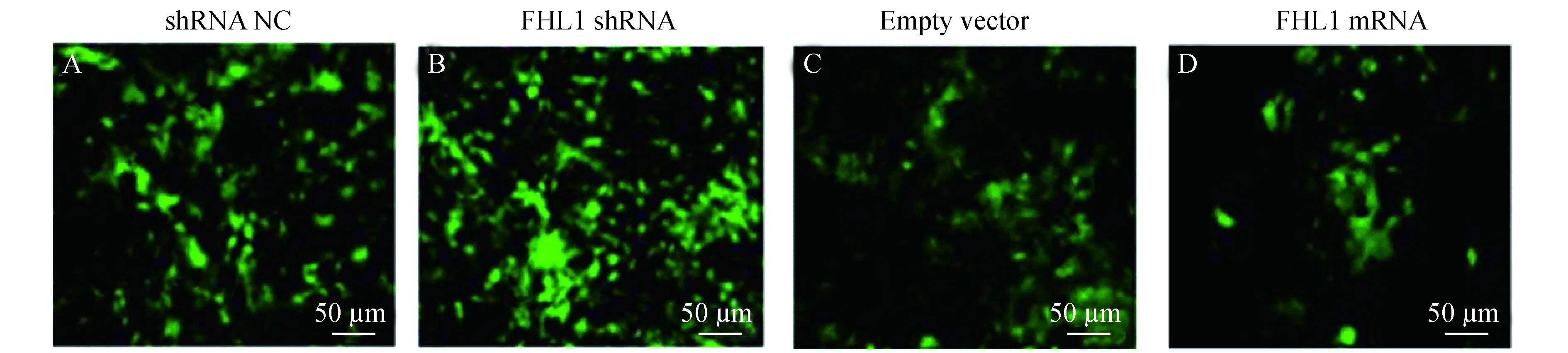
A:Imaging of A549 cell in shRNA-NC group;B:Imaging of A549 cell in FHL1-shRNA group;C:Imaging of A549 cell in empty vector group;D:Imaging of A549 cell in FHL1 mRNA group.
图1慢病毒转染后的细胞形态
Fig1Cellularmorphologyafterthetransfectionoflentivirusvector
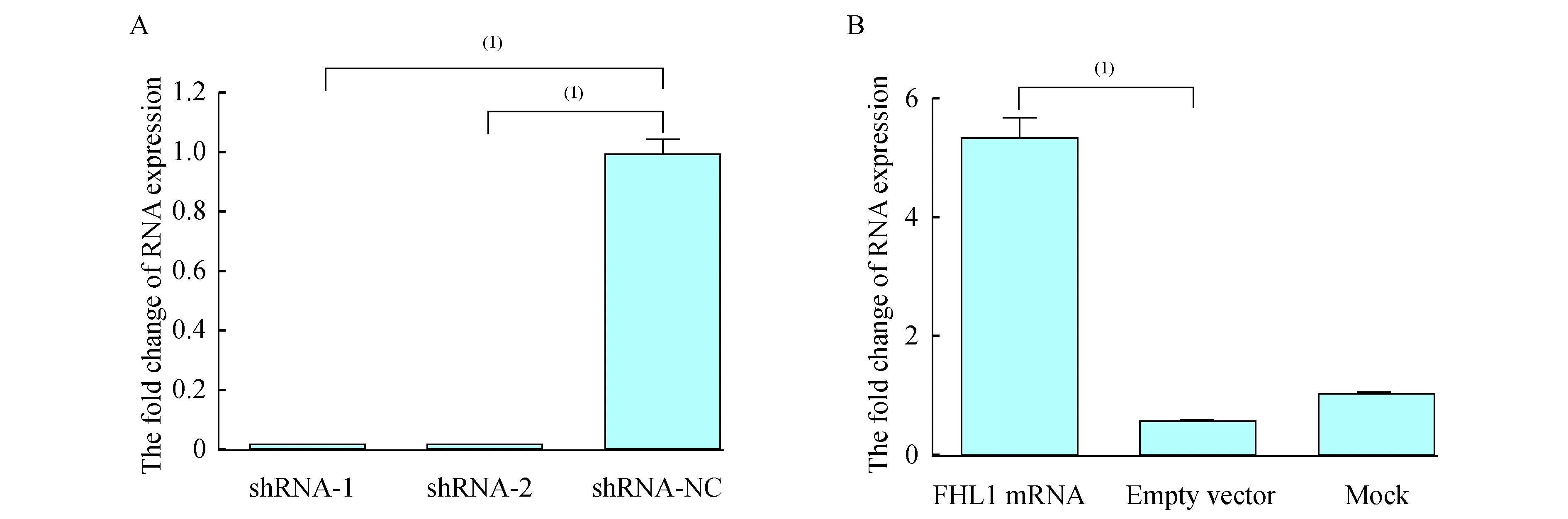
A:FHL1 mRNA expression in groups of shRNA;B:FHL1 mRNA expression in groups of overexpression.(1)P<0.001.
图2FHL1mRNA表达水平的RT-PCR检测结果
Fig2RT-PCRtestresultofFHL1mRNAexpression
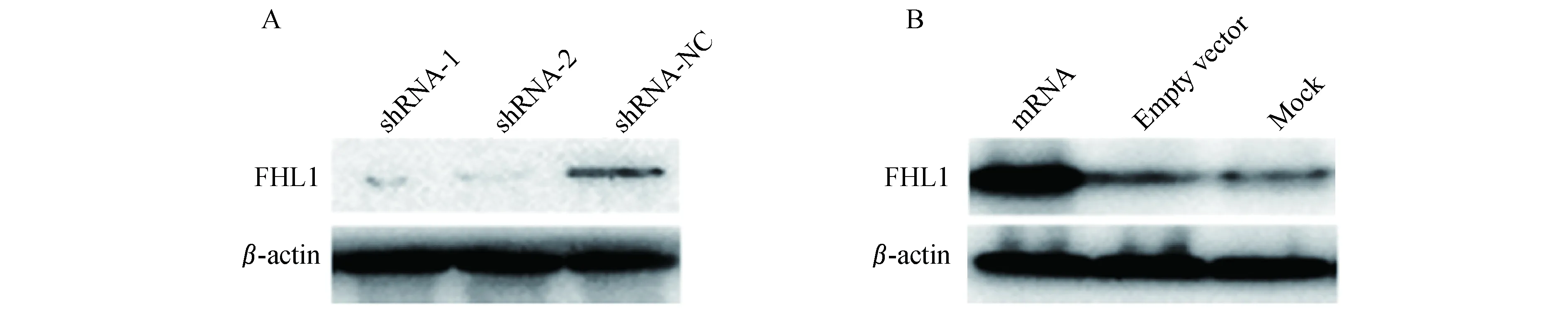
A:FHL1 protein levels in groups of shRNA;B:FHL1 protein levels in groups of overexpression.
图3FHL1表达水平的Westernblot检测结果
Fig3WesternblottestresultofFHL1expression
CCK-8实验检测FHL1在过表达和低表达情况下对A549细胞增殖的影响我们利用CCK-8实验观察了干扰或过表达FHL1后是否会影响A549细胞的增殖。结果显示,FHL1 shRNA-1、2低表达组96 h后的平均D值分别为0.291±0.007和0.272±0.005,增殖率分别为103.4%和98.1%,空白组96 h后的平均D值为0.218±0.004,增殖率为65.2%,差异具有统计学意义(图4A)。该结果表明,干扰FHL1后细胞的增殖较空白组增多。与之相反,FHL1过表达96 h后的平均D值为0.194±0.003,增殖率为43.2%,过表达组细胞的增殖明显低于空白组,差异具有统计学意义(P=0.002 2,图4B)。
细胞流式术检测FHL1在过表达和低表达情况下对A549细胞凋亡的影响为了验证FHL1影响A549细胞的增殖是否通过影响细胞凋亡而实现的,我们利用流式细胞术观察了FHL1在过表达和低表达情况下A549细胞的凋亡情况(图5A~F)。结果显示,FHL1 shRNA-1、2组的总体凋亡率分别为16.41%和20.12%,低于空白组的26.38% (P=0.004 5、0.032 3)。FHL1过表达组的总体凋亡率为50.48%,高于空白组的25.90% (P=0.003 6),且明显高于低表达组,差异具有统计学意义(P<0.001,图5G)。
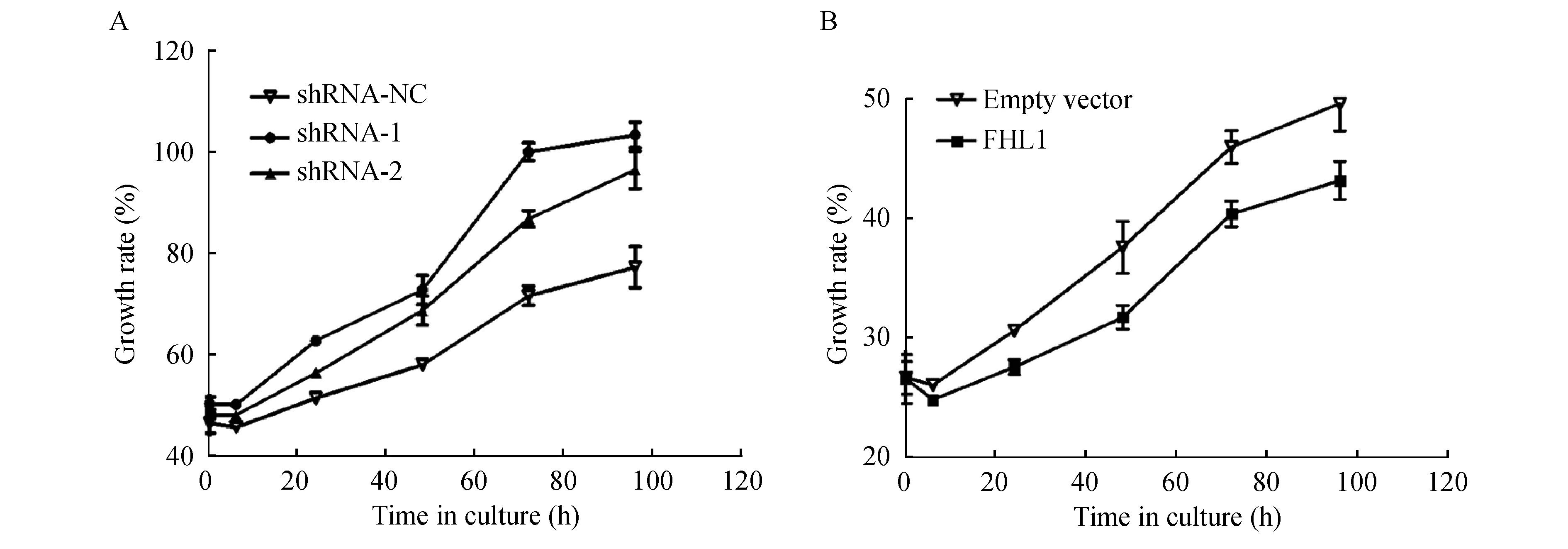
A:Growth rate of A549 cell in FHL1 low expression groups;B:Growth rate of A549 cell in FHL1 overexpression groups.
图4FHL1在过表达和低表达情况下对A549细胞增殖的影响
Fig4TheeffectsofFHL1overexpressionandlowexpressiononA549cellgrowth
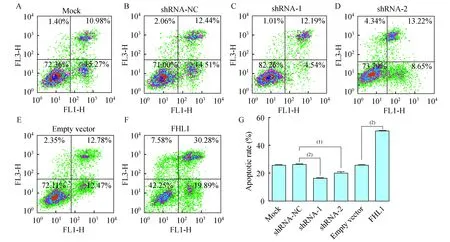
A-F:Representative graph of apoptosis in different groups;G:Statistics graph of apoptosis in different groups.(1)P<0.05,(2)P<0.01.
图5过表达和低表达FHL1下对A549细胞凋亡的影响
Fig5TheeffectsofFHL1overexpressionandlowexpressiononA549cellapoptosis
Transwell实验检测结果为了验证FHL1干扰或过表达后对A549细胞侵袭能力是否有作用,我们通过 Transwell实验观察干扰和过表达FHL1蛋白后对A549细胞侵袭能力的影响(图6A~E)。结果显示,FHL1过表达组平均细胞数为58.6±6.4,空白组为122.4±12.8 (P<0.001,图6G)。而低表达组FHL1 shRNA-1、FHL1 shRNA-2分别为215.6±21.3、200.2±23.7,明显高于空白组,差异具有统计学意义(P=0.004 8,图 6F)。
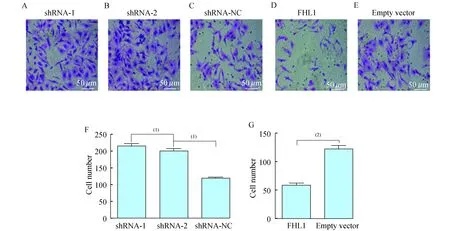
A-E:Low expression of FHL1 on A549 cell proliferation;F-G:Overexpression of FHL1 on A549 cell proliferation.(1)P<0.01,(2)P<0.001.
图6FHL1在过表达和低表达情况下对A549细胞迁移的影响
Fig6TheeffectsofFHL1overexpressionandlowexpressiononA549cellproliferation
成集落实验结果每孔接种细胞数103个,将平皿倒置并叠加一张带网格的透明胶片,在显微镜(低倍镜)下计数各组大于50个细胞的集落数。FHL1低表达组shRNA-1、shRNA-2的平均集落数分别为157.0±6.4、150.7±9.5,空白组为82.0±7.0,而过表达组的集落数为28.7±6.0,明显少于空病毒对照组及FHL1低表达组,差异具有统计学意义(P<0.000 1,图7)。
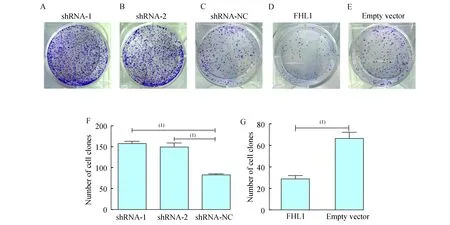
A-E:Low expression of FHL1 on A549 cell colony formation;F-G:Overexpression of FHL1 on A549 colony formation.(1)P<0.001.
图7FHL1在过表达和低表达情况下对A549细胞克隆形成的影响
Fig7TheeffectsofFHL1overexpressionandlowexpressiononA549cellcolonyformation
讨 论
肺癌发生于支气管黏膜上皮,根据显微镜下细胞的大小,肺癌可分为小细胞肺癌(small cell lung cancer,SCLC)及非小细胞肺癌(non small cell lung cancer,NSCLC)两大类,其中,后者约占80%~85%,而NSCLC根据细胞类型又分为腺癌、鳞状细胞癌及大细胞癌等,近年来的流行病学统计显示,腺癌的发病率明显增高,在NSCLC中占比超过50%。手术、化疗、放疗一直以来被作为NSCLC的主要治疗手段,但是目前对于进展期NSCLC的治疗效果仍然较差,5年生存率仅为16%~20%。而分子靶向药物的出现,给NSCLC的治疗指引了新的方向。近年来,NSCLC分子生物学研究成为热点,新的肿瘤标志物、治疗靶点及有效的肿瘤抑制因子可以为NSCLC的诊断和治疗提供更多的手段。
FHL1是FHL家族的一员,在该家族中表达最为广泛,该家族是一类含有4个半LIM结构域的蛋白家族[1]。研究发现,其成员包括FHL1、FHL2、FHL3、FHL4、FHL5/ACT,它们表达分布于不同组织中[2]。它们通过活性结构域LIM,与某些结构蛋白、转录调控因子、激酶等多种物质产生相互作用,从而对一些基因的表达、细胞的分化发育进行调控[3-4]。FHL1在心、肾、卵巢、肌肉、肺和脑等多种人体正常组织细胞中均有表达[5-6]。研究还发现,FHL1基因缺失可以恢复细胞多态性[7-8],FHL1 在多种人体肿瘤细胞中表达是下降的,可被认为是一种新的肿瘤标志物[9-12]。
本研究通过慢病毒载体转染肺腺癌细胞株A549,改变肿瘤细胞内FHL1的表达,构建了FHL1高表达和低表达细胞株模型,通过RT-PCR及Western blot检测均证实其表达差异明显。CCK-8实验检测提示FHL1低表达组的细胞增殖情况明显高于FHL1高表达组,表明FHL1的表达下调能加快肺腺癌细胞株A549的细胞增殖,而上调FHL1的表达将减缓细胞株的增殖。Niu等[13]的研究中发现FHL1能诱导肺癌细胞周期G1及G2/M停滞,同时下调细胞周期蛋白D1和B1,而上调周期蛋白依赖激酶(cyclin-dependent kinase,CDK)抑制因子p21,从而对肿瘤细胞的增殖生长产生抑制作用。流式细胞术检测发现FHL1过表达组的细胞凋亡率明显高于低表达组及空白对照组,表明FHL1能够诱导加速肺腺癌细胞的凋亡。研究表明,FHL1以转录共调控因子的角色参与细胞增殖分化、转录调节、信号转导、凋亡等多种细胞活动[14-15]。在Transwell实验中,FHL1过表达组细胞表现出的侵袭性明显低于低表达组及空白组,表明FHL1对于肿瘤细胞的侵袭性也有影响。在吴成利等[9]、刘哲等[10]及Kashyap等[11]的研究中均发现FHL1的表达与肿瘤的侵袭性呈负相关。细胞集落形成实验中,FHL1过表达组细胞株在培养基上形成的集落数明显少于FHL1低表达组,说明FHL1对肺腺癌细胞株的锚定非依赖生长有抑制作用,而锚定非依赖生长是肿瘤发生局部或远处转移原因之一[16],因此,FHL1表达对于肺腺癌的转移亦有影响。细胞的黏着斑对肿瘤细胞的转移有着重要的影响[17],而Sakashita等[18]研究表明,FHL1在肿瘤中的生物学机制是形成黏着斑。
Niu等[13]的研究中,在体外细胞实验中发现了FHL1的表达对肺癌细胞的增殖及锚定非依赖性生长有抑制作用,也进一步对其作用机制进行了研究。而本研究的结论与其研究一致,重复验证了这一现象,但重点主要集中在干扰或过表达FHL1后A549细胞一系列细胞生物学特性的改变,以期更全面地了解FHL1作为肺腺癌肿瘤抑制因子在肿瘤的发生、发展中所起的作用,为深入了解FHL1基因调控A549细胞提供基本的实验数据。
综上所述,慢病毒载体转染肺腺癌细胞株A549能成功构建FHL1过表达及低表达细胞株模型。FHL1对于肺腺癌细胞株A549的增殖、侵袭及转移均有抑制作用,并且能诱导加速肿瘤细胞凋亡,因此,FHL1作为一种新型的肺腺癌肿瘤抑制因子值得关注。虽然已有动物实验[13]证实FHL1可抑制裸鼠体内肺癌的生长,但目前FHL1能否作为靶向基因用于人体肺腺癌的治疗,尚有待进一步研究。
[1]林鹿杰,肖兴军.FHL1的结构和功能及其与疾病的关系[J].医学分子生物学杂志,2011,8(2):176-179.
[2]SHATHASIVAM T,KISLINGER T,GRAMOLINI AO.Genes,proteins and complexes:the multifaceted nature of FHL family proteins in diverse tissues[J].CellMolMed,2010,14(12):2702-2720.
[3]WILDING BR,MCGRATH MJ,BONNE G,etal.FHL1 mutants that cause clinically distinct human myopathies form protein aggregates and impair myoblast differentiation[J].JCellSci,2014,127(10):2269-2281.
[4]CHATURVEDI P,TYAGII SC.Epigenetic mechanisms underlying cardiac degeneration and regeneration[J].IntJCardiol,2014,173(1):1-11.
[5]CAN T,FAAS L,ASHFORD DA,etal.Proteomic analysis of laser capture microscopy purified myotendinous junction regions from muscle sections[J].ProteomeSci,2014,12(25):25-36.
[6]PFEFFER G,POVITZ M,GIBSON G,etal.Diagnosis of muscle diseases presenting with early respiratory failure[J].JNeurol,2015,262(5):1101-1114.
[7]YUE J,GUAN J,WANG X,etal.Micro RNA-206 is involved in hypoxia-induced pulmonary hypertension through targeting of the HIF-1 a/FHL-1 pathway[J].LabInvest,2013,93(7):748-759.
[8]WU SM,SHI LH,LEE JY,etal.Estrogen enhances activity of Wnt signaling during osteogenesis by inducing Fhl1 expression [J].JCellBiochemistry,2015,116(7):1419-1430.
[9]吴成利,周洲,钱建新,等.FHL1在胃癌中的表达及其临床意义[J].临床肿瘤学杂志,2011,16(3):228-231.
[10]刘哲,许元鸿,龙锦,等.FHL1在人胰腺癌族中的表达及其与胰腺癌的侵袭及转移的相关性研究[J].临床与病理杂志,2015,35(3):423-427.
[11]KASHYAP MK,PAWAR HA,KEERTHIKUMAR S,etal.Evaluation of protein expression pattern of stanniocalcin 2,insulin-like growth factor-binding protein 7,inhibin beta A and four and a half LIM domains 1 in esophageal squamous cell carcinoma[J].CancerBiomakers,2012,12(1):1-9.
[12]REN W,LIAN PF,CHENG L,etal.FHL1 inhibits the growth of tongue squamous cell carcinoma cells via G1/S cell cycle arrest[J].MolMedRep,2015,12(3):3958-3964.
[13]NIU C,LIANG C,GUO J,etal.Downregulation and growth inhibitory role of FHL1 in lung cancer[J].IntJCancer,2012,130(11):2549-2556.
[14]STATHOPOULOU K,CUELLO F,CANDASAMY AJ,etal.Four-and-a-half LIM domains proteins are novel regulators of the protein kinase D pathway in cardiac myocytes[J].BiochemJ,2014,457(3):451-461.
[15]WANG L,GU H,FAN Y,etal.Up-regulated FHL1 expression maybe involved in the prognosis of Hirschsprung′s disease[J].IntJMedSci,2014,11(3):262-267.
[16]陈艳,王熙才,伍治平,等.ITGA6 shRNA抑制非小细胞肺癌H460SM细胞锚定非依赖性生长和侵袭[J].中国肿瘤生物治疗杂志,2012,19(4):355-362.
[17]TILGHMAN RW,PARSONS JT.Focal adhesion kinase as a regulator of cell tension in the progression of cancer[J].SeminCancerBiol,2008,18(1):45-52.
[18]SAKASHITA K,MIMORI K,TANAKA F,etal.Clinical significance of loss of FHL1 expression in human gastric cancer[J].AnnSurgOncol,2008,15(8):2293-2300.

