嗜酸乳杆菌-地衣芽孢杆菌融合子培养特性研究
要荣宇,王静慧,杨乔木,吴瑞妮,霍乃蕊
(1.四川农业大学动物科技学院,四川成都611130;2.山西出入境检验检疫局,山西太原030024;3.太原市食品药品监督管理局,山西太原030031;4.山西农业大学动物科技学院,山西太谷030801)
嗜酸乳杆菌属乳杆菌属,是乳酸菌中非常重要的益生菌之一,被称为第三代乳酸发酵剂菌种[1]。嗜酸乳杆菌具有调节肠道菌群、提高免疫力、降低血脂、降低产毒微生物的活性、防止乳糖不耐受等功能。地衣芽孢杆菌属厚壁菌门,是一种常见的革兰氏阳性细菌,广泛存在于土壤、空气和腐败有机物中。地衣芽孢杆菌已经应用于医药行业,其商品名为整肠生,主要运用于肠道疾病的治疗,对肠炎、菌痢等具有明显疗效[2]。
原生质体融合即细胞融合,是指将两亲本菌株的细胞壁通过酶解脱壁,形成球状的原生质体后,在高渗条件下使其相互接触,通过膜融合、细胞质融合、核融合,最终基因组之间发生接触、交换,进而发生基因重组,最后在适宜的条件下再生出细胞壁来,获得阳性重组子的过程。原生质体融合具有重组频率高、遗传稳定、可实现远缘杂交、可集合双亲优良性状的优点,所以在微生物育种领域得到广泛应用[3-5]。王成涛等[6]利用原生质体融合技术将芽孢杆菌T12-1与嗜热链球菌及嗜酸乳杆菌C3进行融合,得到2株高效降低胆固醇的乳酸菌融合子,可显著降低蛋黄乳等食品中的胆固醇含量,同时兼具乳酸菌发酵食品的风味特征。吕兵等[7]将专性厌氧的短双歧杆菌和典型的啤酒上面酵母进行原生质体融合,成功筛选出遗传较稳定的BSF1和BSF2,改善了双歧杆菌的耐氧特性,为厌氧性益生菌的改良提供了思路。王玉华[8]将2株不同来源的嗜酸乳杆菌La-w1和La-w2融合后获得菌株La-F1,其耐酸性和耐胆盐能力明显高于原菌株。黎永学等[9]将双歧杆菌和酿酒酵母进行原生质体融合可得到遗传稳定的融合子,实现了厌氧菌和酵母的跨界融合,为双歧杆菌生物学功能的开发提供了新途径。
实验室在前期成功制得嗜酸乳杆菌-地衣芽孢杆菌融合子,在此基础上,本试验进一步优化融合子的培养条件,考察培养基种类、培养温度、pH值、氧气浓度对融合子生成量的影响进行分析,确定融合子的适宜培养条件,为融合子的制剂化研究及工业化应用奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株
嗜酸乳杆菌(Lactobacillus acidophilus),地衣芽孢杆菌(Bacillus licheniformis)购于中科院微生物研究所。嗜酸乳杆菌-地衣芽孢杆菌融合子由山西农业大学动科院动物卫检实验室制备。
1.1.2 试剂与设备
牛肉膏、蛋白胨、胰蛋白胨、葡萄糖、酵母浸膏、吐温80、琼脂粉:北京奥博星生物技术有限公司。
硫酸镁、磷酸氢二钾、氯化钠、柠檬酸三铵、硫酸锰、醋酸钠、溴甲酚紫(均为分析纯):天津市化学试剂六厂。
722E型可见分光光度计:上海光谱仪器有限公司;PHS-25C型酸度计:上海大普仪器有限公司;HZQ-F160型全温振荡培养箱:哈尔滨市东连电子技术开发有限公司;XW-80A型漩涡混合器:北京科伟永兴仪器有限公司;DF205型离心机:北京科伟永兴仪器有限公司;LRHS-150型恒温恒湿培养箱:上海跃进医疗器械厂。
1.1.3 培养基的配制
MRS培养基:蛋白胨10 g,牛肉膏10 g,酵母浸膏5 g,葡萄糖 20 g,Tween-80 1 mL,醋酸钠 5 g,K2HPO42 g,柠檬酸铵2 g,MgSO4·7H2O 0.58g,蒸馏水1 000 mL,MnSO4·4H2O 0.2 g (固体培养基加入 15 g~20 g琼脂)pH 6.2~6.6,将mgSO4·7H2O,MnSO4·4H2O,葡萄糖,Tween-80以外的成分溶解,冷至50℃。然后加入MgSO4·7H2O、MnSO4·4H2O,最后加入葡萄糖和 Tween-80。过滤分装,121℃高压灭菌15 min。在MRS液体培养基中添加1.5%琼脂制备固体培养基。
CM培养基(肉汤培养基):蛋白胨10 g,葡萄糖5 g,酵母膏 3 g,牛肉膏 3 g,MgSO4·7H2O 2 g,蒸馏水1 000 mL,pH 7.2。固体培养基琼脂粉用量为2%(15 g~20 g)。按照所需剂量,将配制好的培养基分装在三角瓶中,121℃高压灭菌30 min,备用。
BPM培养基(牛肉膏蛋白胨培养基):牛肉膏3 g,蛋白胨 10 g,NaCl 5 g,蒸馏水 1 000 mL,pH 7.0~7.2。固体培养基琼脂粉用量为2%(15 g~20 g)。按照所需剂量,将配制好的培养基分装在三角瓶中,121℃高压灭菌,备用。
LB培养基:胰蛋白胨10 g,酵母浸膏5 g,NaCl 5 g,蒸馏水1 000 mL,pH 7.0。固体培养基琼脂粉用量为2%(15 g~20 g)。按照所需剂量,将配制好的培养基分装在三角瓶中,121℃高压灭菌,备用。
1.2 试验方法
1.2.1 融合子菌落形态观察
将融合子接种到不同液体培养基中,37℃恒温培养24 h,革兰氏染色后进行镜检,观察菌体在液体培养基中的个体形态。
将融合子划线接种到固体培养基中,37℃恒温培养36 h,长出单菌落,挑取菌体,革兰氏染色后进行镜检,观察菌体在固体培养基上的个体形态。
1.2.2 融合子培养条件的确定
1.2.2.1 培养基对融合子生长量的影响
按照配方分别配制MRS液体培养基、CM液体培养基、BPM液体培养基、LB液体培养基,高压蒸汽灭菌。将活化好的融合子在无菌条件下按5%(体积分数)接种量接种于不同液体培养基中,37℃恒温培养,每3 h取样一次,测定OD600值。
1.2.2.2 起始pH值对融合子生长量的影响
分别配制pH值为4、5、6、7、8的4种液体培养基。将活化好的融合子以5%(体积分数)接种量在无菌条件下分别接种,37℃恒温培养12 h,测定其OD600值。
1.2.2.3 培养温度对融合子生长量的影响
分别配制4种培养基,将活化好的融合子以5%(体积分数)接种量在无菌条件下分别接种,并于20、25、30、35 ℃条件下培养 12 h,测定其 OD600值。
1.2.2.4 培养方式对融合子生长量的影响
1)通气状态摇床培养
将活化好的融合子以5%(体积分数)接种量在无菌条件下接种于不同液体培养基中,瓶口加盖棉塞,37℃恒温摇床培养,140 r/min,第12小时、第24小时取样测定OD值。
2)隔氧状态静置培养
在无菌条件下,将每种培养基各吸取9.5 mL置于10 mL灭菌的EP管中,然后将活化好的融合子各取0.5 mL接种于4种培养基的EP管中,摇匀后石蜡密封,37℃静置培养,每12 h取样一次测定OD值。
1.2.3 融合子产酸性能分析
1.2.3.1 定性产酸实验
将活化好的融合子以5%(体积分数)接种量在无菌条件下接种于不同液体培养基中,并分别滴入2滴溴甲酚紫溶液,37℃恒温培养,观察试管颜色变化。如果试管中的培养液的颜色由紫色变为黄色则说明菌种产酸,否则不产酸。
1.2.3.2 总酸测定
将活化好的融合子以5%(体积分数)接种量在无菌条件下接种于不同液体培养基中,37℃恒温培养。每隔12小时取不同培养基的培养液10 mL,分别加入蒸馏水20 mL,滴加2滴~3滴0.5%酚酞指示剂,用0.1 mol/L氢氧化钠标准溶液(现配现用)进行滴定,滴定至微红为止,根据公式计算出乳酸生成量。

式中:C表示氢氧化钠的浓度,mol/L;V1表示消耗氢氧化钠的体积,mL;V2表示加入样品的体积,mL;90.08表示乳酸的摩尔质量。
2 试验结果
2.1 融合子的个体形态
2.1.1 融合子在不同液体培养基中的个体形态
图1(A、B、C、D)分别为融合子在CM液体培养基、LB液体培养基、MRS液体培养基、BPM液体培养基中的个体形态。

图1 融合子在不同液体培养基中的个体形态(L:10×100)Fig.1 Individual morphology of fusant in different liquid culture medium
经显微镜观察可知,融合子为革兰氏阳性菌。在CM液体培养基中为杆状,呈长链状排列;而在LB液体培养基中为短杆菌,单个排列或成短链状排列;融合子在MRS液体培养基中菌数较少,可观察到的融合子菌体呈长链状排列;在BPM液体培养基中则为短杆菌,单个排列或成短链状排列。
2.1.2 融合子在不同固体培养基中的个体形态

图2 融合子在不同固体培养基中的个体形态(L:10×100)Fig.2 Individual morphology of fusant in different solid culture medium
图2(E、F、G)分别为融合子在BPM固体培养基、LB固体培养基、CM固体培养基中的个体形态。融合子在BPM固体培养基中为短杆菌,多为单个排列,产芽孢;在LB固体培养基为短杆菌,多为单个排列或短链状排列,产芽孢;在CM固体培养基中为单个排列或短链状排列并产芽孢的杆菌。
融合子在BPM固体培养基中为短杆菌,多为单个排列,产芽孢;在LB固体培养基为短杆菌,多为单个排列或短链状排列,产芽孢;在CM固体培养基中为单个排列或短链状排列并产芽孢的杆菌。
2.2 不同培养基对融合子生长的影响
图3为融合子在不同培养基中的生长曲线图。
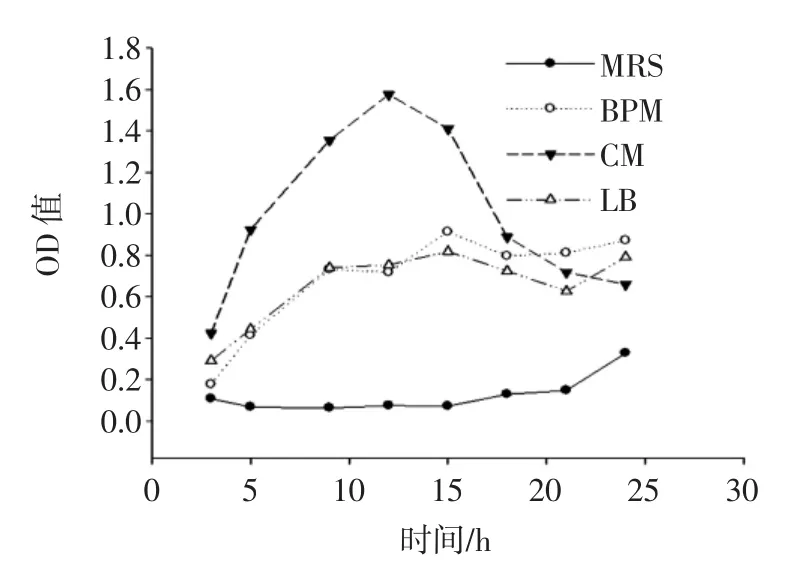
图3 融合子在不同培养基中的生长曲线Fig.3 Growth curve of fusant in different medium
由图3可知,融合子在MRS培养基中的OD值显著低于其他培养基(P<0.05),且延滞期较长;融合子在BPM培养基和LB培养基中,3 h~9 h为对数生长期,之后进入稳定期;在CM培养基中,3 h~12 h为对数生长期,12 h后进入衰亡期,12 h时其OD值(1.576±0.011)显著高于其他培养基(P<0.05),说明CM培养基对融合子的生长更加有利。
2.3 起始pH值对融合子生长量的影响
图4为培养基的不同pH值对融合子生长量的影响。
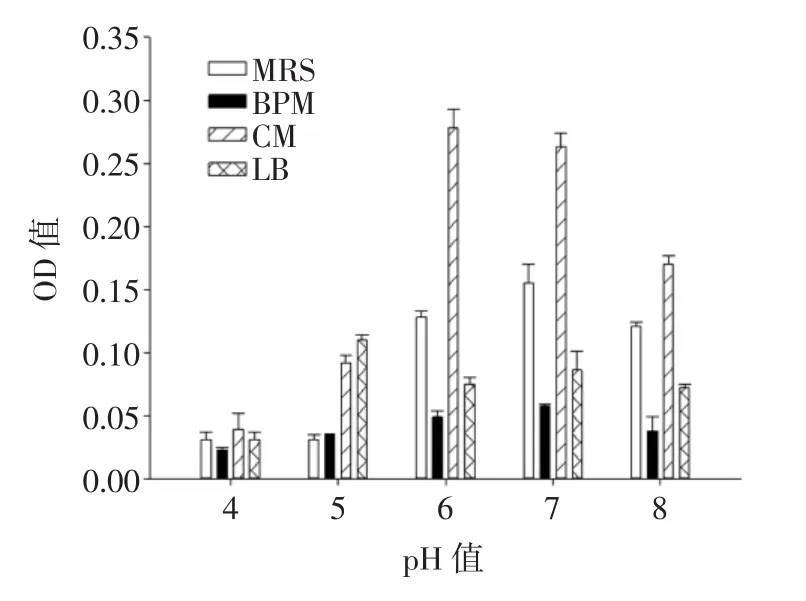
图4 培养基不同起始pH值对融合子生长量的影响Fig.4 Effect of different initial pH values on the growth of the fusant
如图4所示,融合子在MRS培养基、BPM培养基和LB培养基中生长,虽然pH值不同,OD值也不同,但是差异并不显著(P>0.05)。而在CM培养基中,pH值的差异导致OD值变化显著(P<0.05),随着pH值的升高,OD值呈现先升高后降低的趋势,在pH值为6时,融合子OD值最高,达到0.292。由图4可知,在MRS培养基、BPM培养基、CM培养基和LB培养基中,融合子的最适生长pH值分别为7、7、6、5。
2.4 培养温度对融合子生长量的影响
图5为培养温度对融合子生长的影响。
由图5可知,融合子在MRS培养基和BPM培养基中,培养温度对OD值的影响并不显著(P>0.05);在LB和CM培养基中,随着温度的增高,OD值均呈现先升高后降低的趋势,特别是温度对生长在CM培养基中的融合子影响显著,温度为37℃时,OD值显著增加并达到最高。由图可确定,在MRS培养基、BPM培养基、CM培养基和LB培养基中,融合子的最适生长温度分别为 37、35、37、35 ℃。
2.5 培养方式对融合子生长量的影响
将融合子接种于不同培养基中,分别采用有氧培养(通氧摇床)和厌氧培养(隔氧静置)两种方式进行培养,测定培养液OD值,结果如表1所示。
由表1可知,融合子在MRS培养基中隔氧静置培养12 h和24 h,所测得的OD值均高于通氧摇床培养测定的OD值。融合子在BPM培养基、CM培养基及LB培养基中,通氧摇床所测定的OD值均高于隔氧静置培养。说明在MRS培养基中,隔氧静置培养更有利于融合子生长;而在BPM培养基、CM培养基及LB培养基中,通氧培养方式更为适合。
2.6 融合子产酸性能分析
2.6.1 定性产酸实验结果
通过融合子溴甲酚紫显色反应结果发现:MRS培养基和CM培养基均呈黄色,说明融合子在这两种培养基中能够产酸;BPM培养基和LB培养基呈紫色,说明融合子在这两种培养基中产酸不佳。
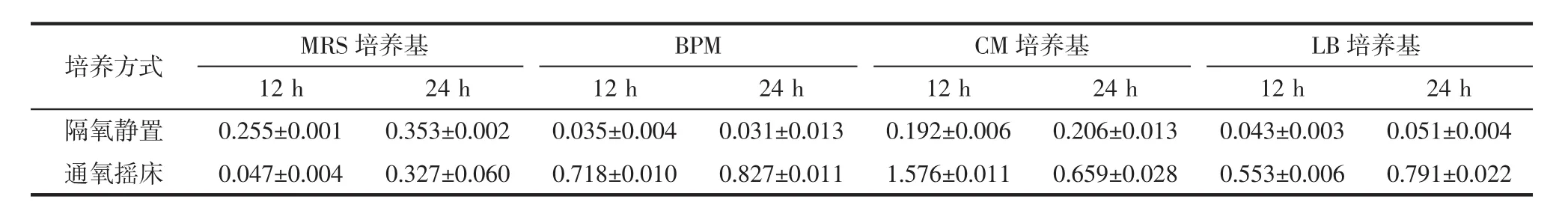
表1 培养方式对融合子生长量的影响Table 1 Effects of culture methods on the growth of fusant
2.6.2 融合子总酸测定结果
融合子在不同培养基中的乳酸生成量如图6所示。
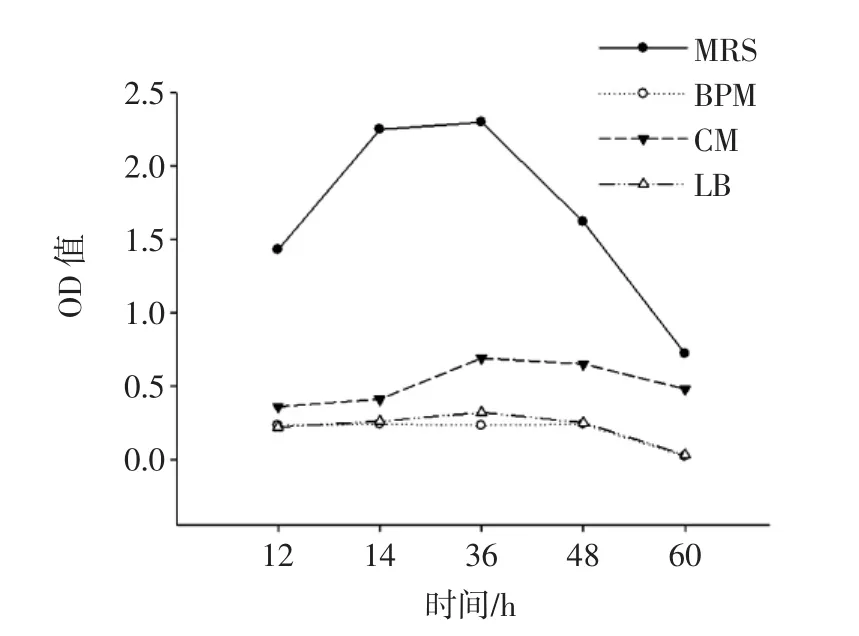
图6 不同培养基中融合子乳酸生成量测定Fig.6 Determination of lactic acid production in different medium
由图6可知,融合子在4种培养基中的乳酸生成量均呈现先升高后降低的趋势。在培养前期,培养液中的总酸积累较少,酸度环境较为适宜融合子的生长,培养基中乳酸量不断升高;培养一段时间后,培养液中总酸积累量较高,酸度上升,此时酸度环境可能会对融合子的生长产生抑制,甚至发生自溶,从而导致产酸量下降。在不同培养时段,融合子在MRS培养基中乳酸生成量显著高于其他培养基,培养36 h,乳酸生成量最高,达到2.30 g/L。
3 讨论与结论
对于微生物来说,即使是同一菌株,在不同培养条件下进行培养,其生长情况和代谢方式也不尽相同[10]。目前,关于嗜酸乳杆菌和地衣芽孢杆菌培养特性的相关报道已经较为详尽,而嗜酸乳杆菌-地衣芽孢杆菌融合子的培养特性尚未见报道。嗜酸乳杆菌为乳酸菌属,一般采用MRS培养基37℃培养。地衣芽孢杆菌的最佳生长温度为35℃,最适pH值为7.0。本试验发现CM培养基(肉汤培养基)成为最适合嗜酸乳杆菌-地衣芽孢杆菌融合子生长的培养基,其次为BPM培养基和LB培养基。CM培养基是最经典的细菌培养基之一,可以用于各种细菌的培养。BPM琼脂培养基和LB培养基可为微生物生长提供氮源、碳源、磷酸盐、维生素和无机盐。MRS培养基是用于鉴别、分离乳酸菌的专用培养基[11]。本试验通过镜检观察发现融合子在液体和固体培养基上的菌落形态与亲本的菌落形态明显不同,这是基因重组的结果[12-13]。基因重组不仅导致融合子的菌落形态发生变化,而且最适培养基的种类也发生了改变。嗜酸乳杆菌在MRS培养基中生长良好,但是与地衣芽孢杆菌融合后,CM成为了最适培养基,培养方式也以通氧摇床培养为佳。但是就产酸性能分析,融合子在MRS培养基中的产酸量最大,说明MRS培养基更有利于融合子的繁殖代谢,产生包括乳酸在内的次级产物。
嗜酸乳杆菌和地衣芽孢杆菌的融合子兼具两亲本的优良特性。乳酸菌和地衣芽孢杆菌都是对人体有益的益生菌,融合子既具备了地衣芽孢杆菌较强的产蛋白酶、产淀粉酶能力以及形成芽孢的能力,也具有了乳酸菌耐受胃部的低酸环境以及肠道前段高胆盐环境的能力,肠道定殖能力大大增强[14],同时还克服了其不易培养和制剂化的缺陷,该融合子在厌氧和有氧环境中都能很好生长,可用于发酵乳、发酵肉制品、奶酪等食品的生产,也可用于L-乳酸、蛋白酶、淀粉酶等制剂的发酵生产,并能作为新一代乳酸菌或地衣芽孢杆菌整肠生制剂生产用的菌株。
通过本试验研究可知在常规培养条件下,CM培养基最有利于融合子的生长。CM、MRS和LB培养基的适宜初始pH值分别为6、7和5,BPM培养基初始pH值对融合子的生长繁殖影响不显著。在CM培养基中,37℃更适于融合子生长,其他培养基的最适培养温度均为35℃。除MRS培养基适合隔氧静置培养外,其他3种培养基则配以通氧摇床培养方式。MRS培养基有利于融合子发酵产酸,第36小时时,乳酸生成量最高,达到2.30 g/L。
参考文献:
[1]LI S,MA C J,GONG G G,et al.The impact of onion juice on milk fermentation by Lactobacillus acidophilus[J].LWT-Food Science and Technology,2016,65(1):543-548
[2]马鑫,郭宏,张宝国,等.地衣芽孢杆菌作为饲料添加剂的研究进展[J].中国饲料添加剂,2011(2):10-13
[3]赵春苗,徐春厚.原生质体融合技术及在微生物育种中的应用[J].中国微生态学杂志,2012,24(4):379-382
[4]王登宇,臧威,孙剑秋,等.细菌原生质体融合育种技术及其应用进展[J].中国酿造,2008,27(7):1-5
[5]邱静,罗水忠,姜绍通,等.高产L-乳酸米根霉的原生质体制备与再生条件研究[J].食品科学,2011,32(9):174-178
[6]王成涛,牛天贵,岳晓禹,等.应用原生质体融合技术构建高效降解胆固醇的乳酸菌[J].食品与发酵工业,2002,28(3):1-5
[7]吕兵,项建琳.应用原生质体融合技术改善双歧杆菌的耐氧性[J].食品科学,2005,26(4):83-86
[8]王玉华,张桂荣,刘景圣.原生质体融合提高嗜酸乳杆菌耐酸及耐胆盐能力[J].食品科学,2006,27(3):96-99
[9]黎永学,张德纯,李代昆.双歧杆菌和酿酒酵母原生质体融合子筛选方法的探讨[J].食品科学,2006,27(2):84-86
[10]COURTIN P,RUL F.Interactions between microorganisms in a simple ecosystem:yogurt bacteria as a study model[J].Le Lait,2003,84(1/2):125-134
[11]杜连祥.工业微生物学实验技术[M].天津:天津科学技术出版社,1992:70-90
[12]霍乃蕊,韩克光.细胞融合技术的发展及应用[J].激光生物学报,2006,15(2):209-213
[13]赵春苗,徐春厚.原生质体融合技术及在微生物育种中的应用[J].中国微生态学杂志,2012,24(4):379-382
[14]曾献春,孟冬丽.乳酸菌原生质体制备与再生研究[J].食品科学,2006,27(10):269-272

