乳酸杆菌作用下香蕉抗性淀粉的体外发酵研究
白永亮,凌志洲,林燕丹,夏雨
(1.佛山科学技术学院食品科学与工程学院,广东佛山 528000;2.咀香园健康食品(中山)有限公司,广东中山528437)
一个健康成人体内的微生物细胞数量共有1014个,其中大量的微生物寄居在肠道中[1-2]。乳酸杆菌通常定植在人或动物的口腔和肠道中,属于革兰氏阳性无芽孢菌,一般为细长的杆状、大多呈链状排列[3]。作为肠道内最有利的一种益生菌,乳酸杆菌对人体的正常代谢活动、营养吸收起到非常重要的作用。乳酸杆菌可以通过其代谢产物降低肠道的pH值,从而抑制有害菌生长,具有减少体内毒素,保护肠道黏膜,调节机体免疫力,并预防一些胃肠道疾病的发生[4]。
人体超过50%人的饮食热量来源于淀粉基质食品,而淀粉基质食品的质量和数量直接影响到人体血糖与体内代谢平衡。抗性淀粉(Resistant starch,RS)的发现被认为是最近二十年来碳水化合物在人体健康应用方面的重大进展[5]。抗性淀粉又称抗酶解淀粉及难消化淀粉,在人体小肠中不被消化吸收,在大肠内被微生物利用发酵产酸,同时厌氧微生物降解有机质产生代谢物用于菌体生长,引起微生物菌群的变化[5-7]。近年来的研究已初步证明,RS在大肠被生理性细菌发酵产生多种短链脂肪酸(Short chain fatty acid,SCFA)和气体,有助于降低大肠pH值,减少结肠癌发病率,抑制致病菌生长和繁殖[8],同时促进肠道内益生菌的生长和繁殖[9-10]。SCFAs对宿主能能产生重要的生理作用,如降低胞内pH值,促进矿物质吸收,减少结肠内次级代谢产物胆汗酸的生成,以及影响大肠内微生物菌群分布等[11-14]。在SCFAs中,丁酸是大肠细胞优先的能量来源,能抑制肠癌细胞的扩散[11],研究发现其与糖尿病、结肠癌和肥胖有关[5,15-20]。
抗性淀粉可分为4种类型:RS1是物理包埋淀粉,RS2天然抗性淀粉,RS3是回生淀粉和RS4是化学改性淀粉[21]。不同来源抗性淀粉在肠道中发酵情况不同,谢涛[22]等研究了4种淀粉样品都能促进短链脂肪酸(SCFAs)总量的增加,其中土豆回生淀粉(RS3)、交联淀粉(RS4)与 Novelose 230(RS2)特别有利于促进丁酸的生成。土豆回生淀粉(RS3)与交联淀粉(RS4)能够改善人体肠道菌群的分布、促进SCFAs特别是丁酸的生成。青香蕉富含天然抗性淀粉,以其致密的颗粒结构和晶体结构而不能被人体小肠消化吸收,被认为是第二类型的抗性淀粉(RS2)[23]。本试验模拟香蕉抗性淀粉在小肠液、胃液中的消化过程,研究消化后香蕉抗性淀粉对乳酸杆菌的生长繁殖影响以及乳酸杆菌对香蕉抗性淀粉的体外发酵作用,为益生菌制剂提供理论基础。
1 材料与方法
1.1 材料与试剂
青香蕉:广州华工市场;EMB琼脂培养基、肠道增菌肉汤:青岛高科园海博生物技术有限公司;甲酸、乙酸、丙酸、丁酸标准品,正己烷(色谱纯)、乳酸检测试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
5975-7890型气相色谱仪:安捷伦科技有限公司;TDL-5-A离心机:上海安亭科学仪器厂;UV3010分光光度计:日本日立公司;DGG-9070B电热恒温鼓风干燥箱:上海森信实验仪器有限公司。
1.3 试验方法
1.3.1 香蕉抗性淀粉的制备
选择采前8成~9成熟的青香蕉,彻底清洗干净后去皮,切片并置于一定比例的VC、柠檬酸和亚硫酸氢钠护色液中浸10 min,将香蕉肉与护色液按一定比例(1∶2)混合后打浆,4 000 r/min离心15 min。取沉淀在50℃烘干,打粉后过100目筛制得香蕉抗性淀粉,密封备用。
1.3.2 消化液的制备
分别配制人工胃液和人工肠液。
1.3.2.1 人工胃液配制
取稀盐酸(9.5%~10.5%)10 mL,加蒸馏水稀释至体系pH值为1.5左右。然后按照1 g/100 mL的质量浓度比加入胃蛋白酶,充分溶解后用孔径0.20 μm微孔滤膜过滤除菌,即得人工胃液。
1.3.2.2 人工小肠液配制
取磷酸二氢钾6.8 g,用900 mL水溶解后,再用0.4%的氢氧化钠溶液调pH值至6.8左右,然后分别加入10 g胰蛋白酶和10 g胰淀粉酶,充分溶解后,最后加水定容至1 000 mL,用孔径0.20 μm微孔滤膜过滤除菌,备用。
1.3.3 消化模拟
采用Jenkins[24]提出的In-Vitro消化模型进行消化模拟试验。分别称取一定量的青香蕉淀粉浸入人工胃液、人工小肠液中,置于37℃水浴中振荡。隔一定时间取样,利用渗析袋模拟人体肠道来分离淀粉的消化产物,并将渗析袋内的残留物低温(50℃以下)烘干后干燥保存备用。
1.3.4 乳酸杆菌的富集培养
取健康大鼠粪便,将粪便样品按质量比1∶10的比例接入已灭菌的生理盐水,充分震荡,用四层无菌纱布过滤,制成样品液,梯度稀释后接种于EMB培养基,接种量为1 mL。于37℃厌氧培养48 h,选择性培养乳酸杆菌。选择性培养后,分别接种于9 mL肠道增菌肉汤(EE),37℃富集培养24 h。
1.3.5 香蕉抗性淀粉对乳酸杆菌生长繁殖的影响
取菌液1 mL,加入到装有9 mL PBS缓冲液(pH7.4)的EP管中,混匀。然后,按菌落计数的方法梯度稀释,取1 mL接种于添加有胃液和小肠液消化后香蕉抗性淀粉(20 g/L)的EMB选择性培养基上,培养一定时间后菌落计数,以不添加香蕉抗性淀粉为空白对照组,观察菌落生长状况。
1.3.6 建立体外发酵模拟试验
上述富集培养结束后,立即取菌液接种于含胃液和小肠液消化后的香蕉抗性淀粉的发酵培养基。分别厌氧培养 0 、4、8、12、16、20 h 后,测定其管内溶液 pH值,同时将管内培养液转移入已灭菌的15 mL聚乙烯管,加入0.5 mL 2%CuSO2溶液将菌杀死,于-20℃保存,测定短链脂肪酸和乳酸。
1.3.7 短链脂肪酸的提取及检测[25]
发酵液离心(3 000 r/min,15 min)。吸取5 mL上清液,14 mL 0.36 mol/L HClO4和 13.5 mL 1 mol/L NaOH,剧烈振荡。加入2.5 mL 5 mol/L磷酸,剧烈振荡。加入15 mL 1%浓H2SO4的甲醇溶液,70℃回流30 min。然后加入15 mL冷的正己烷提取。吸取1 μL有机层,上柱分析。
气相色谱测定条件:载气为N2,分流比80∶1,流速64 mL/min。采用 ZB-WAX,30 m×250 μm×0.25 μm。检测器为FID,检测器温度为260℃。升温程序:50℃保持5 min,然后以5℃/min升温到100℃,再以20℃/min升温到180℃,共运行19 min。
1.3.8 乳酸检测
1.3.8.1 样品预处理
将样品发酵液、培养液用生理盐水稀释到适当浓度,使测定绝对OD值(测定OD-空白OD)在0.05~0.35之间。
1.3.8.2 测定操作
按表1加样混匀后,于530 nm,1 cm光镜,双蒸水调零,测定各管吸光值。乳酸测定见表1。
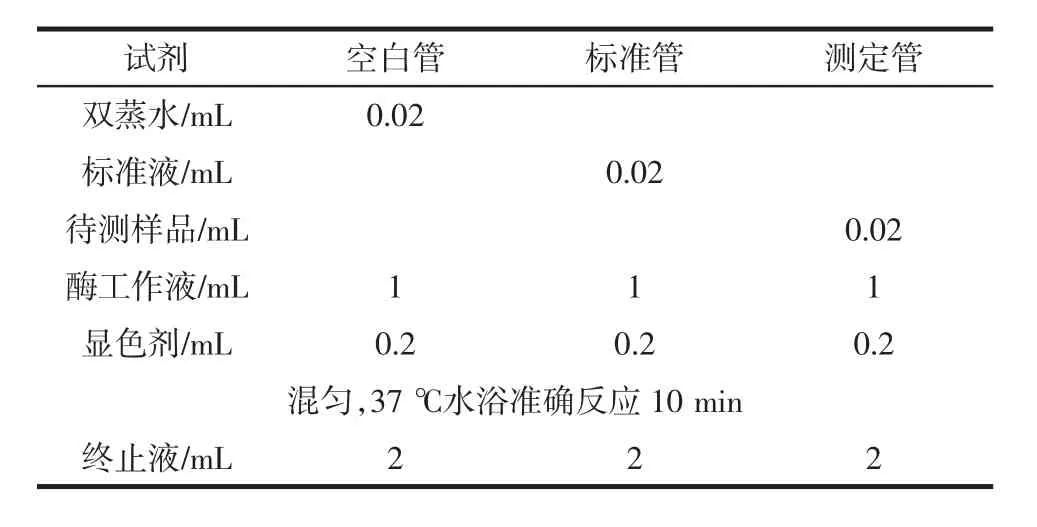
表1 乳酸测定Table 1 Determination of lactic acid
1.3.8.3 乳酸含量计算

2 结果与分析
2.1 香蕉抗性淀粉对乳酸杆菌生长繁殖的影响作用
2.1.1 香蕉抗性淀粉对乳酸杆菌的生长状况的影响
图1为香蕉抗性淀粉对乳酸杆菌生长状况的影响,香蕉抗性淀粉已经过胃液和小肠液消化处理,空白对照培养基不添加香蕉抗性淀粉。
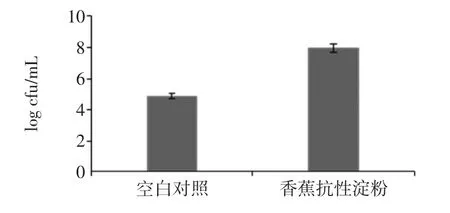
图1 乳酸杆菌的生长状况Fig.1 The growth of lactobacillus
由图1可看出,添加香蕉抗性淀粉后,乳酸杆菌的数量明显增加。由此可知,香蕉抗性淀粉有利于乳酸杆菌的生长繁殖,可作为其碳源利用。虽然目前关于抗性淀粉是如何促进肠道菌群生长的,还未知其分解机理。但根据我们前期的研究发现,经肠道菌利用后的淀粉颗粒表面明显形成了空洞,这证明了抗性淀粉确实作为肠道菌的唯一碳源被利用。此外,还有可能是前期的人工胃液和小肠液的处理,促进了抗性淀粉可被利用的程度[26]。
2.1.2 培养液pH值的变化
乳酸杆菌富集培养后接种于含有消化后的香蕉抗性淀粉发酵培养基,厌氧培养 0、4、8、12、16、20 h 后发酵液的pH值变化情况如图2。

图2 乳酸杆菌发酵液的pH值变化Fig.2 Changes in pH of lactobacillus fermentation
由图2可知,乳酸杆菌在发酵过程中发酵液的pH值随培养时间的延长而降低,从0 h的7.2下降到20 h后的4.8。可见乳酸杆菌能很好地利用香蕉抗性淀粉产酸,维持肠道的酸性环境。
2.2 乳酸杆菌对香蕉抗性淀粉的发酵特性分析
胃液和小肠液消化后的香蕉抗性淀粉经乳酸杆菌分别发酵 4、8、12、16、20 h 后,发酵液中各种短链脂肪酸含量和总酸含量的变化情况如图3和图4。
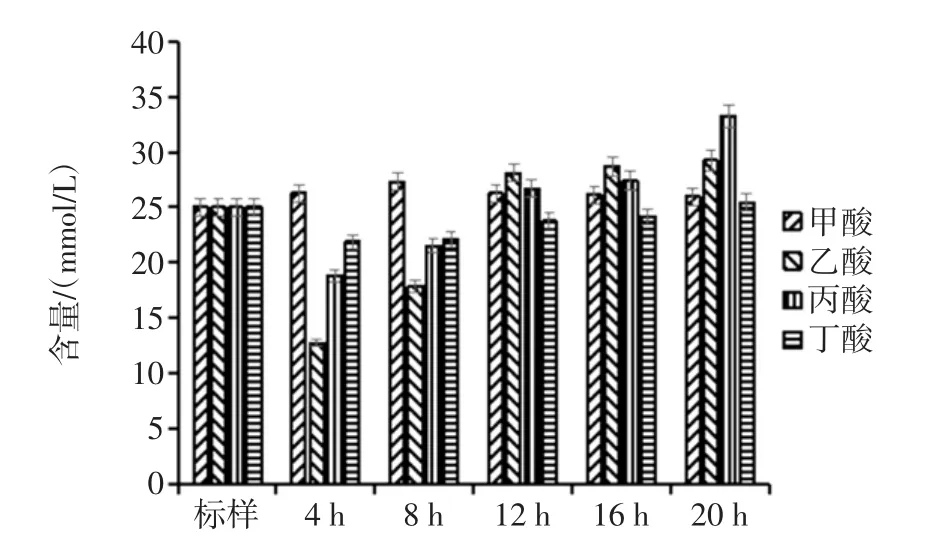
图3 乳酸杆菌发酵液中SCFA含量的变化Fig.3 Changes of SCFA content of lactobacillus fermentation fluid
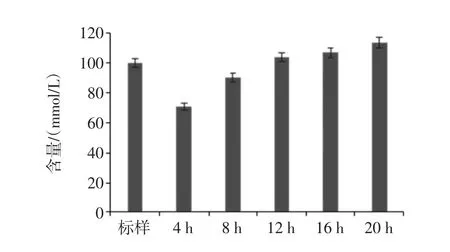
图4 乳酸杆菌发酵液中SCFA的总酸含量变化Fig.4 The total acid content of SCFA in lactobacillus fermentation fluid
由图3可知,发酵液中乙酸、丙酸和丁酸的含量均随着发酵时间的延长而增加。甲酸在发酵4 h后基本稳定在26 mmol/L左右;乙酸在发酵12 h时有明显增加,12 h后增加速率减缓,20 h后达到29.23 mmol/L;丙酸含量在发酵过程中稳步提升,发酵20 h后可达到33.28mmol/L;丁酸含量在发酵4h时达到21.88mmol/L,之后缓慢增加,发酵20 h后达到25.41 mmol/L;发酵液中短链脂肪酸的总酸含量随着发酵时间的延长均有所增加,且增长速率较为一致。发酵20 h后,总酸含量达到113.46 mmol/L。总体来看,乳酸杆菌能够发酵香蕉抗性淀粉产生短链脂肪酸,但产酸能力略低于双歧杆菌[27]。且随着发酵时间的延长,乙酸和丙酸的产量增长较明显,这与相关文献的报道结果基本一致[28-29]。
短链脂肪酸的种类和数量主要受发酵底物的种类、数量、降解速率以及肠道菌群及宿主生理状态等因素的影响。不同酵解底物产生的短链脂肪酸总量和比例不同,对肠道生理功效也不相同。在机体内大部分乙酸被吸收入血液,进入肝脏的代谢,作为周边组织的能源,是机体从小肠不能吸收的碳水化合物中获取能量的主要途径。丙酸经结肠吸收后主要由肝脏代谢用作能源,并且能够抑制胆固醇的合成。
2.3 发酵过程中产生的乳酸含量变化
经胃液和小肠液消化后的香蕉抗性淀粉经乳酸杆菌分别发酵 4、8、12、16、20 h 后,发酵液中乳酸含量变化情况如图5。
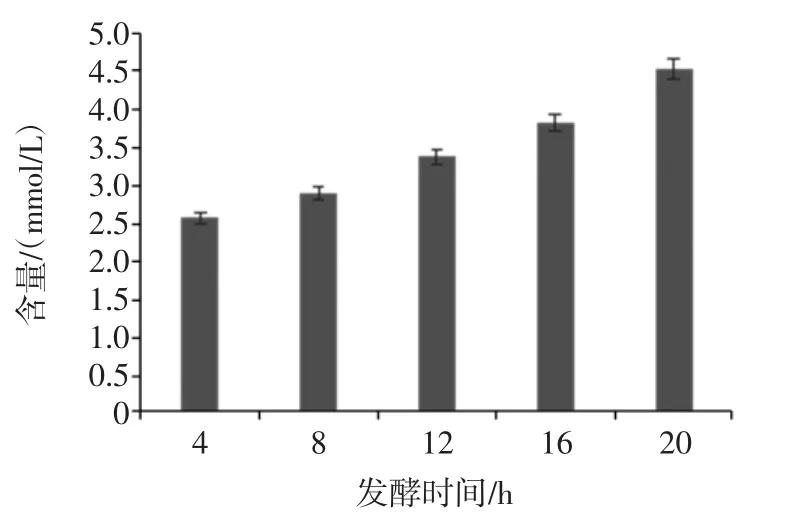
图5 乳酸杆菌发酵液中乳酸含量的变化Fig.5 The change of lactobacillus lactic acid content in the fermented liquid
发酵过程中乳酸含量随着发酵时间的延长而缓慢增加,增长速率基本本不变。发酵20 h后,乳酸含量达到4.53 mmol/L。说明乳酸杆菌在发酵香蕉抗性淀粉时产生乳酸,但产量均在5 mmol/L以下,产乳酸的能力明显低于双歧杆菌[27]。乳酸产量是反映乳酸杆菌生理活性的重要指标,有研究发现乳酸可能是直肠菌群发酵利用香蕉淀粉产生的中间代谢物,能为肠道其它菌群提供能源[30]。
2.4 消化途径对发酵产物的影响
图6为不同消化处理后香蕉抗性淀粉发酵产物(短链脂肪酸)的含量分析。
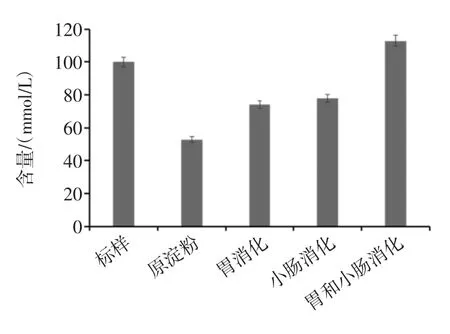
图6 消化途径对发酵产物的影响Fig.6 The effects of digestive pathways on fermentation products
由图6可看出,4种样品的发酵产物中总酸含量大小依次为:胃液和小肠液消化后>小肠液消化后>胃液消化后>原淀粉。分别经胃液消化的香蕉淀粉和经小肠液消化的香蕉抗性淀粉总酸产量相差不大,而经胃液和小肠液消化的香蕉淀粉的总酸含量提高较为明显,达到112.95 mmol/L。
3 结论
我国香蕉资源丰富,且青香蕉富含天然抗性淀粉和膳食纤维,是制备高附加值抗性淀粉产品的良好来源。本试验结果表明,培养基中添加香蕉抗性淀粉后,乳酸杆菌的数量明显增加,发酵20 h后,乳酸杆菌短链脂肪酸总酸含量达到113.46 mmol/L,乳酸含量达到4.53 mmol/L。说明香蕉抗性淀粉能够促进对乳酸杆菌的生长繁殖;通过体外消化和发酵模拟的研究发现,胃液和小肠液消化均使香蕉抗性淀粉发酵产物(短链脂肪酸)的含量比原淀粉高,表明胃液和小肠液的消化提高了香蕉抗性淀粉在大肠中的发酵作用,消化后的香蕉抗性淀粉更有利于肠道微生物的利用;随着发酵时间的延长,发酵产物中甲酸的含量变化不大,而乙酸、丙酸、丁酸、短链脂肪酸的总酸和乳酸含量均有提高。本文基于香蕉抗性淀粉的发酵特性,初步研究了香蕉抗性淀粉与乳酸杆菌的相互作用,但对香蕉抗性淀粉的酵解机理还有待进一步研究。而香蕉抗性淀粉如何通过发酵产生短链脂肪酸进一步发挥相应的生理功能也需进一步研究。
参考文献:
[1]魏晓,刘威,袁静,等.人类肠道菌群与疾病关系的元基因组学研究进展[J].中国微生态学杂志,2011,23(1):75-81
[2]陶金华,狄留庆,单进军,等.肠道微生态与中药有效成分代谢的相互作用[J].中草药,2008,39(12):1902-1903
[3]LEBEER S,VANDERLEYDEN J,DEK,et al.Host interactions of probiotic bacterial surface molecules:compari-son with commensals and pathogens[J].Nature R eviewsMicrobiology,2010,8(3):171-184
[4]RUBIO R,JOFRE A,MARTIN B.Characterization of lactic acid bacteria isolated from infant faeces as potential probiotic starter culturesforfermentedsausages[J].FoodMicrobiology,2014,38:303-311
[5]Shi Y C,Maningat C C,Shi Y C,et al.Resistant starch sources,applications and health benefits[M].New York:John Wiley&Sons,2013:131-142
[6]尚晓娅,高群玉,杨连生.抗性淀粉对糖脂以及肠道代谢影响的研究进展[J].食品工业科技,2005,26(4):179-180
[7]Higgins J A,Brown I L.Resistant starch:A promising dietary agent for the prevention/treatment of inflammatory bowel disease and bowel cancer[J].Curropin Gastroenterol,2013,29:190-194
[8]李敏,杨晓光,朴建华.抗性淀粉生理功能的研究研究进展[J].卫生研究,2008,37(5):640-643
[9]何梅,洪洁,杨月欣,等.抗性淀粉对大鼠肠道菌群的影响[J].卫生研究,2005,34(1):85-87
[10]RIDLON J M,HYLEMON P B.A potential role for resistant starch fermentation in modulating colonic bacterial metabolism and colon cancer risk[J].Cancer Biol Ther,2006,5(3):273-274
[11]Topping D L,Clifton P M.Short chain fatty acids and human colonic function:Roles of resistant starch and non-starch polysaccharides[J].Physiol Rev,2001,81:1031-1064
[12]Schwiertz A,Lehman U,Jacobasch G,et al.Influence of resistant starch on the SCFA production and cell counts of butyrate producing Eubacterium spp.in the human intestine[J].J Appl Microbiol,2002,93:157-162
[13]Hylla S,Gostner A,Dusel G,et al.Effect of resistant starch on the colon in healthy volunteers:possible implications for cancer prevention[J].Am J Clin Nutr,1998,67:136-142
[14]Edward C A,Gibson G,Champ M,et al.In vitro method for quantification of the fermentation of starch by human faecal bacteria[J].J Sci Food Agr,1996,71:209-217
[15]Wei C,Qin F,Zhu L,et al.Microstructure and ultrastructure of high-amylose rice resistant starch granules modified by antisense RNA inhibition of starch branching enzyme[J].Journal of Agricultural&Food Chemistry,2010,58(2):1224-1232
[16]PETERS U,SINHA R,CHATTERJEE,et al.Dietary fibre and colorectal adenoma in a colorectal cancer early detection programme[J].The Lancet,2003,361:1491-1495
[17]JOHNSON I,LUND E.Review article:nutrition,obesity and colorectal cancer[J].Aliment Pharm Therap,2007,26(2):161-181
[18]BACKHED F,MANCHESTER J K,SEMENKOVICH C F,et al.Mechanisms underlying the resisitance to dietinduced obesity in germ-free mice[J].Proceedings of the National Acadmy of Sciences of the United States of America,2007,104(3):979-984
[19]LEYRE,TUMBAUGH P J,KLEIN S,et al.Microbial ecology:human gut microbes associated with obesity[J].Nature,2006,444:1022-1023
[20]Stewart M L,Zimmer J P.A High Fiber Cookie Made with Resistant Starch Type 4 Reduces Post-Prandial Glucose and Insulin Responses in Healthy Adults[J].Nutrients,2017,9(3):237
[21]Brown I L.Applications and uses of resistant starch[J].Journal of Aoac International,2004,87(3):727-732
[22]谢涛,祝红,李晓文,等.土豆抗性淀粉的体外消化与发酵[J].食品科技,2017,24(5):35-40
[23]Zhang P Y,Zhang Q,Whistler R L.L-arabi nose release from arabinoxylan and arabinogalactan under potential gastric acidities[J].Cereal Chemistry,2003,80(3):252
[24]Jenkins D,Thorne M,Wolever T.The effect of starch-protein interaction in wheat on the glycemic response and rate of in vitro digestion[J].Am J Clin Nutr,1987,45(5):946-951
[25]DRZIKOVA B,DONGOWSKI G,GEBHARDT E,et al.The composition of dietary fibre-rich extrudates from oat affects bile acids binding and fermentation in vitro[J].Food Chemistry,2005,90(12):181-192
[26]Bae C H,Park M S,Ji G E,et al.Effects of phosphorylated crosslinked resistant corn starch on the intestinal microflora and short chain fatty acid forming during in vitro human fecal batch culture[J].Food SciBiotechnol,2013,22(6):1649-1654
[27]彭真福,陈庆发,白永亮,等.双歧杆菌对香蕉抗性淀粉的体外发酵研究[J].食品科技,2015,40(1):2-5
[28]Madeline V,Catherine D,Rebecca M,et al.Effect of oligosaccharides and fiber substitutes on shout-chain fatty acid production by human faecal microflora[J].Anaerobe,2006,6:87-92
[29]Schneider S M,Fernand G P,Rodolphe A,et al.Effects of total enteral nutrition supplemented with a multi-fiber mix on faecal shortchain fatty acids and microbiota[J].Clin Nutr,2006,25:82-90
[30]Molist F,Segura A G D,Gasa J,et al.Effects of the insoluble and soluble dietary fibre on the physicochemical properties of digesta and the microbial activity in early weaned piglets[J].Animal Feed Science&Technology,2009,149(3/4):346-353

