乌鳢鱼片冷冻贮藏过程中品质变化规律研究
马文慧,周宣宣,彭禛菲,程晓通,张文佳,许倩,2,*
(1.塔里木大学生命科学学院,新疆阿拉尔843300;2.南疆特色农产品深加工兵团重点实验室,新疆阿拉尔843300)
乌鳢(Channa argus)俗称黑鱼,其作为药用具有祛风治疳、补脾益气、滋补调养、生肌补血,促进伤口愈合等功效[1]。鱼类和其他海产品是高度易腐食品,由于其高水分活度,中性pH值、结缔组织含量低、自溶酶的存在导致其不良气味和口感的迅速变化[2],目前,国内外对乌鳢的研究主要是针对养殖技术[3]、鉴定方法[4-6]、营养成分[7-10]和相关酶功能[11]等方面的研究。对于贮藏乌鳢鱼片的研究仅见阙婷婷[12]利用不同低温保鲜方法对乌鳢鱼肉理化性质以及组织结构方面的研究,无冻藏及其营养价值相关研究。目前全球范围内采用的低温冷链贮运一般选择0℃~4℃的冷藏保鲜,0℃~-2℃的冰温保鲜,-2℃~-4℃的微冻保鲜以及-18℃~-40℃的冻藏保鲜这个温度带范围[13]。由于采取低温冷链长距离运输,成本高,覆盖面窄,贮藏期短,运输工具有限,导致冷藏保鲜不能广泛推广。因此,本试验以乌鳢鱼片为原料,采用冷冻贮藏方式,在乌鳢鱼片贮藏期间以理化指标评价蛋白质、脂肪及新鲜度的变化情况,了解长期冻藏乌鳢鱼片品质变化的内在原因及机制,并通过比较得出长期冻藏时间内的较好的冷冻保鲜方法,为乌鳢长期冷冻贮藏保鲜提供基础理论依据。
1 材料与方法
1.1 材料与仪器
乌鳢鱼由阿拉尔农贸市场提供,其平均体重为(1 923.04±173.67)g,平均体长为(42.13±1.93)cm,活体运送至实验室。
十二烷基硫酸钠、三羟甲基氨基甲烷(高纯试剂):北京赛因坦科技有限公司;硫酸铜、乙二胺四乙酸、钼酸铵:天津市北辰方正试剂厂;酒石酸钾钠、尿素、氯化钙、盐酸、六水氯化镁、抗坏血酸:天津市致远化学试剂有限公司;氢氧化钠:沧州津盛化工产品有限公司;氯化钠、硫酸:北京化工厂;马来酸、2-硝基苯甲酸、腺嘌呤核苷三磷酸:上海山普化工有限公司,以上均为分析纯。
TU-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;BSA2202S-CW电子天平:赛多利斯科学仪器(北京)有限公司;TGL-20K高速台式离心机:上海安亭科学仪器厂;TGL-20KR高速台式冷冻离心机:上海安亭科学仪器厂;F6/10手持式高速匀浆机:上海拓赫机电科技有限公司;PHS-3C PH计:上海仪电科学仪器股份有限公司。
1.2 试验方法
1.2.1 样品处理
乌鳢鱼活体运至试验室后重击致死、去鳞、去内脏,以垂直脊柱方向横切切片,厚度约为2 cm,低温流水清洗干净,装于聚乙烯保鲜袋内置于冰箱,分别进行-18℃和-40℃贮藏20周,每两周从两组中随机选取3片,(20±2)℃流水解冻至温度达到0℃以上后进行各项指标的测定,每个指标重复3次。
1.2.2 解冻损失的测定
参照王航[14]测定解冻损失的方法。乌鳢鱼解冻前称重为W1,(20±2)℃流水解冻后,将保鲜袋中的解冻流失的汁液倒掉,肉样用吸水纸吸干,再次称重W2,解冻汁液流失率按照下式计算:
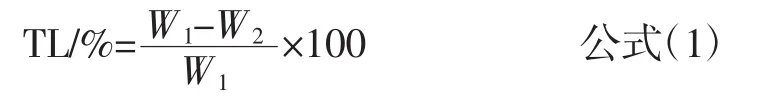
式中:TL为解冻汁液流失率,%;W1为解冻前质量,g;W2为解冻后质量,g。
1.2.3 双缩脲法测定蛋白质含量
参照王航[14]的方法。
1.2.4 盐溶性蛋白含量的测定
参照Pan等[15]建立的方法并稍作修改,取1 g鱼肉,加入0.05 mol/L NaCl-20mg/mol Tris-马来酸溶液15 mL 匀浆后,10 000 r/min离心 20 min,静置 0.5 h,离心2次取沉淀,再加入15 mL冰冷的0.6 mol/L NaCl-20mg/mol Tris-马来酸溶液,匀浆10 s,4℃提取1.5 h。然后4℃下,10 000 r/min离心30 min,取上清液搅拌均匀,计算盐溶性蛋白含量(mg/g)。
1.2.5 盐溶性蛋白Ca2+-ATPase活性
参照孔春丽[16]的试验方法并稍作修改,取5 mL蛋白溶液加热至中心温度为80℃,取出放入冰水中冷却,用于Ca2+-ATPase活性及巯基含量的测定。Ca2+-ATPase活性的表示方法为1mg酶蛋白1 min内生成的无机磷酸量,盐溶性蛋白Ca2+-ATPase活性按照下式计算:
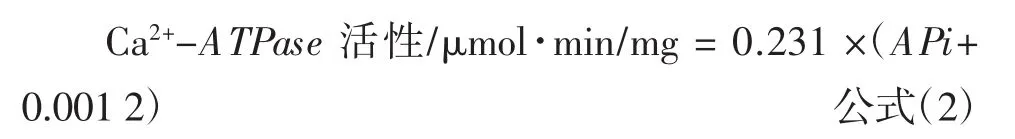
式中:APi为无机磷酸量,μmoL。
1.2.6 总巯基含量的测定
参照Kobayashi等[17]的方法并稍作修改,取0.5 mL 4mg/mL的盐溶性蛋白溶液加到4.5 mL pH6.8,0.2 mol/L Tris-HCl缓冲液中。取4 mL混合液,加入0.5mL0.2mol/L Tris-HCl,pH 8.0溶液,于 40℃下温育 25 min,412 nm下测定其吸光度。空白组用0.6 mol/L KCl,pH 7.0代替。
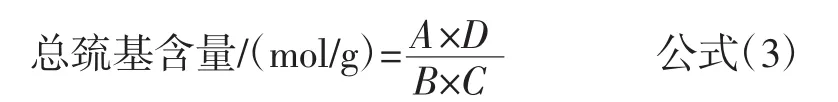
式中:A为吸光值;B为待测蛋白浓度,mg/mL;C为分子吸光系数,其值为13 600 L/(mol·cm);D为稀释倍数。
1.2.7 水溶蛋白含量测定
依据Tadpitchayangkoon等[18]的方法稍作改动,搅碎的鱼肉与冰冷蒸馏水以1∶5(g/mL)的比例混合,匀浆2 min。匀浆后的溶液在4℃的冰箱中提取30 min,再在4℃下11 410 r/min离心20 min,取上清液搅拌均匀,计算水溶蛋白含量(mg/g)。
1.2.8 水溶蛋白浊度的测定
参照Wang等[19]的方法。蛋白溶液用pH 7.0,0.6 M NaCl-20 mM Tris-马来酸缓冲液调至浓度为2.0mg/mL,于350 nm下测定吸光值。
1.2.9 水溶性蛋白巯基含量的测定
取0.5 mL 4mg/mL的水溶性蛋白溶液加入到4.0 mL pH 8.0的0.2 mol/L Tris-HCl缓冲液中,测定方法同1.2.6。
1.2.10 过氧化值的测定
参照于夕娟等[20]所采用的分光光度法测定。称取200mg油脂用氯仿-甲醇溶解(7+3),加入0.05 mL二氯化铁溶液,摇匀,加入0.05 mL 30%硫氰酸钾溶液,摇匀后放置5 min,以氯仿-甲醇混合溶剂为参比,于500 nm处测定吸光度。
1.2.11 共轭二烯值
参照Kim等[21]的方法。称取200mg油脂样品溶于97%正己烷,于233 nm下测定吸光值。
1.3 数据处理
数据利用SAS 19.0软件进行单因素方差分析,用邓肯氏多变域检验法确定数据间的差异,P<0.05表示统计学上差异显著,获得各项数据间的差异显著性情况,从而分析出两种温度对乌鳢鱼片品质的影响。
2 结果与分析
2.1 解冻损失率变化
解冻损失是肉质评定的重要指标之一,解析损失分析见图1。
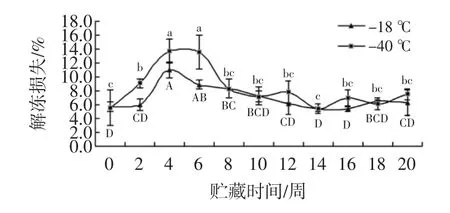
图1 解冻损失的分析Fig.1 Analysis for thawing loss
如图1,其中0周代表乌鳢鱼片在最新鲜时的初始状态,随着贮藏时间的不断延长,2组鱼片的解冻损失率在第20周的冻藏过程中先升高后下降。这可能是由于在慢速冷冻过程中形成的晶核少,冰晶大;冷冻前期冰晶刺破细胞膜使汁液流失,损失增加,解冻损失增大;随贮藏时间延长,冰晶升华,肉的汁液含量相对减少,损失也相对减少。由于第6周解冻损失率开始降低并趋向平稳;贮藏至16周,-40℃组解冻损失率为7.0%,且高于-18℃组的5.4%。-18℃和-40℃组在贮藏末期的解冻损失率分别达到了6.3%和7.5%,-40℃组解冻损失较高可能由于该温度条件下冰的升华现象较-18℃更显著,水分损失较多。
2.2 蛋白质含量变化
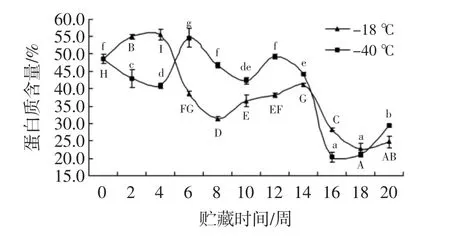
图2 蛋白质含量的分析Fig.2 Analysis for protein content
乌鳢鱼蛋白质含量分析见图2。如图2,随着冷冻贮藏时间的延长,蛋白质空间结构发生变化,蛋白质变性变成肽段或者多肽,两组蛋白质含量均显著下降(P<0.05)。新鲜乌鳢鱼片蛋白质含量为47.2%。乌鳢鱼片蛋白含量在0~4周差异显著,而-40℃组相对-18℃组下降速率较快。-18℃蛋白质含量从4周至8周下降显著(P<0.05),后趋于平缓,至贮藏第14周,蛋白含量急速下降,后趋于平缓。在贮藏末期,-18℃组和-40℃组蛋白质含量为24.7%和29.4%,且-40℃组蛋白含量高于-18℃组含量。因此对于短期储存,-40℃组相对于-18℃组而言损失相对较少,这主要是由于肌球蛋白重链减少引起的[22]。冻藏温度越低,溶解性下降得越快,冻藏时间越长,肌肉蛋白的溶解性越差。
2.3 盐溶性蛋白的测定
盐溶性蛋白是鱼肌中的主要蛋白质,占总蛋白的65%~75%[23],乌鳢鱼盐溶性蛋白含量分析见图3。

图3 盐溶性蛋白含量分析Fig.3 Analysis for salt-soluble protein
如图3所示,2组鱼片的盐溶性蛋白含量在0~20周的冻藏期内都显著下降(P<0.05),新鲜乌鳢鱼片的盐溶性蛋白含量为28.59%,第10周时-18℃组的含量只有13.27%,-40℃组的含量只有13.57%,10周到20周依旧呈下降趋势,但较前10周平缓,-18℃组最终的盐溶性蛋白含量为2.83%,-40℃组的含量为4.83%。-40℃的盐溶性蛋白含量高于-18℃组。这与孔春丽[16]在不同温度下冻藏鲤鱼片的品质研究的实验变化趋势相符。实验结果表明,冻藏温度越低,乌鳢鱼片变性程度越轻,抑制变性效果越好。在冻藏过程中,由于部分结合水形成冰晶,肌动球蛋白相互之间生成氢键、疏水键、二硫键和盐键,从而形成不溶性聚集体,导致盐溶性降低。
2.4 Ca2+-ATPase活性的测定
ATP降解是在死后的鱼和贝类中最重要的生物化学变化之一[24],乌鳢鱼肌原纤维蛋白Ca2+-ATPase活性分析见图4。
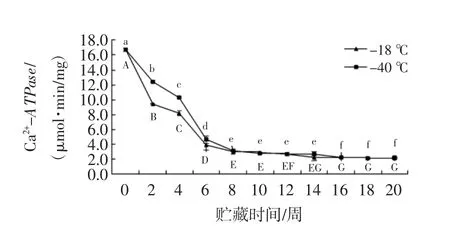
图4 肌原纤维蛋白Ca2+-ATPase活性分析Fig.4 Analysis for Ca2+-ATPase enzyme activity
如图4所示,在整个冻藏期内,两组鱼片的Ca2+-ATPase活性含量均呈下降趋势,且两组样品的Ca2+-ATPase活力在前6周均显著下降(P<0.05)。在0~8周贮藏过程中,-40℃组的Ca2+-ATPase活性高于-18℃组,此时-18℃组及-40℃组的Ca2+-ATPase活性分别为 2.98 、3.07 μmol·min/mg。8 周后两组 Ca2+-ATPase含量无显著差异(P>0.05)并趋于平缓。在研究中,0~2周的存放过程中观察到急剧下降现象的结果与Mehta等[23]一致。解冻损失,巯基含量等变化与Ca2+-ATPase活性的降低相一致,原因可能在冻藏过程中,肌动球蛋白的头部结构会发生变化,严重时会形成二硫键,进而导致其酶活性的下降或丧失[25]。结果表明在整个贮藏过程中,-40℃条件下的蛋白质在前期得到了较好的保护。
2.5 总巯基的测定
总巯基含量反应了蛋白质变性聚合的程度[25],乌鳢鱼巯基含量分析见图5。如图5,在冻藏过程中,随着时间的延长,两组样品的巯基含量均逐渐降低,-18℃组在前2周的下降速度显著(P<0.05),可能是前两周的蛋白质交联程度较大,巯基被氧化程度较严重,从第2周之后下降速度趋于平缓;-40℃组在整个冻藏期间下降程度不显著(P>0.05),这与阴晓菲[26]的试验结果有些差异,这可能与材料的处理方式和鱼类的品种不同有关;在0~20周冻藏过程中,-40℃组一直比-18℃组的巯基含量高,表明在较低温度冻藏条件下,可以有效的抑制巯基的氧化、二硫键的互换或蛋白质的交联作用。以上结果表明较低的冻藏条件下的蛋白质交联程度和蛋白的变性程度较低,巯基的氧化程度较轻微,鱼肉的品质维持的较好。
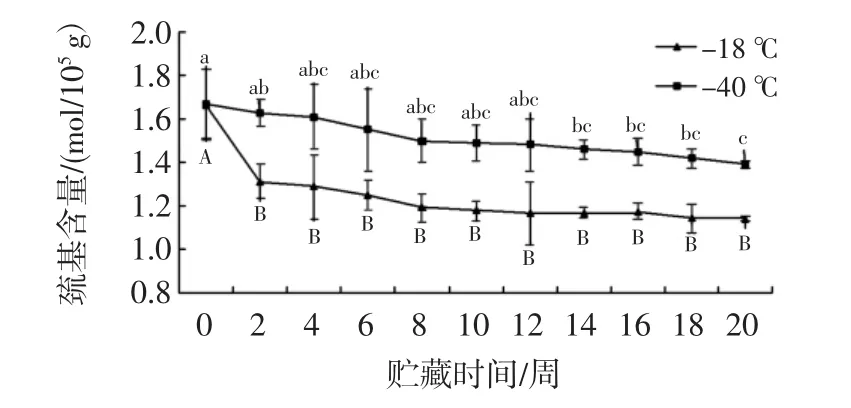
图5 巯基含量的分析Fig.5 Analysis for sulfhydryl content
2.6 肌浆蛋白质含量变化
乌鳢鱼肌浆蛋白分析见图6。
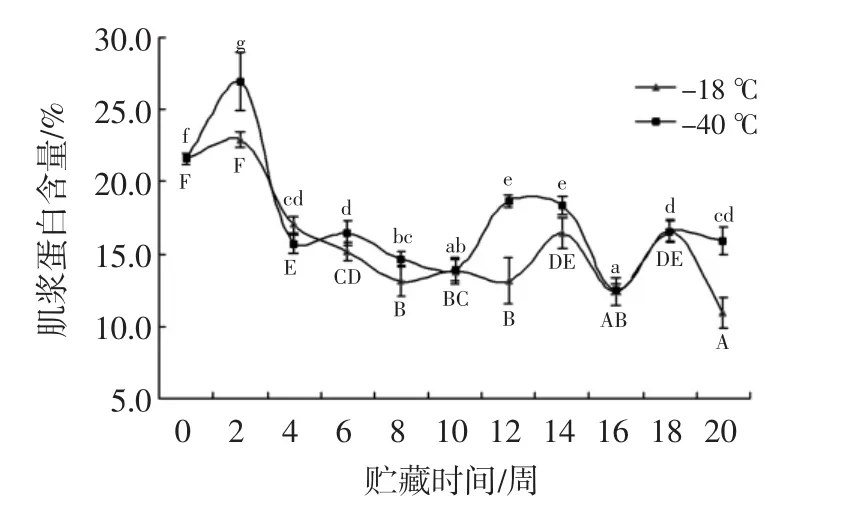
图6 肌浆蛋白的分析Fig.6 Analysis for sarcoplasmic protein
如图6所示,两组肌浆蛋白含量都显著下降(P<0.05),第0周肌浆蛋白质含量为21.59%,两组肌浆蛋白含量都在2周~4周大幅度下降,在第4周时-18℃和-40℃的肌浆蛋白含量分别为17.1%和15.7%。两组含量在6至10周下降无显著差异(P>0.05)。第20周时,-18℃和-40℃的肌浆蛋白含量较新鲜值下降了10.6%和5.7%。从图6可以看出,随着贮藏期的延长,肌原纤维蛋白与肌浆蛋白变化不一致,相对其肌原纤维蛋白含量变化波动较大,其原因有待研究。结果表明,温度越低乌鳢鱼片质量保存的越好。
2.7 水溶性蛋白浊度变化
乌鳢鱼肌浆浊度变化分析见图7。
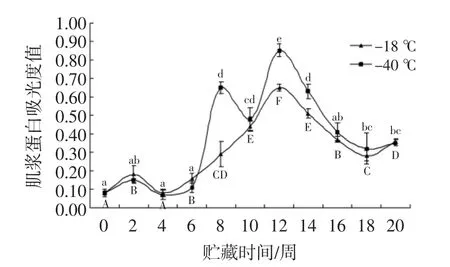
图7 肌浆浊度变化分析Fig.7 Analysis for turbidity changes
如图7所示,随着时间的延长,两组水溶性蛋白的浊度都呈现显著的增加(P<0.05)。-40℃组蛋白质在6周前沉淀不显著(P>0.05),在第8周有显著提高(P<0.05),并在第12周达到最大值。-18℃组平稳上升至第12周达到最高值,之后有所下降。在6周~20周,-40℃的浊度高于-18℃,与乌鳢鱼片的水溶性蛋白含量降低的变化规律一致,因此浊度的变化可能与水溶性蛋白含量相关,可能由于蛋白质交联引起蛋白质聚集,疏水残基暴露,导致蛋白的变性、沉淀。结果说明-18℃对于乌鳢鱼片的蛋白保存具有更好的保护作用。
2.8 水溶性巯基含量变化
水溶性蛋白巯基含量变化如图8所示。
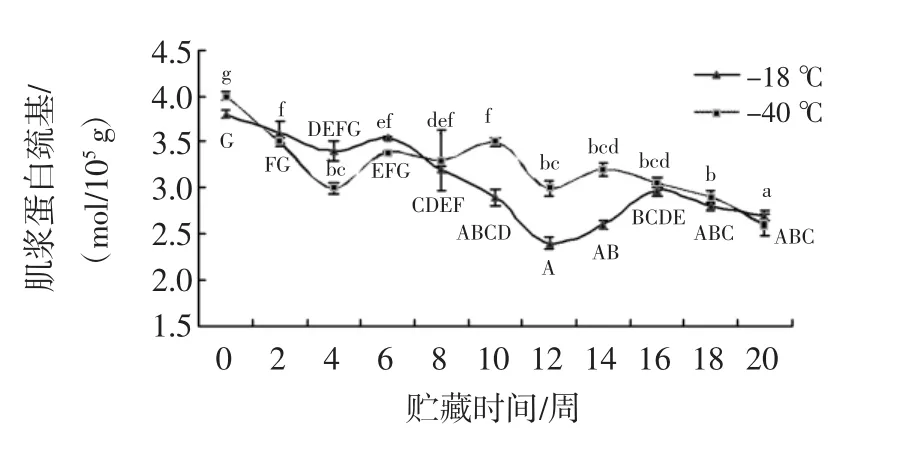
图8 肌浆巯基含量分析Fig.8 Analysis for sulfhydryl content
随着冻藏时间的延长,两组样品中的总巯基含量均显著降低(P<0.05),在贮藏过程中-18℃组和-40℃组巯基含量初值分别为3.8 mol/105g和4.0 mol/105g,贮藏至第10周时乌鳢鱼片巯基含量降至2.9 mol/105g和3.5mol/105g,此时两组存在显著差异(P<0.05)。12周后巯基含量先升高,后趋于平缓,至贮藏末期20周时,两组分别降至2.7 mol/105g和2.6 mol/105g。结果表明0~20周贮藏中,-40℃组下降速率较平缓,8周~14周贮藏中-40℃组含有较高的巯基含量,说明较好的延迟蛋白质的氧化。
2.9 过氧化值(peroxide value,POV)变化
乌鳢鱼过氧化值的分析见图9。
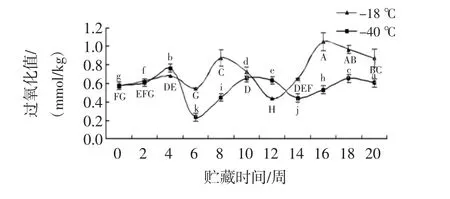
图9 过氧化值的分析Fig.9 Analysis for peroxide value changes
如图9,在整个贮藏过程中,2组鱼片的POV总体呈上升趋势,其中出现三次上升三次下降趋势。-40℃组的过氧化值在整个贮藏过程中都明显低于-18℃组。贮藏至第6周,-18℃组和-40℃组分别下降至0.54 mmol/kg和0.23 mmol/kg,后上升。贮藏至第13周,-18℃组及-40℃组POV分别降低至0.43 mmol/kg、0.63mmol/kg,后再上升。在贮藏20周时-18℃组较新鲜值显著升高了0.30 mmol/kg,-40℃升高了0.02 mmol/kg(P<0.05)。这种变化规律与Zaghbib等[27]的结论相一致。吕飞等[28]在研究竹筴鱼在冻藏过程中也得出相类似的结论,其POV值总体呈上升趋势,但乌鳢鱼片在冻藏过程中的POV值有下降趋势,这可能是由于鱼的种类、脂肪含量、生长环境的差异所致。结果说明较低的冻藏温度对脂肪氧化的抑制效果更好,更有利于乌鳢鱼片的保藏。
2.10 共轭二烯值的变化
乌鳢鱼共轭二烯值的分析见图10。
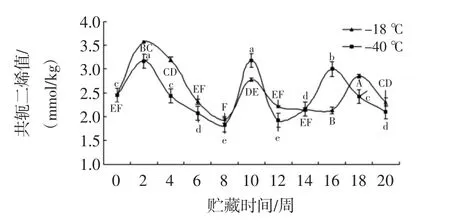
图10 共轭二烯值的分析Fig.10 Analysis for Conjugated diene value
如图10,在0~6周冻藏期,两组样品的共轭二烯值都呈先上升后下降的趋势,-18℃组和-40℃组分别在第2、10、18 和 2、10、16 周成为共轭二烯值的下降变化的转折点,转折点后呈现下降趋势。0~8周共轭二烯值大小为:-18℃处理组>-40℃处理组,且-18℃组和-40℃组鱼片在第2周和第10周达到最大值3.6 mmoL/kg和3.2 mmoL/kg。共轭二烯通过多不饱和脂肪酸双键的转移形成中间体[29],是反映脂肪氧化的初级产物。关于不同冻藏温度对乌鳢鱼片的共轭二烯的产生无显著影响的原因有待进一步研究。
3 结论
在-18℃和-40℃下贮藏的两组乌鳢鱼片中蛋白质含量都随时间的延长而减少,脂肪含量也因为氧化分解而导致下降,与-18℃组相比,-40℃组在20周的储存过程中能显著延缓乌鳢鱼片在贮藏过程中蛋白质分解、巯基的暴露氧化、过氧化值的升高、共轭二烯值的增长,一定程度上可以降低乌鳢鱼品质的下降速率,延长货架期,但-40℃组和-18℃组的解冻损失速率无显著差异。试验表明,不同的冻藏温度可以造成乌鳢鱼肉品质的不同变化,冻藏保鲜虽然可以延长鱼体的保鲜期限,但鱼肉部分冻结,冰晶增长破坏细胞结构,导致营养价值以及风味下降,影响鱼的品质。因此,冷藏及微冻条件下乌鳢鱼的品质变化规律还有待进一步的研究。
参考文献:
[1]秦伟夫,蒋俊和.乌鳢复元汤促进术后大鼠切口愈合的实验研究[J].湖南中医药大学,2010,8(10):189-190
[2]HASSOUN A,KAROUI R.Quality evaluation of fish and other seafood by traditional and nondestructive instrumental methods:Advantages and limitations[J].Critical Reviews in Food Science and Nutrition,2017,57(9):1976-1998
[3]WEGLEITNER B J,TUCKER A,CHADDERTON W L,et al.Identifying the genetic structure of introduced populations of northern snakehead(Channa argus)in Eastern USA[J].Aquatic Invasions,2016,11(2):199-208
[4]SAGADA G,CHEN J,SHEN B,et al.Optimizing Protein and Lipid Levels in Practical Diet for Juvenile Northern Snakehead Fish(Channa argus)[J].Animal Nutrition,2017,3(2):1-8
[5]XU J,BIAN C,CHEN K,et al.Draft genome of the Northern snakehead,Channa argus[J].Gigascience,2017,6(4):1-5
[6]ZHANG X C,CHEN K C,ZHU X P,et al.Two molecular markers based on mitochondrial genomes for varieties identification of the northern snakehead(Channa argus)and blotched snakehead(Channa maculata)and their reciprocal hybrids[J].Mitochondrial DNA,2015,26(4):555-558
[7]赵立,陈军,赵春刚,等.野生和养殖乌鳢肌肉的成分分析及营养评价[J].现代食品科技,2015,31(9):244-249
[8]罗青,陈昆慈,赵建,等.乌鳢,斑鳢及其杂交F1代肌肉营养成分和含肉率的比较分析[J].大连海洋大学学报,2015,30(2):175-180
[9]Zhang J,Zou M,Zhang M,et al.Impact of Telopeptides on Self-Assembly Properties of Snakehead(Channa argus)Skin Collagen[J].Food biophysics,2016,11(4):380-387
[10]赵文亚,崔旭海,孙中贯.复合磷酸盐对乌鳢鱼糜凝胶强度影响的研究[J].食品研究与开发,2016,37(3):23-25
[11]LIU Y,ZHANG Y F,JIANG W,et al.Nucleic acids digestion by enzymes in the stomach of snakehead(Channa argus)and banded grouper(Epinephelus awoara)[J].Fish Physiology Biochemistry,2017,43(1):127-136
[12]阙婷婷.不同低温保鲜方法对乌鳢鱼肉理化性质以及组织结构的影响[D].杭州:浙江大学,2014:23-49
[13]Gallart-Jornet L,Rustad T,Barat J D,et al.Effect of superchilled storage on the freshness and salting behavior of Atlantic salmon fillets[J].Food Chemistry,2007,103(4):1268-1281
[14]王航.鲤鱼冻藏时间与解冻方法对其品质特性的影响[D].北京:中国农业大学,2012:11-13
[15]PAN J,SHEN H,LUO Y.Changes in salt extractable protein and Ca2+-ATPase activity of mince from silver carp(Hypophthalmichthys mollitrix)during frozen storage:a kinetic study[J].Journal of Muscle Foods,2010,21(4):834-847
[16]孔春丽.鲤鱼片冻藏过程中品质变化规律研究及预测模型的建立[D].北京:中国农业大学,2016:22-23
[17]KOBAYASHI Y,PARK J W.Biochemical and physical characterizations of fish protein isolate and surimi prepared from fresh and frozen whole fish[J].LWT-Food Science and Technology,2017,77:200-207
[18]TADPITCHAYANGKOON P,PARK J W,MAYER S G,et al.Structural changes and dynamic rheological properties of sarcoplasmic proteins subjected to pH-shift method[J].Journal of Agricultural&Food Chemistry,2010,58(7):4241-4249
[19]Wang H H,Pato M,Pietrasik Z,et al.Biochemical and physicochemical properties of thermally treated natural actomyosin extracted from normal and PSE pork Longissimus muscle[J].Food Chemistry,2009,113(1):21-27
[20]于夕娟.分光光度法测定食品油脂中过氧化值的研究[J].预防医学论坛,2009,15(9):860-861
[21]KIM R S,LABELLA F S.Comparison of analytical methods for monitoring autoxidation profiles of authentic lipids[J].Journal of Lipid Research,1987,28(9):1110-1117
[22]任丽娜.白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D].江苏:江南大学,2014:20-22
[23]MEHTA N K,CHOUKSEY M K,BALANGE A K,et al.Physicochemical and Gel Properties of Myofibrillar Protein from Sin Croaker(Johnius dussumieri)Fish During Ice Storage[J].Journal of Aquatic Food Product Technology,2017,26(1):71-85
[24]HONG H,REGENSTEIN J M,LUO Y K.The importance of ATP-related compounds for the freshness and flavor of post-mortem fish and shellfish muscle:a review[J].Critical reviews in food science and nutrition,2017,57(9):1787-1798
[25]岳开华,张业辉,刘学铭,等.冻藏温度对海鲈鱼鱼糜蛋白生化指标及其凝胶特性的影响[J].现代食品科技,2016,32(6):225-232
[26]阴晓菲,范鸿冰,郑超,等.不同冻结方法对草鱼鱼片冻藏-冷藏期间蛋白质生化特性的影响[J].中国农业大学学报,2013,18(6):000158-163
[27]ZAGHBIB I,FELIX M,ROMERO A,et al.Effects of Whitening A-gents and Frozen Storage on the Quality of Sardine(Sardina pilchardus)Surimi:Physicochemical and Mechanical Properties[J].Journal of Aquatic Food Product Technology,2017,26(1):29-42
[28]吕飞,魏倩倩,胡卓瑾,等.冷海水预处理时间对竹筴鱼冻藏品质的影响[J].核农学报,2016,30(7):1373-1378
[29]FARHOOSH R,MOOSAVI S M R.Evaluating the performance of peroxide and conjugated diene values in monitoring quality of used frying oils.[J].Journal of Agricultural Science&Technology,2009,11(2):173-179
——白乌鳢

