丹玄口康对ANE诱导的口腔黏膜下纤维化TGFβ1/Smad信号通路的影响
谭 劲 岳金宝 罗玉姣 吴 丹 刘 寻 李 群
1.湖南中医药大学第一附属医院,湖南长沙 410007;2.湖南中医药大学研究生院,湖南长沙 410208
口腔黏膜下纤维化是一种以胶原蛋白等细胞外基质异常增多和过渡沉积为主要病变特征的慢性、隐匿性疾病[1]。研究发现中药丹玄口康能影响TGFβ1的表达从而抑制ANE诱导的口腔黏膜成纤维细胞胶原蛋白的分泌[2],TGFβ1调节胶原等细胞外基质的信号传递,主要由Smad家族蛋白分子来完成[3]。Smad2/3的磷酸化是Smad通路激活的最重要一步,P-Smad2/3由细胞质转入细胞核是信号通路的标志。本研究以体外培养的口腔黏膜成纤维细胞(fibroblast,FB)为研究对象,采用特异性TGF-β受体抑制剂LY2109761[4]阻断TGF-β/Smad通路,运用免疫组化、分子生物学等方法,观察ANE对口腔黏膜成纤维细胞表达胶原蛋白的影响及丹玄口康的干预作用,旨在为OSF的中医药临床治疗提供新的实验依据。
1 材料与方法
1.1 口腔黏膜成纤维细胞(FB)
口腔黏膜成纤维细胞来自雄性SD大鼠(SPF级,体重220~250g,湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK (湘):20U-0005。饲养环境温度25℃,相对湿度50%,自由饮食进水,分笼喂养),细胞分为4组:正常组、对照组、LY2109761组和丹玄口康组。
1.2 实验药物
1.2.1丹玄口康片 湖南中医药大学第一附属医院药剂科生产,由丹参、当归、红花、生地、玄参、白花蛇舌草、生黄芪、薄荷等药组成,院制批号:20140208,规格:每片含生药1g(相当于原药材20g)。
1.2.2槟榔提取物(ANE) 食用槟榔150g,60℃烤箱烘干碾成粉,加乙醚500mL,10%氨水100mL,充分混合,强震荡,静置24h,4℃。抽滤去渣后,水浴馏去乙醚及氨,浓缩成膏状,60℃烤箱拷干成粉末状,粉溶于蒸馏水,浓度10mg/mL,用0.22μm过滤器过滤除菌后分装,4℃保存备用。
1.3 主要试剂和设备
DMEM(高糖型)培养基;胎牛血清;10×多聚赖氨酸(北京索莱宝科技有限公司);LY2109761(selleck);兔 抗 Collagen I(Abcam);小 鼠 抗p-Smad2/3(Abcam);羊抗兔 IgG(美 Vector);羊抗小鼠IgG(Vector);ABC试剂盒;琼脂糖;逆转录试剂盒(北京康为世纪);EDTA(Sigma);Tris(Sigma);Trizol(Invitrogen);Taq酶(Genstar);引物(南 京 金 斯 瑞);DEPC(Sigma);DL2000 DNA Marker(Genstar);dNTP(Genstar);E.B.(Sigma);SYBGREEN PCR Mix(Invitrogen);CO2细胞培养箱(南京皓海仪器仪表有限公司);超净工作台(苏州智净净化设备有限公司);倒置显微镜(上海赖氏电子科技有限公司);TGL-18R台式冷冻离心机(eppendorf);荧光定量 RCP仪(Thermo);荧光PCR板(Thermo);164-5050电泳仪(Bio-rad);水平琼脂糖电泳槽(北京六一);电动玻璃匀浆器(新芝)。
1.4 方法
1.4.1药物血清制备 大鼠分别以生理盐水、丹玄口康8g/kg(按照体表面积药物剂量换算公式计算,相当70kg成人剂量的2倍)灌胃,2次/d,连续5d。大鼠末次灌胃1h后,无菌条件下颈动脉采血,室温静置2h,1500rpm离心10min制备血清,56℃灭活30min,0.22μm滤器除菌后,用DMEM配制成含10%大鼠血清的培养液备用。
1.4.2FB的培养和干预 取健康SD大鼠口腔颊部粘膜组织块,含双抗(100μ/mL青霉素,100μg/mL链霉素)的PBS充分漂洗3次,入DMEM中剪碎,种入到培养瓶中,置37℃,5%CO2的培养箱内,组织贴附后,加适量20%胎牛血清的DMEM培养液,继续静置培养,48h半量换液1次。待组织周围爬出细胞占培养瓶底面积80%时即可进行传代。弃培养液,Hanks液洗3次,0.25%胰蛋白酶消化3min,辅以吹打,倒置显微镜下观察到细胞回缩、细胞漂浮在液体中后,加入含10%胎牛血清的DMEM终止反应,移至离心管中,800r/min速度离心5min,去上清液,加入DMEM吹打,使细胞悬浮,移至培养瓶中,一般按照1∶2比例传代,4d左右传代一次。取第4代细胞,分组干预如下:正常组(10%正常大鼠血清)、对照组(100μg/mL ANE+ 10%正常大鼠血清)、LY2109761组(10μmol/L LY2109761+100μg/mL ANE+10%正常大鼠血清)丹玄口康组(10%丹玄口康含药血清+100μg/mL ANE),细胞以5×104个/mL的密度接种于贴有盖玻片的24孔板中,每组6孔,培养48h后,收集上清液,-80℃保存,用于ELISA检测;培养细胞用4%多聚甲醛固定15min后进行免疫细胞化学染色。
1.4.3ELISA检测上清液中Ⅰ型胶原含量 按试剂盒说明书操作,设置对照品组、样品组及空白组,显色后,以空白孔调零,在波长490nm处读取OD值;以OD值为纵坐标,以对照品浓度为横坐标,绘制标准曲线,根据所测得的OD 值在标准曲线上计算出Ⅰ型胶原含量的相应浓度。
1.4.4免疫细胞化学染色检测Ⅰ型胶原及P-Smad2/3蛋白的表达 免疫细胞化学染色主要步骤依次为:0.01MPBS漂洗,1%过氧化氢溶液10min,0.01 MPBS漂洗,5%正常小牛白蛋白(BSA)+0.3%TritonX-100室温下封闭lh,吸弃封闭液,直接滴加一抗Collagen I(1∶500)或P-Smad2/3(1∶ 200),4℃过夜,0.01 MPBS漂洗,加入二抗(1∶ 200),37℃孵育 lh;0.01 MPBS漂洗,加入ABC复合物,37℃孵育lh;0.01MPBS,DAB显色试剂盒37℃显色,梯度酒精脱水,二甲苯透明,中性树脂封片。在高倍镜下摄取图像,采用图像分析系统,测定免疫阳性细胞的灰度值,同时测量背底灰度值,计算其差值的绝对值,即得出免疫阳性细胞的相对灰度值。
1.4.5荧光定量PCR检测Ⅰ型胶原mRNA的表达 提取组织总RNA,涡旋振荡混匀,短暂离心,使管壁上的溶液收集到管底。42℃孵育30 ~ 50min,85℃孵育5min,得到逆转录终溶液即为cDNA溶液,短暂离心,置于冰上冷却,保存于-80℃待用;RT-qPCR引物设计:在NCBI上搜索目的基因的序列,运用primer5软件设计引物,合成引物(actin-F:5’- CATCCTGCGTCTGGACCTGG-3’actin-R:5’-TAATGTCACGCACGATTTCC-3’,product length:1 0 7 b p;C o l 1-F:5’-TGTGCGATGGCGTGCTATGC-3’Col1-R:5’-CGACTCCTATGACTTCTGCGTCTGGT-3’,product length:123bp);每组实验设6个复孔,独立实验重复3次,取平均值。以管家基因 β-actin 作为内源性参照。待测基因的相对表达量以2-ΔΔCT表示。
1.5 统计学处理
本研究运用SPSS20.0统计软件分析,实验数据以(x±s) 表示,多组间均数的比较采用单因素方差分析,组间采用两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 Ⅰ型胶原蛋白ELISA检测结果
ELISA结果显示,正常组上清液中CollagenⅠ的含量约为133.7pg/mL,ANE刺激后,对照组Collagen Ⅰ的含量明显增加(P<0.05);ANE刺激同时加入LY2109761后,培养液中Collagen I的含量明显降低,与对照组相比差异有统计学意义(P<0.05)。丹玄口康组Collagen I的含量略高于正常组和LY2109761组,差异无统计学意义,但与对照组相比含量明显降低(P<0.05)。见表1。
表1 丹玄口康对ANE刺激下的Collagen Ⅰ表达的影响(±s )

表1 丹玄口康对ANE刺激下的Collagen Ⅰ表达的影响(±s )
注:与正常组比较*P<0.05;与对照组比较#P<0.05
组别 培养液(pg/mL) 细胞(相对灰度值)正常组 133.7±14.5 38.8±4.3对照组 268.5±30.2* 58.4±6.8*LY2109761组 134.6±12.7# 41.7±5.3#丹玄口康组 135.3±15.6# 42.4±5.6#F 70.48 15.15 P<0.01 <0.05
2.2 Ⅰ型胶原蛋白免疫细胞化学染色结果
免疫细胞化学染色结果显示Collagen Ⅰ免疫阳性物质在胞浆中表达。正常组细胞中也存在Collagen Ⅰ的表达,但染色较浅。对照组与正常组相比,免疫阳性细胞相对灰度值明显要大(P<0.05),LY2109761组与对照组相比,免疫阳性细胞相对灰度值均有所减小(P<0.05),丹玄口康组与对照组相比,免疫阳性细胞相对灰度值均有所减小(P<0.05)。见1,图1。

图1 口腔黏膜成纤维细胞Collagen Ⅰ免疫细胞化学染色(A.正常组, B. 对照组, C. LY2109761组, D.丹玄口康组,200倍)
2.3 P-Smad2/3蛋白免疫细胞化学染色结果
免疫细胞化学染色结果显示正常组胞浆和胞核中有P-Smad2/3表达,但染色较浅。对照组,细胞核免疫阳性颗粒的相对灰度值比正常组明显要大(P<0.05),LY2109761组与对照组相比,相对灰度值比ANE刺激组有所减小(P<0.05),丹玄口康组与对照组相比,相对灰度值有所减小(P<0.05)。见表2,图2。
表2 丹玄口康对ANE刺激下的 P-Smad2/3胞核转位的影响(±s )

表2 丹玄口康对ANE刺激下的 P-Smad2/3胞核转位的影响(±s )
注:与正常组比较*P<0.05;与对照组比较#P<0.05
组别 相对灰度值正常组 25.3±3.1对照组 54.4±8.8*LY2109761组 26.5±3.4#丹玄口康组 26.8±3.5#F 43.13 P<0.01
2.4 荧光定量PCR结果

图2 口腔黏膜成纤维细胞P-Smad2/3免疫细胞化学染色(A.正常组, B. 对照组, C. LY2109761组, D.丹玄口康组,200倍)
Collagen Ⅰ和β-actin扩增曲线显示荧光信号指数扩增阶段,PCR产物量的对数值与起始模板量之间存在线性关系。Collagen Ⅰ和β-actin溶解峰呈单峰,结果为单一峰,说明无非特异性产物,定量准确。2-ΔΔCt反映各样品相对于对照组样品目的基因的表达水平,对照组Collagen I mRNA相对表达量高于正常(P<0.05),LY2109761组Collagen I mRNA相对表达量比对照组明显降低(P<0.05),丹玄口康组Collagen I mRNA相对表达量比对照组明显降低(P<0.05)。见图3 ~ 5。

图3 扩增曲线
图4 溶解曲线
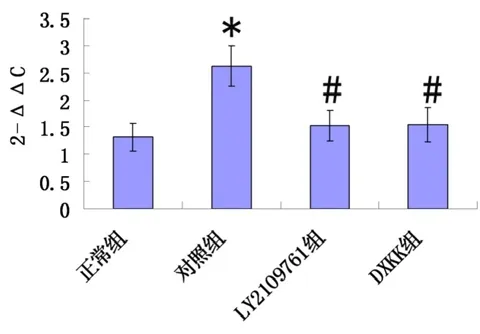
图5 Collagen Ⅰ mRNA相对表达量(2-ΔΔCT)
3 讨论
研究表明活化的口腔黏膜成纤维细胞(fibroblast,FB)是促进细胞外基质异常增多和过渡沉积的主要细胞,是口腔黏膜胶原蛋白合成的主要来源[5]。TGFβ是一种具有多种生物学功能的蛋白多肽,是对细胞的增殖、分化等多种生理功能起重要调节的因子,也是多种器官和组织纤维化的关键因子[6]。TGF-β具有三种受体类型[7]:受体Ⅰ型(TGF-β receptorⅠ,TβRⅠ)、受体Ⅱ型(TGF-β receptor Ⅱ,TβR Ⅱ)、受体Ⅲ型(TGF-β receptorⅢ,TβRⅢ)。其中TβRⅠ、TβRⅡ具有膜结合丝氨酸/苏氨酸结构域,具有细胞信号转导所必需的活性。TβR Ⅱ可直接结合配体,随后RⅠ与RⅡ受体结合,并磷酸化受体胞内结构域,进行信号的传递。Smads蛋白(Drosophila mothersagainst decapentaplegic protein,Smad)是近年发现的一种胞内信号蛋白,是一种在真核细胞中高度保存的分子,由于Smad及所介导的生物学信号可能作为杠杆作用,参与多种纤维化疾病的过程而倍受关注。Smad 蛋白家族可分为3群[8]:受体激活型 Smads(R-Smads),包括 Smad1-3、Smad5、Smad8;通用配体型 Smads(Co-Smads)包括 Smad4、Smad10;抑制 型 Smads(I-Smads),包 括 Smad6、Smad7。 其中 Smad2、Smad3、Smad4、Smad7参与 TGF-βs的信号转导。TGFβ1调节胶原等细胞外基质的信号传递,主要由Smad家族蛋白分子来完成。TGFβ1信号由胞内转导入核内的过程,是由磷酸化的R-Smads分子来完成的,即TGF-β家族成员与胞膜受体丝氨酸/苏氨酸激酶受体结合,形成异四聚体复合物TGF-βⅡ型受体并使其磷酸化,TβRⅡ继而激活 TGF-βⅠ型受体。TGF-βⅠ型受体磷酸化下游 R-Smads(Smad2/3),p-Smad2/3与 Co-smad(smad4)结合,形成复合体后进入细胞核并在细胞核内聚集。该复合体与其他转录因子一起共同与DNA双链结合,通过和转录因子的相互作用从而调控靶基因的表达。而Smad2/3的磷酸化是Smad通路激活的最重要一步及标志,细胞内p-Smad2/3表达的多少即意味着该通路激活的程度。
已有研究表明[9-10]:阻断TGFβ1的信号转导就能有效抑制TGFβ1的生物学效应。其方式有三种,一是从配体水平的阻断,阻断TGFβ的生成和激活,是信号转导过程的起始,是胞外配体即处于活化状态的TGFβ1分子,与胞膜上的TGFβ1受体结合。二是胞膜受体水平的阻断,是胞外TGFβ1与胞膜上的TGFβ1受体相结合,通过磷酸化激活的形成将信号转导入胞内。三是胞内信号分子水平的阻断,是TGFβ1的胞内信号传递,主要由Smad家族蛋白分子来完成。阻断TGFβ1信号转导,下调Smad2和Smad3的表达并增加Smad7表达,对抑制许多疾病的纤维化有着重要的意义[11-12]。因此,如何阻断TGFβ1信号转导,寻找针对OSF发病机制环节的特异性治疗,从而达到防治OSF的目的是本研究的主要目标。
LY2109761是一种TGF-β受体特异性抑制剂,研究表明LY2109761具有显著增加卵巢癌细胞的凋亡和抗卵巢癌细胞增殖的作用[13];LY2109761能抑制骨肉瘤MG-63细胞转移和提高化疗的敏感性[14];LY2109761减轻鼠放射性肺损伤纤维化作用[15]。本研究采用体外培养大鼠颊黏膜的成纤维细胞为研究对象,用LY2109761阻断TGFβ1/Smad通路,观察了ANK对FB的Ⅰ型胶原蛋白合成的影响及丹玄口康药物血清的干预作用。实验首先发现,ANE刺激FB后,免疫细胞化学染色和上清液ELISA检测结果显示I型胶原蛋白合成增多(P<0.05),荧光定量PCR检测显示Ⅰ型胶原蛋白mRNA的基因转录水平明显提高(P<0.05),说明ANE诱导可促进FB I型胶原蛋白的合成。进一步对FB磷酸化Smad2/3免疫染色显示,ANE刺激FB后,细胞核磷酸化Smad2/3免疫阳性细胞数量增多(P< 0.05),表达明显增强(P<0.05),ANE诱导可促进FB Smad2/3的磷酸化胞核的转位。以上结果显示ANE作为一种较强刺激因素,通过激活TGFβ1/Smads信号转导通路促进FB的Ⅰ型胶原蛋白的合成。ANE刺激FB后,给予TGF-β受体抑制剂LY2109761干预,发现Ⅰ型胶原蛋白合成减少(P<0.05),Ⅰ型胶原蛋白mRNA的表达减弱(P<0.05),细胞核磷酸化Smad2/3免疫阳性细胞数量明显减少(P<0.05),表达明显减弱(P<0.05),抑制了ANE诱导的Smad2/3的磷酸化胞核的转位,结果显示LY2109761通过阻断TGFβ1/Smads信号转导通路抑制ANE刺激的FB的Ⅰ型胶原蛋白的合成。ANE刺激FB后,给予丹玄口康药物血清的干预,Ⅰ型胶原蛋白及mRNA表达明显减弱(P<0.05)、Smad2/3的磷酸化胞核的转位水平降低(P<0.05),与LY2109761干预结果一致。以上实验结果提示:丹玄口康可通过调控TGFβ1/Smads信号转导通路,从而抑制ANE刺激的FB的I型胶原蛋白的合成,进而发挥其抗纤维化的作用。
[参考文献]
[1] Wollina U,Verma SB,Ali FM,et al.Oral submucous fibrosis:an update[J].Clin Cosmet Investig Dermatol,2015,8:193-204.
[2] 谭劲,吴丹,陈明,等.丹玄口康对ANE诱导大鼠口腔粘膜下纤维化TGF-β1表达的影响[J].临床医学工程,2015,22(2):155-156.
[3] Xie WL,Jiang R,Shen XL,et al.Diosgenin attenuates hepatic stellate cell activation through transforming growth factor-β/Smad signaling pathway[J].Int J Clin Exp Med,2015,8(11):20323-20329.
[4] Bueno L,Alwis DP,Pitou C,et al.Semi-mechanistic modelling of the tμmour growth inhibitory effects of LY2157299,a new type I receptor TGF-β kinase antagonist,in mice[J].Eur J Cancer,2008,44:142-150.
[5] Mathew P,Austin RD,Varghese SS,et al.Estimation and comparison of copper content in raw areca nuts and commercial areca nut products:implications in increasing prevalence of oral submucous fibrosis (OSMF) [J].J Clin Diagn Res,2014,8(1):247-249.
[6] Kamath VV,Krishnamurthy S,Satelur KP,et al.Transforming growth factor-β1 and TGF-β2 act synergistically in the fibrotic pathway in oral submucous fibrosis: An immunohistochemical observation[J].Indian J Med Paediatr Oncol,2015,36(2):111-116.
[7] Travis MA,Sheppard D.TGF-β activation and function in immunity[J].Annu Rev Immunol,2014,32(1):51-82.
[8] Xu F,Liu C,Zhou D,et al.TGF-β/SMAD Pathway and Its Regμlation in Hepatic Fibrosis[J].J Histochem Cytochem,2016,64(3):157-167.
[9] Biernacka A, Dobaczewski M, Frangogiannis NG.TGF-β signaling in fibrosis[J]. Growth Factors. 2011,29(5):196-202.
[10] Persson U,Souchelnytskyi S,Franzén P,et al.Transforming growth factor (TGF-beta)-specific signaling by chimeric TGF-beta type II receptor with intracellμlar domain of activin type IIB receptor[J].J Biol Chem,1997,272(34):21187-22194.
[11] Nakao A,Imamura T,Souchelnytskyi S,et al.TGF-beta receptor-mediated signalling through Smad2, Smad3 and Smad4[J].Embo J,1997,16(17):5353-5362.
[12] Matsuzaki K.Smad phosphoisoform signaling specificity:the right place at the right time[J].Carcinogenesis,2011,32(11):1578-1588.
[13] Gao Y,Shan N,Zhao C,et al.LY2109761 enhances cisplatin antitμmor activity in ovarian cancer cells[J].Int J Clin Exp Pathol,2015,8(5):4923-4932.
[14] Ren XF,Mu LP,Jiang YS,et al.LY2109761 inhibits metastasis and enhances chemosensitivity in osteosarcoma MG-63 cells[J].Eur Rev Med Pharmacol Sci,2015,19(7):1182-1189.
[15] Flechsig P,Dadrich M,Bickelhaupt S,et al.LY2109761 attenuates radiation-induced pμlmonary murine fibrosis via reversal of TGF-β and BMP-associated proinflammatory and proangiogenic signals[J].Clin Cancer Res,2012,18(13):3616-3627.

