苯磺酸左旋氨氯地平治疗的高血压患者颈动脉硬化参数及血清胱抑素C、尿酸水平变化
杨天贵,牛铁生
(中国医科大学附属盛京医院,沈阳 110000)
高血压为临床常见的慢性病,是造成心脑血管疾病的高危因素。高血压慢性并发症发生隐匿,尤其是大血管病变,造成的伤残和病死率较高。高血压能引起血管内皮细胞损伤、激活肾素-血管紧张素系统、促进心肌细胞凋亡、促进炎症反应[1,2],其可通过促进动脉硬化的发生发展引起靶器官并发症。胱抑素C(Cys C)可以调节半胱氨酸蛋白酶的活性,影响中性粒细胞迁移,参与炎症反应、细胞外基质的产生与降解、血管壁基质重构[3]。尿酸(SUA)通过损伤血管内皮致内皮细胞功能失调、参与氧化应激反应、导致LDL氧化等途径,促使动脉硬化的发生发展,从而参与心脑血管疾病、糖尿病、高血压等的发生[4~6]。颈动脉内膜中层厚度(CI-MT)是用于评价动脉粥样硬化的重要指标,可以反
映动脉粥样硬化的负荷程度。研究[7]发现,通过多因素共同干预可以减小CIMT,减少动脉粥样硬化及心脑血管终点事件的发生。苯磺酸左旋氨氯地平是临床常用的降压物,其主要通过阻滞Ca2+内流,使小动脉扩张,降低外周阻力,从而达到降压作用,有扩张冠状血管增加冠脉血流的作用,降压过程中不减少心脑肾等重要器官的血流量,降压作用持久且平稳安全;但苯磺酸左旋氨氯地平对高血压患者CIMT和血清Cys C、SUA水平的影响目前文献报道不多。本研究观察了苯磺酸左旋氨氯地平治疗后高血压患者颈动脉硬化参数及Cys C、SUA水平变化,旨在为临床医师选择合适的延缓高血压患者动脉硬化发生发展的药物提供参考。
1 资料与方法
1.1临床资料选取2015年3月~2016年12月中国医科大学附属盛京医院收治的原发性高血压患者210例,男104例,女106例;年龄(58.6±14.8)岁。有吸烟史116例;既往有冠心病96例,脑梗塞160例,糖尿病64例;既往使用阿司匹林、他汀药物、血管紧张素转换酶抑制剂各210例,氯吡格雷76例,β受体阻滞剂160例,硝酸酯类90例,降糖药42例,胰岛素33例。排除标准:继发性高血压、严重肝肾功能不全、急性心功能衰竭、恶性肿瘤、血液系统疾病、结缔组织疾病、严重感染者。患者入组前4周均未服用降压药物及他汀类药物。所有患者随机分为观察组及对照组各105例。本研究均经患者知情并自愿参加本次临床研究,并签署知情同意书。
1.2苯磺酸左旋氨氯地平应用方法两组患者均进行高血压健康教育、戒烟、戒酒、饮食控制、适当运动等基础治疗,并予以抗血小板聚集、降脂稳定斑块治疗,另口服培哚普利(4 mg),1次/d;观察组在此基础上口服苯磺酸左旋氨氯地平(2.5 mg),1次/d;两组患者均坚持服药1 a。
1.3观察方法颈动脉硬化参数:取颈总动脉远端分叉水平线下1~1.5 cm处,采用VIVID 7 Dimension型彩色多普勒超声显像仪检测CIMT、平均狭窄程度、最重狭窄程度、斑块大小、斑块厚度,先进行横向探测后进行纵向探测,双侧共取10个测量值,取平均值。CIMT测定:选取颈总动脉开始膨大处近心端10~15 mm、膨大部及颈内动脉起始部上方1 cm处的远侧壁,测量内膜表明到中层与外膜交界面的垂直距离。平均狭窄程度、最重狭窄程度、斑块大小、斑块厚度测定:横向扫查观察血管壁的四周有无斑块,确定斑块所在位置,以血管长轴图像测量斑块的上下经及厚度,斑块大小以斑块长度×斑块厚度表示(mm2),当斑块呈非对称性时要用横向探测,确定斑块最大厚度、大小,狭窄程度指内径狭窄程度,即为[(正常血管腔直径-狭窄残留腔内径)/正常血管腔直径]×100%。Cys C、SUA:取患者晨起空腹抽静脉血3 mL,采用日立7600全自动生化分析仪检测血清Cys C、SUA,其中Cys C测定采用免疫比浊法,SUA测定采用过氧化物酶法。血压:患者测量前不服降压药,采用血压计测量右上肢血压,测量3次,取平均值。
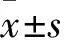
2 结果
2.1两组治疗前后左侧颈动脉硬化参数比较结果见表1。

表1 两组治疗前后左侧颈动脉硬化参数比较
注:与同组治疗前比较,*P<0.05;与对照组比较,△P<0.05。
2.2两组治疗前后右侧颈动脉硬化参数比较结果见表2。

表2 两组治疗前后右侧颈动脉硬化参数比较
注:与同组治疗前比较,*P<0.05;与对照组比较,△P<0.05。
2.3两组治疗前后血清Cys C、SUA水平及收缩压、舒张压比较结果见表3。

表3 两组治疗前后血清Cys C、SUA水平及收缩压、舒张压比较
注:与同组治疗前比较,*P<0.05;与对照组比较,△P<0.05。
3 讨论
高血压是造成心脑血管疾病发生的主要危险因素,治疗高血压不仅仅要求血压达标,更要尽可能减少由高血压引起的心脑血管疾病。高血压能引起全身血管阻力的持续升高,从而导致动脉管壁的僵硬,因动脉壁承受较高的压力,内皮细胞容易损伤,低密度脂蛋白易于进入动脉壁,从而刺激平滑肌细胞增殖,引发动脉粥样硬化[8,9]。因此,有效控制血压并降低其变异率可以减轻动脉硬化及减少心脑血管疾病的发生。
心脑血管疾病的发生与动脉内膜脂质沉积、血管炎症反应及动脉硬化呈正相关,研究[10]显示CIMT每增加1个标准差,心脑血管疾病的发生率就增加1.36倍,IMT是反映全身动脉硬化的早期指标[11],是心血管病变发生发展的必然阶段,并且是亚临床动脉粥样硬化以及心血管疾病终点事件发生的一个重要预测因子,在心脑血管疾病的发展过程中同时存在颈动脉内斑块形成,因此检测颈动脉内膜情况是判断心脑血事件发生风险的理想方法,颈动脉超声可以准确反映颈动脉内膜的斑块情况。在多种心脑血管病患者外周血检测出Cys C异常表达[12],Cys C是动脉粥样硬化形成的危险因素,是颈动脉内膜中层增厚的危险因素,可能原因是其可以参与调节机体内半胱氨酸蛋白酶、组织蛋白酶的活性,与动脉粥样斑块形成相关[13]。Cys C本身可以作为一种炎症因子,与其降解产物共同参与机体的炎症反应,从而会诱发和加重动脉粥样硬化进程[14]。另外Cys C会通过影响血清同型半胱氨酸的代谢,增强其对血管内皮细胞的毒性作用,刺激血管平滑肌增殖,促进动脉硬化发生发展。研究[15]表明,SUA是高血压、心脑血管疾病、糖尿病、高脂血症、肥胖等发生的危险因素,主要是因为高SUA可促进动脉硬化发生发展,其机制可能是其可直接损伤血管内皮细胞[16],即高SUA时可形成盐结晶,使缩血管物质、炎症介质、黏附因子表达增加,直接损伤血管壁及血管内皮细胞,从而促进冠状动脉粥样硬化发生。生理浓度的SUA具有抗氧化的作用,高浓度SUA可降低NO含量及生物利用度,激活RASS诱导血管平滑肌增殖,使蛋白亚基化和脂质氧化增加,加速动脉硬化形成[17]。高SUA通过影响线粒体的Na+-Ca2+通道使Ca2+超负荷,导致内皮细胞功能失调。高SUA可致使LDL氧化,通过促进VSMC增殖而影响动脉硬化发生发展[18]。
钙离子拮抗剂是常用的一线降压药物,降压效果显著且价格低廉。氨氯地平是第三代长效二氢吡啶类钙离子拮抗剂,分左旋体及右旋体,左旋体活性是右旋体的1 000倍,氨氯地平中仅左旋异构体具有扩张血管作用,故左旋氨氯地平具有降压更持久更平稳、不良反应少等优点,且对胰岛素抵抗、血糖、血脂无影响[19]。另外,苯磺酸左旋氨氯地平降压过程中不减少心脑肾等重要器官的血流量,对心肌收缩力和房室传导功能影响很小,口服吸收缓慢,峰谷比值较高,具有血压波动小、降压作用时间长的特点,同时该药以代谢产物的形式被清除,对肾功能不全者无影响[20]。研究[21]显示,苯磺酸左旋氨氯地平能明显增加动脉内径,使压力波反射点相对向远心端移位,从而减少收缩期反射波,能有效阻止动脉粥样硬化的发生和进展,是目前惟一采用血管腔内超声技术显示能阻截和消退冠状动脉粥样硬化斑块的降压药物。
本研究显示,两组治疗后双侧CIMT、平均狭窄程度、最重狭窄程度、斑块大小、斑块厚度较同组治疗前减小;观察组治疗后双侧CIMT、斑块大小较对照组增加,平均狭窄程度、最重狭窄程度、斑块厚度较对照组减小。两组治疗后血清Cys C、SUA水平及收缩压、舒张压较同组治疗前降低,观察组治疗后血清Cys C、SUA水平及收缩压、舒张压较对照组降低。提示苯磺酸左旋氨氯地平不仅能有效控制血压,还能降低炎症因子、抑制炎症反应,降低Cys C及SUA水平,减缓大动脉内膜增生,从而达到延缓动脉硬化进程、稳定动脉硬化斑块的作用,一定程度上延缓高血压引起的动脉硬化发展进程,减少高血压引起的心脑血管疾病并发症。其可能机制是:①苯磺酸左旋氨氯地平通过降压、降脂作用,从而降低血液及主动脉组织脂质过氧化,良好的清除氧自由基,避免血管壁破坏,阻止发生动脉硬化[22];②本研究观察组治疗后Cys C及SUA水平下降,这是因为氨氯地平可以减轻肾脏肥大,抑制氧自由基形成,促使NO产生,改善线粒体钙负荷[23],因此氨氯地平可以减少炎症因子、抑制炎症反应,从而对血管内皮功能起到保护作用,减轻动脉硬化程度;③氨氯地平通过降低内皮素-1水平、抑制巨噬细胞基质金属蛋白酶的分泌作用,可有效减少基质金属酶的产生,促进胶原纤维生成而加强纤维帽,进而抑制动脉硬化斑块内单核细胞聚集,减轻动脉硬化程度[24];④氨氯地平通过抑制血管平滑肌细胞的钙内流,抑制交感神经末梢释放去甲肾上腺素,使血管壁外周阻力下降、儿茶酚胺浓度下降,从而起到降压、降SUA、减轻动脉硬化程度的作用[25];⑤氨氯地平通过抑制炎症反应,有一定抗血小板聚集功能,从而保护血管内皮功能,稳定和缩小动脉粥样硬化斑块,降低CIMT、斑块大小、厚度、数量[26,27]。
参考文献:
[1] Bahrami H, Budoff M, Haberlen SA, et al. Inflammatory markers associated with subclinical coronary artery disease: the multicenter AIDS cohort study[J]. J Am Heart Assoc, 2016,5(6):e003371.
[2] Teague H, Mehta NN. The Link between inflammatory disorders and coronary heart disease: a look at recent studies and novel drugs in development[J]. Curr Atheroscler Rep, 2016,18(1):3.
[3] Okyay K, Yildirir A, Cicek M, et al. Serum cystatin C and neutrophil gelatinase-associated lipocalin in predicting the severity of coronary artery disease in diabetic patients[J]. Anatol J Cardiol, 2016,16(10):756-761.
[4] Purnima S, El-Aal BG. Serum uric acid as prognostic marker of coronary heart disease (CHD)[J]. Clin Investig Arterioscler, 2016,28(5):216-224.
[5] Neupane S, Dubey RK, Gautam N, et al. Association between serum uric acid, urinary albumin excretion, and glycated hemoglobin in Type 2 diabetic patient[J]. Niger Med J, 2016,57(2):119-123.
[6] Yokokawa H, Fukuda H, Suzuki A, et al. Association between serum uric acid levels/hyperuricemia and hypertension among 85,286 Japanese workers[J]. J Clin Hypertens (Greenwich), 2016,18(1):53-59.
[7] Byrkjeland R, Stensmith KH, Anderssen S, et al. Effects of exercise training on carotid intima-media thickness in patients with type 2 diabetes and coronary artery disease. Influence of carotid plaques[J]. Cardiovasc Diabetol, 2016,15:13.
[8] Walsh KB, Woo D, Sekar P, et al. Untreated hypertension: a powerful risk factor for lobar and nonlobar intracerebral hemorrhage in whites, blacks, and hispanics[J]. Circulation, 2016,134(19):1444-1452.
[9] Nargesi AA, Heidari B, Esteghamati S, et al. Contribution of vitamin D deficiency to the risk of coronary heart disease in subjects with essential hypertension[J]. Atherosclerosis, 2016,244:165-171.
[10] Naseh G, Fard MM, Kazemi T, et al. Comparison of carotid intima-media thickness in hypertensive patients and control group[J]. J Cardiovasc Echogr, 2016,26(2):48-51.
[11] Ferreira JP, Girerd N, Bozec E, et al. Intima-media thickness is linearly and continuously associated with systolic blood pressure in a population-based cohort (Stanislas cohort study)[J]. J Am Heart Assoc, 2016,5(6):e003529.
[12] Gevorgyan MM, Voronina NP, Goncharova NV, et al. Cystatin C as a marker of progressing cardiovascular events during coronary heart disease[J]. Bull Exp Biol Med, 2017,162(4):421-424.
[13] Agasthi P, Aloor S, Yarlagadda V, et al. Abstract P014: association between serum resistin levels and coronary artery disease: a Meta-analysis[J]. Circulation, 2016,133(Suppl 1):AP014-AP014.
[14] Hagg S, Fall T, Ploner A, et al. Adiposity as a cause of cardiovascular disease: a mendelian randomization study[J]. Int J Epidemiol, 2015,68(9):934-945.
[15] Ajmal MUR, Afzal SN, Abdali N, et al. Association of NAFLD with carotid atherosclerosis and serum uric acid level[J]. J Clin Exp Hepatol, 2016,6(1):S26-S26.
[16] von Lueder TG, Girerd N. The prognostic role of Serum Uric Acid (SUA) in coronary artery disease: persuasive data plea for a large morbidity-mortality trial[J]. Cardiology, 2016,134(3):357-359.
[17] Aribas A, Akilli H, Kayrak M, et al. Effect of serum uric acid on the positive predictive value of dobutamine stress echocardiography[J]. Heart Vessels, 2016,31(3):382-389.
[18] Kamei K, Konta T, Ichikawa K, et al. Serum uric acid levels and mortality in the Japanese population: the Yamagata (Takahata) study[J]. Clin Exp Nephrol, 2016,20(6):904-909.
[19] Derosa G, Cicero AF, Carbone A, et al. Different aspects of sartan + calcium antagonist association compared to the single therapy on inflammation and metabolic parameters in hypertensive patients[J]. Inflammation, 2014,37(1):154-162.
[20] Rath CL, He J, Nordling MM, et al. Acute intravenous calcium antagonist for suspected hemiplegic migraine-a case story[J]. Case Rep Neurol, 2017,9(1):98-105.
[21] Wen S, Li B, Jin Y, et al. Relation between serum inflammatory factors and lower-limb arteriosclerosis obliterans[J]. Int J Clin Exp Med, 2017,10(5):7965-7972.
[22] Ramírez-Morros A, Granado-Casas M, Alcubierre N, et al. Calcium phosphate product is associated with subclinical carotid atherosclerosis in type 2 diabetes[J]. J Diabetes Res, 2017,2017(4):1-8.
[23] Santilli S, Kast DR, Grozdev I, et al. Visualization of atherosclerosis as detected by coronary artery calcium and carotid intima-media thickness reveals significant atherosclerosis in a cross-sectional study of psoriasis patients in a tertiary care center[J]. J Transl Med, 2016,14(1):1-12.
[24] Duivenvoorden W, Hopmans S, Werstuck G, et al. Androgen-deprivation therapy-induced atherosclerosis in prostate cancer: differences between GnRH-agonist and antagonist[J]. Atherosclerosis, 2016,252:e87.
[25] Houde M, Desbiens L, Schwertani A, et al. Endothelin receptor antagonist macitentan or deletion of mouse mast cell protease 4 delays lesion development in atherosclerotic mice[J]. Life Sci, 2016,159:71-75.
[26] Lee DH, Chun EJ, Hur JH, et al. Effect of sarpogrelate, a selective 5-HT 2A, receptor antagonist, on characteristics of coronary artery disease in patients with type 2 diabetes[J]. Atherosclerosis, 2017,257:47-54.
[27] Kedar E, Gardner GC. Lipid-associated rheumatologic syndromes[J]. Rheum Dis Clin North AM, 2013,39(2):481-493.

