姜黄素灌胃对帕金森病大鼠中脑黑质氧化应激损伤的影响及其机制探讨
吕慧君,王运良,白宏英,娄季宇,梅可夫
(郑州大学第二附属医院,郑州 450014)
帕金森病(PD)是中老年人常见的中枢神经退行性疾病[1]。越来越多的证据表明,氧化应激可能是导致神经退行性疾病发生的关键因素[2]。姜黄素是姜黄中的一种主要活性多酚成分,具有抗癌、抗炎、抗氧化和神经保护等特性,被广泛用于治疗与炎症和氧化应激有关的疾病。Wnt信号通路参与调节多种细胞生物学行为,包括细胞形态与功能的维持、分化、免疫、应激和细胞凋亡等[3]。研究[4]表明,Wnt/β-catenin信号还可以影响H2O2介导的细胞死亡。但目前国内外文献对Wnt/β-catenin信号通路在PD中的研究较为少见。因此本研究通过观察姜黄素对PD大鼠氧化应激损伤的影响,并探讨其可能机制,旨在为PD的临床治疗提供理论依据。
1 材料与方法
1.1实验动物成年雄性SD大鼠100只,体质量200~220 g,由北京维通利华实验动物技术有限公司提供。实验大鼠均饲养在无病原体条件下,自由获取食物和水,环境控制在21~23 ℃、40%~50%相对湿度。
1.2主要试剂1.2 6-羟基多巴胺(6-OHDA);抗坏血酸、戊巴比妥钠、阿朴吗啡;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒;一抗酪氨酸羟化酶(TH)多克隆抗体(1∶500);链霉卵白素-生物素复合物、DAB显色剂;兔抗β-catenin、Wnt3a单克隆抗体;姜黄素(10 μmol/L)。
1.3PD模型制备、实验动物分组及姜黄素给予方法随机选80只SD大鼠,以戊巴比妥钠(40 mg/kg)腹腔注射麻醉,将大鼠固定于脑立体定位仪上,参照Paxinos和Watson大鼠脑立体定位图谱,确定右侧纹状体区坐标(前囟前1.0 mm,中线右侧3.0 mm,硬膜下4.0/5.0 mm),用微量注射器在上述两个靶点注入8 μg的6-OHDA(溶于4 μL含0.2%的抗坏血酸的生理盐水中),注射速度为1 μL/min,注毕留针10 min,之后缓慢退针(2~3 min),速度为1 μL/min,注射完毕后留针10 min,然后匀速缓慢退针,术后常规处理切口。PD模型制备成功标准:模型建立1周后,腹腔注射阿扑吗啡(0.5 mg/kg)诱发大鼠旋转行为,记录30 min内旋转次数,若大鼠恒定向左旋转,且旋转圈>210 r/30 min,则视为造模成功。共56只(70%)大鼠造模成功,从中随机选取40只,随机分为姜黄素组和模型组各20只;另取20只正常大鼠作为对照组。姜黄素组在造模成功24 h后灌胃给予姜黄素灌胃2 mL,1次/d,持续21 d;其余两组给予等量蒸馏水。
1.4大鼠损伤侧中脑黑质TH阳性细胞数观察采用免疫组化法。每组随机选取10只大鼠,采用3%戊巴比妥钠灌胃(50 mg/kg)麻醉后经左心室插管依次灌流生理盐水及含0.04%多聚甲醛的0.1 mol/L的磷酸盐缓冲溶液(PBS,pH7.2~7.4)固定组织。断头取脑,固定4 h,浸泡在4 ℃含20%蔗糖的0.1 mol/L的PBS中过夜。将中脑腹侧作连续冰冻冠状切片,片厚20 μm。切片首先与一抗[TH,1∶500]4 ℃孵育过夜;然后与二抗生物素化羊抗小鼠IgG(1∶300)反应1 h,并用辣根过氧化物酶标记的链霉卵白素-生物素复合物反应2 h。最后用含有3,3-二氨基联苯胺的缓冲液进行着色。随机选取每只大鼠脑切片5张,分别在右侧黑质阳性细胞密集区中央部分取4个互不重叠的高倍视野,计数视野内TH阳性细胞数。
1.5大鼠损毁侧中脑黑质SOD、GSH-Px、MDA检测每组取剩余10只大鼠,用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后处死,新鲜取脑。将脑组织定位取出黑质后,把损毁侧黑质部分剪切成小块,取一半(另一半用于Wnt3a、β-catenin蛋白检测)精密称重,按质量(g)∶体积(mL)=1∶9比例加9倍生理盐水,冰水浴条件下机械匀浆,制备成浓度为10%匀浆液,以4 000 r/min离心15 min,取上清液保留备用。采用黄嘌呤氧化酶法和二硫代二硝基苯甲酸法分别检测SOD、GSH-PX活性,硫代巴比妥酸法检测MDA含量,严格按试剂盒说明书步骤进行检测。
1.6大鼠损伤侧中脑黑质Wnt3a、β-catenin蛋白检测采用免疫蛋白印迹法。取另一半黑质放于预冷的玻璃匀浆器中,按说明加入蛋白裂解液,匀浆器充分研磨,裂解液于4 ℃、12 000 r/min离心10 min,取上清液,加上样缓冲液,取蛋白样品进行十二烷硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳。5%浓缩胶和8%分离凝胶用于跨膜。将膜洗涤5次,每次3 min,然后用密封流体密封1 h。以1∶1 000稀释制备的兔抗β-catenin和Wnt3a单克隆抗体置入4 ℃环境下培养过夜。用清洗液洗涤该膜3次,每次3 min。加入辣根过氧化物酶兔抗小鼠IgG二抗(1∶1 500),37 ℃恒温摇床上,低速摇动孵育1 h,缓冲液洗涤。ECL显色,以GAPDH作为内参,采用Image J软件分析目的条带的灰度值,以目标蛋白/内参蛋白比值表示结果。
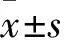
2 结果
2.1各组中脑黑质TH阳性细胞数比较姜黄素组、模型组、对照组TH阳性细胞数分别为(23.38±4.37)、(5.68±4.46)、(58.41±8.12)个,两两比较,P均<0.05。
2.2各组大鼠中脑黑质SOD、GSH-PX活性及MDA含量比较结果见表1。

表1 各组大鼠中脑黑质SOD、GSH-PX活性及MDA含量比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.3各组中脑黑质Wnt3a、β-catenin蛋白相对表达量比较结果见表2。

表2 各组大鼠黑质区Wnt3a、β-catenin蛋白相对表达量比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨论
PD是由多种因素如遗传因素、内源性活性氧类等共同作用的结果,通过氧化应激、神经炎症等多种机制导致中脑黑质多巴胺能神经元大量变性缺失。目前,对PD的发病和进展机制仍不明确,PD患者黑质区脂质和蛋白氧化水平较正常人高,抗氧化蛋白水平较低,因此氧化应激被认为是导致多巴胺能神经元变性的潜在机制[5]。TH是多巴胺生物合成途径的关键酶,可大量产生活性氧自由基(ROS),ROS可导致TH失活,与PD的发生发展密切相关[6]。SOD是生物体内重要的抗氧化酶,能清除超氧自由基,其活力的高低间接反映了机体清除自由基的能力。GSH-Px是机体内一种重要的催化过氧化氢分解的酶,防止羟自由基的产生。MDA是生物体内氧自由基攻击脂质产生的一种脂质过氧化物,反映膜脂过氧化的程度,具有细胞毒性,间接反映细胞损伤的程度。抗氧化剂(SOD、GSH-Px等)的共同作用保护了细胞和组织免受氧化应激的损伤。6-OHDA在大鼠中脑黑质纹状体区通过快速自我氧化产生氧自由基,对膜脂质和蛋白质水平造成氧化损伤,引起GSH、抗氧化酶、SOD和过氧化氢酶的降低,最终导致黑质神经元的损伤[7]。本文结果显示,模型组中SOD、GSH-Px活性下降,MDA含量升高。提示PD大鼠处于氧化应激状态,与文献[8]报道一致。
姜黄素是从姜黄中提取的一种主要着色剂,是一种多酚类物质,具有抗癌、抗炎、抗氧化和神经保护等多种特性[9]。在临床上,姜黄素被广泛用于与炎症、氧化应激有关的疾病治疗[10]。Song等[11]发现,姜黄素通过脑黑质区SOD、GSH-Px活性升高及MDA含量降低,拮抗黑质区域6-OHDA诱导的神经损伤。Cui等[12]研究表明,姜黄素能够通过激活蛋白激酶B/核因子E2相关因子2信号通路,显著减轻鱼藤酮诱导的多巴胺能神经元的氧化应激损伤。本研究表明,姜黄素能增加PD大鼠TH阳性细胞数,通过提高SOD和GSH-PX的活性,降低MDA含量,提高PD大鼠抗氧化能力和减少自由基。姜黄素可通过降低氧化应激,减少多巴胺能神经元的损伤,与研究[13]结果一致,从而发挥对PD的治疗作用。
Wnt3a是Wnt经典通路的主要细胞外信号分子之一,能促进氧化应激状态下黑素细胞的存活,并帮助氧化应激状态下细胞内活性氧的清除[3]。体内和体外研究显示,Wnt3a存在于海马神经源性中,并调节齿状回中的新发神经[14]。Eaf2通过对Wnt3a信号通路的作用抑制过氧化氢导致的氧化应激损害。β-catenin是Wnt信号转导途径的关键蛋白,它在多种细胞的增殖、分化、运动、衰老及形态发生中发挥重要作用,它可以抑制皮肤的氧化应激反应,延缓皮肤细胞衰老[15]。神经毒剂拮抗中脑多巴胺神经元中的Wnt/β-catenin,Wnt/β-catenin可以抑制正在进行的炎症反应,保护黑质DA神经元免受有害攻击,证明Wnt/β-catenin信号通路参与PD的发病机制[16]。罗欣等[17]通过激活Wnt/β-catenin信号通路,对滋养细胞氧化应激损伤有保护性作用。本文结果表明,姜黄素可减轻氧化应激的损伤,其机制可能是通过激活Wnt/β-catenin信号通路,增强Wnt3a、β-catenin蛋白表达,提高SOD和GSH-PX活性,降低MDA含量,保护多巴胺能神经元,从而干预PD的发生和发展。考虑到分子和神经系统的复杂性,需要进行更多的研究来找出准确的机制。
参考文献:
[1] Gazewood JD, Richards DR, Clebak K. Parkinson disease: an update[J]. Am Fam Physician, 2013,87(4):267-273.
[2] Sarrafchi A, Bahmani M, Shirzad H, et al. Oxidative stress and Parkinson′s disease: new hopes in treatment with herbal antioxidants[J]. Curr Pharm Des, 2016,22(2):238-246.
[3] 郑妍,杨珂,李娅莎,等.Wnt3a减轻黑素细胞iMC65氧化应激损伤[J].基础医学与临床,2017,37(10):1389-1394.
[4] Kook SH, Lee D, Cho ES, et al. Activation of canonical Wnt/beta-catenin signaling inhibits H2O2-induced decreases in proliferation and differentiation of human periodontal ligament fibroblasts[J]. Mol Cell Biochem, 2016,411(1-2):83-94.
[5] Dias V, Junn E, Mouradian MM. The role of oxidative stress in Parkinson′s disease[J]. J Parkinson Dis, 2013,3(4):461-91.
[6] 张晓录,张逢春,李尧华.酪氨酸羟化酶与帕金森病的关系研究[J].北华大学学报(自然科学版),2005(3):224-227.
[7] Khan MM, Raza SS, Javed H, et al. Rutin protects dopaminergic neurons from oxidative stress in an animal model of Parkinson′s disease[J]. Neurotox Res, 2012,22(1):1-15.
[8] Wang P, Niu L, Gao L, et al. Neuroprotective effect of gypenosides against oxidative injury in the substantia nigra of a mouse model of Parkinson′s disease[J]. J Int Med Res, 2010,38(3):1084-1092.
[9] Mythri RB, Bharath MM. Curcumin: a potential neuroprotective agent in Parkinson′s disease[J]. Curr Pharm Des, 2012,18(1):91-99.
[10] Kim SJ, Son TG, Park HR, et al. Curcumin stimulates proliferation of embryonic neural progenitor cells and neurogenesis in the adult hippocampus[J]. J Biol Chem, 2008,283(21):14497-14505.
[11] Song S, Nie Q, Li Z, et al. Curcumin improves neurofunctions of 6-OHDA-induced parkinsonian rats[J]. Pathol Res Pract, 2016,212(4):247-251.
[12] Cui Q, Li X, Zhu H. Curcumin ameliorates dopaminergic neuronal oxidative damage via activation of the Akt/Nrf2 pathway[J]. Mol Med Rep, 2016,13(2):1381-1388.
[13] Ataie A, Sabetkasaei M, Haghparast A, et al. Neuroprotective effects of the polyphenolic antioxidant agent, curcumin, against homocysteine-induced cognitive impairment and oxidative stress in the rat[J]. Pharmacol Biochem Be, 2010,96(4):378-385.
[14] Shruster A, Eldar-Finkelman H, Melamed E, et al. Wnt signaling pathway overcomes the disruption of neuronal differentiation of neural progenitor cells induced by oligomeric amyloid β-peptide[J]. J Neurochem, 2011,116(4):522-529.
[15] 田黎明,谢红付,李吉,等.氧化应激所致的人皮肤成纤维细胞衰老中β-连环蛋白的表达研究[J].中华皮肤科杂志,2011,(4):259-262.
[16] L′Episcopo F, Tirolo C, Caniglia S, et al. Targeting Wnt signaling at the neuroimmune interface for dopaminergic neuroprotection/repair in Parkinson′s disease[J]. J Mol Cell Biol, 2014,6(1):13-26.
[17] 罗欣,庄白妹,饶海英,等.经典Wnt/β-catenin信号通路介导子痫前期滋养细胞氧化应激损伤的机制研究[J].重庆医科大学学报,2015(6):801-805

