胃癌高表达转录本1对胃癌细胞株AGS增殖、周期的影响及其机制
万颖,严芝强,韦四喜,夏英,刘娟娟,周春欢,黄海,
(1贵州医科大学,贵阳 550004;2贵州医科大学附属医院;3贵阳中医学院第一附属医院)
胃癌是好发于胃窦部胃黏膜腺上皮细胞的恶性肿瘤,其发生发展是一个复杂过程,涉及抑癌基因、致癌基因、细胞周期调控和蛋白异常编码、表达等多种表观遗传的改变[1~3]。据全球癌症统计数据显示,胃癌发病率排名第4,亚洲约占世界患病总数的六成[4],中国每年约有30万人死于胃癌。由于缺乏早期特异性的检测方法和指标,许多患者就诊时已处于胃癌晚期,5年生存率低[5,6]。长链非编码RNA(LncRNA)是一类内源性RNA,通常由RNA聚合酶Ⅱ转录而成,以RNA的形式发挥作用,缺乏开放阅读框,可通过表观遗传、转录和转录后水平调节蛋白表达[7]。LncRNA在调控细胞增殖分化、肿瘤发生发展、疾病诊断及预后判断等各方面都起着重要作用[8~10]。胃癌高表达转录本1(GHET1)全长1 913 nt,是一种LncRNA,定位于人类基因组染色体7q36.1,在胃癌组织和细胞中都异常增高[11]。本研究观察了GHET1对胃癌细胞株AGS增殖、周期的影响,并探讨其机制。
1 材料与方法
1.1主要仪器及试剂实时荧光定量PCR仪,流式细胞仪,蛋白分析系统。LipofectamineTMRNAiMAX,Opti-MEM低血清培养基,逆转录试剂盒,SYBR®Premix Ex TaqTMⅡ,Cell Counting Kit-8,细胞周期试剂盒,BCA蛋白浓度测定试剂盒,周期蛋白依赖性激酶4(CDK4)、CDK6、CDK2及细胞周期蛋白E(Cyclin E)、Cyclin D兔源单克隆抗体,β-actin兔源多克隆抗体,ECL化学发光试剂盒。
1.2GHET1干扰序列si-GHET1转染及细胞GHET1检测取对数生长期AGS细胞,用含10%胎牛血清和1%谷氨酰胺的RPMI1640无双抗完全培养基吹打重悬,以每孔2×105个接种于6孔板中,置于5%CO2、37 ℃环境的温箱中培养,待细胞融合度约60%时进行分组。实验共分为3组,干扰组取特定GHET1干扰序列si-GHET1和脂质体LipofectamineTMRNAiMAX,分别加入opti-MEN中混合5 min,缓慢加入6孔板中,使si-GHET1终浓度为33.3 pmol/mL;阴性组取等量乱序无意义序列si-NC和脂质体LipofectamineTMRNAiMAX,转染方法同干扰组;空白组加入等量opti-MEN,其余不做任何处理。si-RNA序列由上海吉玛公司设计合成。转染6 h后用无双抗的完全培养基换液,继续培养细胞到48 h,向细胞培养板中加入适量TRIzol充分裂解细胞,提取细胞总RNA,测定总RNA的纯度和浓度并逆转录成cDNA。采用SYBR Green Ⅱ荧光染料法进行real-time PCR扩增,扩增引物由上海生工设计合成。采用2-ΔΔCT表示目的基因的相对表达量,实验重复3次,取平均值。
1.3细胞增殖能力检测取对数生长期AGS细胞,以7 000/孔接种于96孔板中,每孔加入100 μL无双抗培养基,实验分组及各组转染方法同“1.2”,每组设置5个复孔。用CCK-8法,于450 nm波长处用酶标仪测定在0、24、48、72 h的吸光度值(OD450值),实验重复3次,取平均值。
1.4细胞周期分布观察取对数生长期AGS细胞,以2×105/孔接种于6孔板中,实验分组及各组转染方法同1.2,收集转染48 h后各组细胞,加入70%预冷乙醇固定过夜,并于次日依次加入RNase A Solution和PI染液,使用流式细胞仪进行检测,结果用modfit软件进行分析,以细胞周期各阶段百分比表示结果,实验重复3次,取平均值。
1.5细胞周期相关蛋白检测取对数生长期AGS细胞,以2×105/孔接种于6孔板中,实验分组及各组转染方法同1.2,收集6孔板中转染48 h的各组细胞,按量加入蛋白RIPA强效裂解液,冰上裂解30 min,期间混匀震荡3次,离心后上清即为细胞总蛋白,BCA法测定各细胞样本蛋白含量。电泳-转膜后,CDK2、CDK4、CDK6、Cyclin D、Cyclin E、β-actin于一抗孵育盒中4 ℃孵育过夜,次日取出,1×TBST洗膜3次,每次10 min,放入二抗孵育盒中室温孵育2 h,1×TBST洗膜3次,每次10 min,ECL法显影。Image-J软件对蛋白条带进行灰度值分析,以目的蛋白条带灰度值比内参β-actin灰度值表示CDK2、CDK4、CDK6、Cyclin D、Cyclin E的相对表达量,实验重复3次,取平均值。
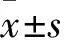
2 结果
2.1各组细胞GHET1相对表达量比较干扰组、阴性组、空白组GHET1相对表达量分别为0.42±0.06、1、1.15±0.19,干扰组与其余两组比较,P<0.05。
2.2培养不同时点各组细胞OD450值比较见表1。

表1 培养不同时点各组细胞OD450值比较
注:与其余两组比较,*P<0.05。
2.3各组细胞周期比较干扰组、阴性组、空白组G0/G1期细胞比例分别为62.01%±4.56%、47.03%±3.36%、44.65%±3.44%,干扰组与其余两组比较,P均<0.05;S期细胞比例分别为20.34%±3.29%、32.25%±1.78%、32.96%±2.58%,干扰组与其余两组比较,P均<0.05;G2/M期细胞比例分别为17.65%±1.58%、20.72%±3.42%、22.40%±2.61%,两两比较,P均>0.05。
2.4各组细胞周期相关蛋白相对表达量比较结果见表2。

表2 各种细胞周期相关蛋白相对表达量比较
注:与其余两组比较,*P<0.05。
3 讨论
胃癌是消化系统中常见的恶性肿瘤,在我国胃癌患者的病死率在男性中仅次于肺癌,在女性中仅次于乳腺癌[12],严重威胁人的健康和生命。目前,学者对LncRNA与胃癌作用的研究主要体现在两方面,一方面是希望从研究中发现一些具有高特异度和高灵敏度的肿瘤标志物,为肿瘤的早期诊断提供更有临床价值的参考信息;另一方面是研究出能够抑制肿瘤生长的靶向效应RNA片段,使靶向治疗相关肿瘤成为可能。GHET1最早发现于胃癌组织中[13],并与肿瘤的直径、侵袭能力和预后相关;Liu等[14]研究证实,高表达的GHET1与食管鳞状细胞癌的分化程度、淋巴转移和预后有关;Ding等[15]发现,GHET1可通过调节ATF1和乙酰化H3K27的表达量来促进肝癌的发生;Zhou等[16]在结直肠癌中敲低GHET1的表达,发现其可通过参与上皮-间质转换抑制细胞侵袭;大量研究提示,GHET1与肿瘤的发生发展、细胞侵袭、上皮间质转化等现象有关,但其在胃癌细胞增殖及周期的具体调控机制方面却鲜有报道。本研究中,我们通过CCK-8实验发现敲低GHET1后,干扰组细胞在48、72 h时增殖能力受到抑制,流式细胞术PI单染结果进一步证明细胞周期被阻滞在G0/G1期,提示GHET1可能通过阻滞细胞周期的进展而抑制细胞的增殖。
正常机体是由细胞增殖及凋亡共同参与维持的,其过程受到多种基因的调控,一旦这些基因异常表达,将导致肿瘤的发生发展。细胞增殖主要受周期调控影响,由多种信号通路共同参与,是一个复杂的网络调控过程。细胞周期的4个连续阶段的进展是由Cyclins、CDKs及其抑制剂之间的相互作用而介导的[17]。Cyclin D是由11号染色体上CCND1编码的含有295个氨基酸的蛋白分子,其表达量的增加可使细胞的G1期缩短,减弱有丝分裂原的依赖性[18],主要参与细胞G0/G1期的转换,Cyclin D与CDK4、CDK6相互作用并形成复合物以调节G1期细胞进展。Cyclin E主要参与细胞G0/G1期向S期的转换,是S期的关键调控蛋白,其活性降低,会使细胞阻滞在G0/G1期[19]。CDK2作为丝氨酸/苏氨酸激酶家族的一员,是细胞周期的重要推动因素,Cyclin E通过与CDK2结合形成复合物来控制细胞G1期向S期的细胞进展[20]。本研究显示,沉默GHET1后,Cyclin D、CDK4、CDK6相对表达量下降,使细胞阻滞在G0/G1期,Cyclin E与CDK2表达下降,使细胞在G1向S期转换的活性降低,提示GHET1作为胃癌细胞增殖调控的重要影响因素,可能通过上调周期相关蛋白的表达来促进胃癌细胞增殖,进而加速胃癌的发生发展。此结果可为后续进一步探索GHET1参与胃癌增殖、调控细胞周期的具体分子靶标的研究奠定基础。
参考文献:
[1] Yakirevich E, Resnick MB. Pathology of gastric cancer and its precursor lesions [J]. Gastroenterol Clin North Am, 2013,42(2):261-284.
[2] Kim Y, Cho MY, Kim J, et al. Profiling cancer-associated genetic alterations and molecular classification of cancer in Korean gastric cancer patients[J]. Oncotarget, 2017,8(41):69888-69905.
[3] Yoon H, Kim N. Diagnosis and management of high risk group for gastric cancer [J]. Gut Liver, 2015,9(1):5-17.
[4] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011,61(2):69-90.
[5] Piazuelo MB, Correa P. Gastric cancer: overview[J]. Colomb Med (Cali), 2013,44(3):192-201.
[6] Geng R, Li J. Apatinib for the treatment of gastric cancer[J]. Expert Opin Pharmacother, 2015,16(1):117-122.
[7] Mercer TR, Dinger ME, Mattick JS. Long non-coding RNAs: insights into functions [J]. Nat Rev Genet, 2009,10(3):155-159.
[8] Schmitt AM, Chang HY. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016,29(4):452-463.
[9] Liu Z, Chen Z, Fan R, et al. Over-expressed long noncoding RNA HOXA11-AS promotes cell cycle progression and metastasis in gastric cancer[J]. Mol Cancer, 2017,16(1):82.
[10] Nie F, Yu X, Huang M, et al. Long noncoding RNA ZFAS1 promotes gastric cancer cells proliferation by epigenetically repressing KLF2 and NKD2 expression[J]. Oncotarget, 2016,13(24):38227-38238.
[11] 夏英,严芝强,毕瑩,等.长链非编码RNA GHET1在胃癌中的表达及其临床意义[J].实用医学杂志,2016,32(9):1418-1421.
[12] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China [J]. CA Cancer J Clin, 2016,66(2):115-132.
[13] Yang F, Xue X, Zheng L, et al. Long non-coding RNA GHET1 promotes gastric carcinoma cell proliferation by increasing c-Myc mRNA stability[J]. FEBS J, 2014,281(3):802-813.
[14] Liu H, Zhen Q, Fan Y. LncRNA GHET1 promotes esophageal squamous cell carcinoma cells proliferation and invasion via induction of EMT[J]. Int J Biol Markers, 2017,32(9):403-408.
[15] Ding G, Li W, Liu J, et al. LncRNA GHET1 activated by H3K27 acetylation promotes cell tumorigenesis through regulating ATF1 in hepatocellular carcinoma[J]. Biomed Pharmacother, 2017,94(10):326-331.
[16] Zhou J, Li X, Wu M, et al. Knockdown of Long Noncoding RNA GHET1 inhibits cell proliferation and invasion of colorectal cancer[J]. Oncol Res, 2016,23(6):303-309.
[17] Gérard C, Goldbeter A. The balance between cell cycle arrest and cell proliferation: control by the extracellular matrix and by contact inhibition[J]. Interface Focus, 2014,4(3):20130075.
[18] Qie S, Diehl JA. Cyclin D1, cancer progression, and opportunities in cancer treatment[J]. J Mol Med, 2016,94(12):1313-1326.
[19] Tominaga O, Nita ME, Nagawa H, et al. Expressions ofcell cycle regulators in human colorectal cancercell lines[J]. Jpn J Cancer Res, 1997,88(9):855-860.
[20] Chikara S, Lindsey K, Dhillon H, et al. Enterolactone induces G1-phase cell cycle arrest in nonsmall cell lung cancer cells by downregulating cyclins and cyclin-dependent kinases[J]. Nutr Cancer, 2017,69(4):652-662.

