3,5-二溴水杨醛缩和4-乙基苯胺希夫碱的合成、表征及其生物活性研究*
刘 钊 曾灿彪 黄 浩 柯 玲 陈星合
(肇庆学院食品与制药工程学院,广东肇庆 526061)
希夫碱的应用涉及催化领域、分析化学领域、功能材料领域、生物和医学领域等,因此对希夫碱进行研究并深入探索它的结构、化合物的稳定性、化学性质、生物特性等有着重要意义。水杨醛系列希夫碱备受瞩目,因其具有良好的抑菌和抗氧化性,而水杨醛本身也有良好的药理作用,还应用于止痛、抗炎、抗病毒等方面。希夫碱的官能团(RC=N)与叶酸分子中的喋啶构造类似,两者对叶酸还原酶产生竞争性抑制,叶酸的生成因此作用受到抑制,从而使细菌体内核苷酸和氨基酸的合成受阻,导致细菌停止生长和繁殖。用于测定抗菌物质抑菌效果的主要方法有定量稀释法(MIC法) 和定性扩散法。扩散法通过测量在培养基上含样品纸片的抑菌圈直径,判断其对细菌的抑菌效果,也可以用含不同浓度样品的滤纸片进行抑菌试验。目前,对希夫碱的抗氧化能力有不少研究和报道。樊素芳等人探讨了壳寡糖水杨醛系列希夫碱的抗氧化活性,并与壳寡糖对照比较。本文以3,5-二溴水杨醛和4-乙基苯胺为底物,设计并合成新型希夫碱,对其结构进行表征,并研究其生物活性。采用溶剂热法合成希夫碱,用红外、紫外光谱及核磁共振谱图等进行结构表征,用纸片扩散法和DPPH法进行抑菌活性及抗氧化活性的研究,以期为进一步研究3,5-二溴水杨醛类希夫碱及其生物活性提供参考依据。
1 材料与方法
1.1 材料与仪器
试剂:3,5-二溴水杨醛,纯度98%,Aladdin Industrial Corporation;4-乙基苯胺,纯度99%,Aladdin Industrial Corporation; DPPH/2,2-二苯基-1-苦基肼,BR,纯度96%,上海源叶生物科技有限公司;N,N-二甲基甲酰胺,AR,西陇化工股份有限公司;其他常规试剂,均为分析纯。
仪器:UV-2600紫外可见分光光度计,SHIMADZU CIRPORATION KYOTO JAPAN;FTIR-8400S红外光谱仪,CE日本岛津制作所;AVANCEIII 400MHz核磁共振仪,德国布鲁克公司等。
1.2 方法
1.2.1 希夫碱的合成
称取5 mmol(约1.399 5 g) 3,5-二溴水杨醛置于烧杯中,加入10 mL无水乙醇,水浴致其溶解,溶解后转入100 mL的圆底烧瓶中。称取5 mmol(约0.610 9 g) 4-乙基苯胺,用10 mL无水乙醇溶解至呈无色溶液,将无色溶液倒入50 mL的烧杯中。将溶液混合加入圆底烧瓶,安装好回流装置置于集热式磁力搅拌器中搅拌,65℃恒温回流反应2.5 h。用薄层色谱法(TLC:thin-layer chromatography)跟踪反应并确定其反应终点。展开剂为石油醚和乙酸乙酯(体积比4∶1),GF254薄层层析硅胶板。
新希夫碱合成过程的化学方程式如图1所示。
1.2.2 红外光谱对新希夫碱结构的表征

图1 新希夫碱化合成的化学反应方程式
采用FTIR-8400S傅里叶红外光谱仪对新产物进行测定,取微量经过重结晶洗涤纯化的新希夫碱产物制成薄片,分辨率4 cm-1,波数范围400 cm-1~4 000 cm-1,扫描次数20次。
1.2.3 紫外光谱对新希夫碱结构的表征
取微量干燥的希夫碱样品,测量扫描范围200 nm~800 nm。用正已烷配制成浓度适当的溶液,使得所测定样品的吸收顶峰吸收值落在记录范围0~0.4内。同时用正已烷做空白扣除。
1.2.4 核磁共振H谱图对新希夫碱结构的表征
在核磁共振分析中,化学位移在扫场时用磁感应强度的改变来表示。用TMS(四甲基硅烷) 作内标,在新希夫碱溶液中加入少许TMS,以TMS中氢核共振时的磁感应强度作为标准,将它的化学位移规定为0。
核磁共振H谱选用CDCl3(氘代氯仿) 为溶剂,400 MHz的条件下TMS内标法测定新希夫碱的1H NMR。
同时通过化学软件Chemdraw模拟出希夫碱的理论氢谱图、氢谱峰图等对新化合物进行表征,进一步确定其化合物的结构。
1.2.5 核磁共振C谱图对新希夫碱结构的表征
核磁共振C谱选用CDCl3为溶剂,100 MHz的条件下TMS内标法测定新希夫碱的13CNMR。
通过Chemdraw模拟出希夫碱的理论碳谱图、碳谱峰图等对新化合物进行表征,确定所合成的希夫碱为理论中的希夫碱。
1.2.6 熔点的测定
将样品先用5℃/min粗测,粗测完成后,再将起始温度设置成比粗测熔点低5℃,最后用升温速率1℃/min精测。
1.2.7 溶解性的测定
采用不同溶剂,将保存良好,干燥的样品溶于其中,观察其溶解性;溶剂包括N,N-二甲基甲酰胺(DMF)、乙醇、甲醇和水。
1.2.8 新希夫碱抑菌活性的研究
准备好牛肉膏培养基、沙氏劳保培养基、无菌生理盐水、扩散平板。用无菌操作分别将细菌(大肠杆菌、金黄色葡萄球菌、沙门氏菌、枯草杆菌)活化。取活化好的细菌接入9 mL无菌生理盐水中,充分分散菌体。采用10倍系列稀释法,制备10倍系列稀释菌悬液。各梯度菌悬液进行涂布记数,每次用移液管吸取0.2 mL该梯度菌悬液于倒好平板的牛肉膏培养皿中,采用画半圆法使菌液分布均匀,涂布完成后正置15 min,将平板翻转,37℃下培养24 h。选取细菌浓度范围在108CFU/mL的试管做菌悬液。
取出已活化的霉菌菌种,洗脱于9 mL灭菌生理盐水中,制成孢子悬浮液。对霉菌悬浮液的孢子数进行计数。以DMF为溶剂,分别称取适量的待测新希夫碱于50 mL烧杯中,分别制得质量浓度为10 mg/mL、5 mg/mL、1 mg/mL的溶液。将足够数量的滤纸片(直径为6 mm) 浸泡于溶液中,充分浸泡2 h备用(同时做DMF溶液空白对照)。量取0.2 mL菌悬液,将其加入并涂布于冷却凝固完成的平板表面,将均匀涂布0.2 mL菌液的平板平均分为4个区域,分别对应空白组(DMF),浓度为10 mg/mL、5 mg/mL、1 mg/mL的样品液,做好标记,用无菌镊子依次夹取浸泡于10mg/mL、5mg/mL、1 mg/mL的DMF溶液的滤纸片,放置于平板内固定,平行试验3次。细菌于37℃活化24 h,真菌于25℃活化48 h。待活化完毕后,取出培养基,观察抑菌结果,用游标卡尺量取抑菌圈直径,记录平均值。
1.2.9 新希夫碱的抗氧化活性研究
准确称取0.0100 gDPPH(MDPPH=394.32) 固体,用无水乙醇溶解并定容于250 mL容量瓶,配成0.1 mmol/L DPPH溶液置于暗处备用。用DMF制得系列浓度的新希夫碱样液,以及系列浓度的Vc溶液(对照液)。用3 mLDMF溶液与1 mL无水乙醇溶液作空白调零。分别取3 mL DMF和1 mL DPPH溶液于比色管中,置于暗处反应30 min,在517 nm处比色,记录数值,记为A0。分别取3 mL不同浓度希夫碱溶液和1 mLDPPH溶液于比色管中,置于暗处反应30 min,在517 nm处比色,记为Ai。分别取3 mL不同浓度希夫碱溶液和1 mL无水乙醇溶液于比色管中,置于暗处反应30 min,在517 nm处比色,记为Aj。DPPH自由基清除能力的计算:清除率=[1-(Ai-Aj)/A0]×100%。算出不同浓度希夫碱溶液对DPPH的清除能力,绘制出散点折线图。计算出希夫碱与Vc溶液对DPPH的半数清除率(IC50)。
2 结果与分析
2.1 合成结果
新希夫碱为干燥橙红色晶体,总产量为1.4929g,产率74.3%,样品在空气中稳定存在。
2.2 表征结果分析
2.2.1 红外光谱对新希夫碱结构的表征分析
红外光谱测试结果如图2所示。
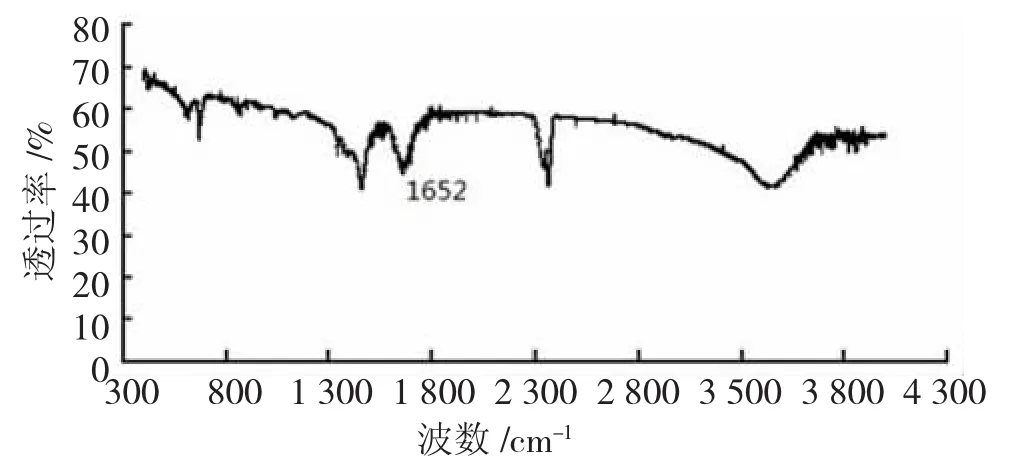
图2 新希夫碱的红外吸收光谱图
通过谱图分析,在波数为1 655 cm-1~1 900 cm-1处无明显的强吸收峰,表明-C=O消失,新产物产生。在波数为1 652 cm-1处的强特征吸收峰为-CH=N-的伸缩振动,此为表征希夫碱结构的特征官能团已经生成并被检测到。波数为1 504 cm-1的特征吸收峰为苯环的骨架振动,在波数为706 cm-1的特征吸收表明苯环上有1,2,3-三取代物,3 505 cm-1处则为羟基的伸缩振动吸收峰,在605 cm-1处溴的吸收峰,波数为2 450 cm-1处推断为亚甲基特征吸收峰。因此,红外谱图表征结果与新产物希夫碱的结构基本吻合。
2.2.2 紫外光谱对新希夫碱结构的表征分析
紫外光谱扫描结果如图3所示。

图3 新希夫碱的紫外吸收光谱图
从图3中可以看出,希夫碱在202 nm、231 nm、275 nm、316 nm、332 nm、359 nm处有最大吸收峰,特征吸收波长分析结果见表1。
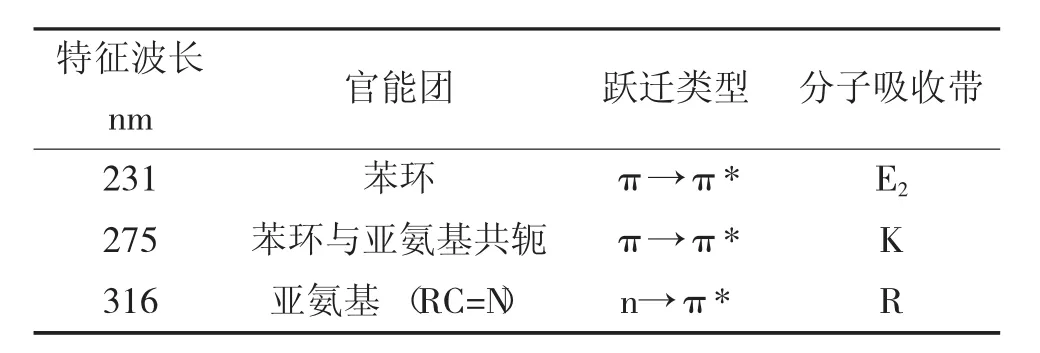
表1 特征吸收波长分析
从表1中可以看出,原本的-C=O结构消失,新产物产生。这进一步证明了N原子进行了配位及亚氨基的生成。
2.2.3 核磁共振H谱图对新希夫碱结构的表征分析
通过Chemdraw模拟出希夫碱的理论氢谱图、氢谱峰图,分别见图4、图5。
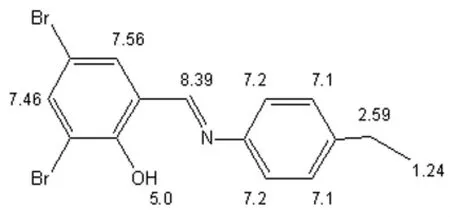
图4 新希夫碱模拟的H谱图
图5 新希夫碱模拟的H谱峰图
核磁共振H谱图如图6所示。
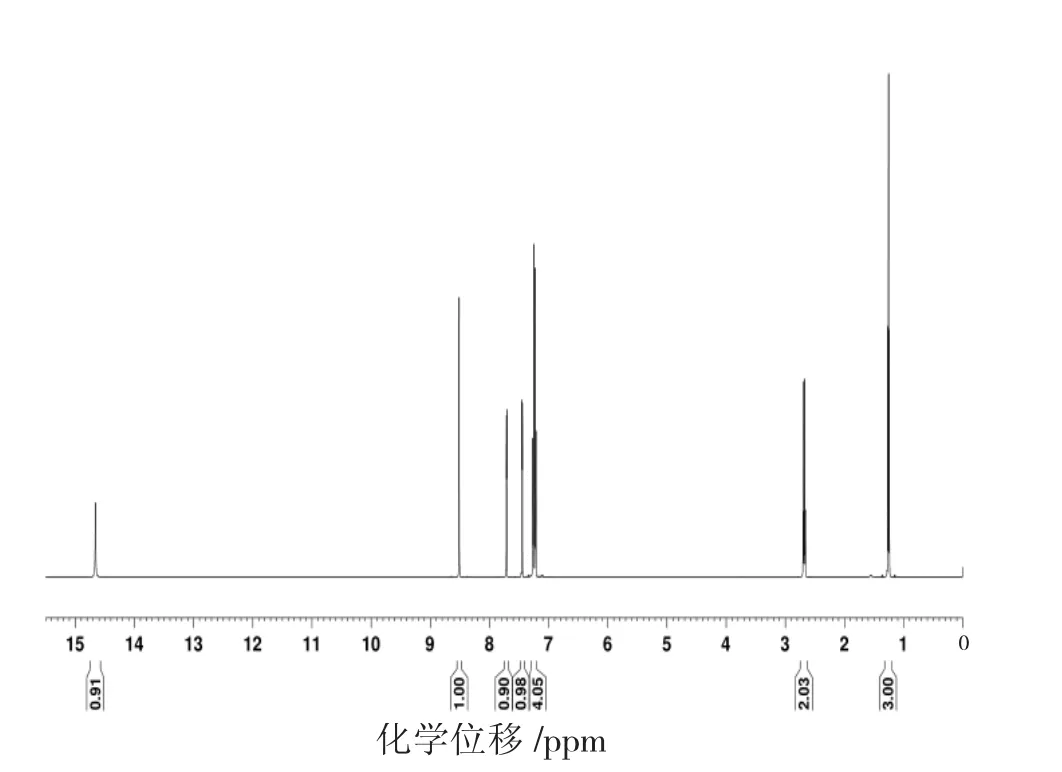
图6 新希夫碱的1H NMR谱图
通过新希夫碱的1H NMR谱图数据分析,化学位移 δ=7.447 5 μm~7.451 3 μm是 CDCl3的溶剂峰,化学位移δ=8.514 8 μm为与苯环相连接的-CH=N-基团中H,共轭作用增强使化学位移向低电场移动,表明产物已经具有希夫碱结构。在化学位移δ=7.217 4 μm~7.268 9 μm处存在的多重峰为苯乙基环上的质子吸收峰,在δ=14.659 0 μm的单峰为3,5-二溴水杨醛苯环上的-OH引起,δ=2.664 1 μm~2.702 2 μm的吸收峰为苯乙基环上-CH2-的质子峰,在 δ=1.244 9 μm~1.270 3 μm的吸收峰为苯乙基环上-CH3的质子峰,在化学位移δ=7.711 1 μm~7.715 0 μm处的吸收峰为 3,5- 二溴水杨醛苯环上的质子吸收峰。从测试结果推断其质子在苯环上以及其他位上的结构与目标产物结构基本一致。
2.2.4 核磁共振C谱图对新希夫碱结构的表征分析
通过Chemdraw模拟出希夫碱的理论碳谱图、碳谱峰图,分别见图7、图8。
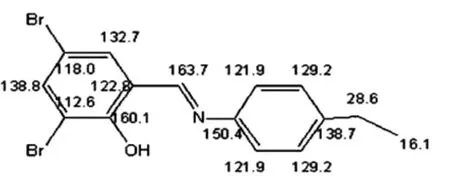
图7 新希夫碱模拟的C谱图

图8 希夫碱模拟的C谱峰图
核磁共振C谱图如图9所示。

图9 新希夫碱的13C NMR谱图
通过新希夫碱的13CNMR谱图数据分析,化学位移δ=158.7536μm为-C=N-的碳峰,δ=28.5231μm为-CH2-的碳峰,δ=15.517 9 μm为 -CH3的碳峰,δ=110.0760μm和112.2518μm为苯环连着2个溴的碳峰,δ=129.074 5 μm和 δ=120.736 1 μm ~121.145 5 μm是苯乙基环上的-CH的碳峰,δ=133.264 4 μm和δ=137.887 6 μm为 3,5- 二溴水杨醛苯环上的 -CH的碳峰,δ=157.537 0 μm是连着 -OH的碳峰,δ=144.557 6 μm和 δ=144.101 1 μm是苯环上与 -C=N-相连2个C上的碳峰。δ=76.831 4 μm-77.254 8 μm为CDCl3溶剂峰。从测试结果推断其碳原子在苯环以及其他位上的结构与目标产物结构基本一致。
2.3 新希夫碱的熔点测定结果
熔点约为102.6℃。
2.4 新希夫碱的溶解性
新希夫碱的溶解性测定结果见表2。

表2 新希夫碱的溶解性
综合新希夫碱化合物的表征数据与分析结果,表明所合成产物的结构与理论结构基本相同,且产物产率较高。
2.5 抗菌活性测定结果
采用滤纸片扩散法测定希夫碱对各细菌和霉菌的抑菌活性,希夫碱在不同浓度下抑菌圈直径结果如表3所示。

表3 新希夫碱在不同浓度下的抑菌圈直径(mm)
从表3中看出,新希夫碱对细菌具有良好的抑菌性,当溶液质量浓度达到5 mg/mL或10 mg/mL时,对细菌均可达到高度敏感。其中当质量浓度为10 mg/mL时,对大肠杆菌的抑菌圈可达到20 mm以上,对大肠杆菌的抑菌效果为极度敏感,抑菌效果十分显著。当溶液质量浓度在1 mg/mL时,除大肠杆菌外,均达到中等敏感水平。DMF溶液对各细菌或霉菌的抑菌圈均为6 mm,表明它对各菌均没有抑制作用。此外,当溶液质量浓度为5 mg/mL时,新希夫碱对沙门氏菌、枯草杆菌的抑菌圈比在10 mg/mL时的直径大,这表明抑菌圈大小并不是简单随着溶液质量浓度的增大而增强,而是在其质量浓度范围内有最大值,此时达到最强的抑菌效果。在对霉菌的抑制效果中,本文中合成的新希夫碱对黑根霉的抗菌性没有被检测出,对黑曲霉和毛霉的抑菌圈效果随新希夫碱质量浓度的增加而略有提高。依据本文的抑菌评价标准,除在1 mg/mL时对毛霉没有抑菌圈的产生,新希夫碱对黑曲霉和毛霉的抑菌结果均为低度敏感,存在一定的抑菌效果。
2.6 抗氧化能力的测定结果
使用UVmini-1240(SHIMADZU) 测定紫外吸光度,得出清除能力工作曲线,新希夫碱和Vc溶液对DPPH自由基清除能力如下页图10、下页图11所示。

图10 希夫碱对DPPH的清除能力
由图10和图11可以看出,在一定范围内,新希夫碱和Vc溶液对DPPH自由基的清除能力表现出较好的剂量效应关系,随试验溶液质量浓度的增加呈现出上升的趋势。根据线性方程y=4.5213x+18.759,R2=0.988,算出希出碱对DPPH自由基的半数清除率为6.92 mg/mL。根据线性方程y=1431.9x+38.638,R2=0.918 3,算出希出碱对DPPH自由基的半数清除率为0.007 9 mg/mL。IC50的结果表明,与Vc相比,新希夫碱对DPPH自由基的清除能力相对较弱。当IC50小于10 mg/mL时,则说明抗氧化剂具有良好的自由基清除活性。依据此标准,化合物的IC50为6.92 mg/mL,小于10 mg/mL,其对DPPH自由基的清除能力相对较弱,但也保有一定的自由基清除活性。
3 结论
通过用3,5-二溴水杨醛和4-乙基苯胺合成的新希夫碱样品为橙红色晶体,产率为74.3%,熔点约为102.6℃。通过红外、紫外光谱分析、核磁共振谱图分析对新希夫碱进行结构表征,表征的结果表明合成产物与目标产物基本相一致。采用滤纸片法对希夫碱样品进行抑菌活性测定,结果表明,新型希夫碱对细菌具有良好的抑制性,同时它对细菌的抑制效果整体高于真菌。对细菌的抑菌效果普遍在高浓度时达到高度敏感,其中对大肠杆菌可达到极度敏感程度。在抗氧化活性测定结果中,新希夫碱对DPPH自由基的IC50为6.92 mg/mL,清除
DPPH自由基的能力明显比Vc弱,但仍具备一定的抗氧化活性。
[1]王澈,侯鹏,李崧,等.希夫碱及其金属配合物的合成及生物活性研究进展[J].化学通报,2009,5(4):334-340.
[2]李晓荣.两类苯甲醛希夫碱的合成、结构表征及相关活性研究[D].大连:大连医科大学,2012.
[3]张强华,纪丽莲.四种希夫碱抑菌活性的对比研究[J].淮阴工学院学报,2001,10(3):31-33.
[4]金晓晓,王江涛,白洁.壳聚糖与肉桂醛的缩合反应制备席夫碱及其抑菌活性研究[J].高校化工工程学报,2010,24(4):645-650.
[5]雷亮.氨基吡啶类双席夫碱及配合物的合成与抑菌活性研究[D].抚州:东南理工大学,2012.
[6]樊素芳,杨国玉,徐翠莲,等.壳寡糖水杨醛系列希夫碱的抗氧化作用[J]. 河南农业大学学报,2012,46(6):687-690.
[7]潘勇.Pd(Ⅱ)席夫碱配合物的合成、晶体结构及其性能研究[D].呼和浩特:内蒙古工业大学,2013.
[8]张卉,宋妍,冷静,等.近红外光谱分析技术[J].光谱实验室,2007,24(3):387-395.
[9]高明珠.核磁共振技术及其应用进展[J].信息记录材料,2011,12(3):48-51.
[10]常建华,董绮功.波谱原理及解析[M].第2版.北京:科学出版社.2005:82-83.

