寨卡病毒囊膜E蛋白的原核表达及其抗体制备
王佳美,巩新,刘党生,吴军,刘波
1.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;
2.军事医学研究院 生物工程研究所,北京 100071
寨卡病毒(Zika virus,ZIKV)属于黄病毒科黄病毒属,黄病毒家族成员还包括黄热病毒(YFV)、登革热病毒(DENV)、日本乙型脑炎病毒(JEV)、西尼罗病毒(WNV)、蜱传脑炎病毒(TBEV)等[1]。只有约20%寨卡病毒感染者会出现轻微症状,2~7 d可自愈。但如果孕妇感染了寨卡病毒,病毒会通过胎盘屏障感染胎儿,病情较为严重,导致新生儿小头症[2]和格林-巴利综合征(Guillain-Barré syndrome,GBS)[3]。世界卫生组织(WHO)曾在2016年2月宣布将寨卡病毒列为全球公共卫生紧急事件。
寨卡病毒只有一种血清型,电镜下形态呈球形颗粒,有囊膜,基因组为单股正链RNA,全长约10.8 kb,两端是非编码区,中间有一段开放读框,编码3种结构蛋白(衣壳蛋白C、前体膜蛋白PrM、囊膜蛋白E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)[4],结构蛋白构成病毒颗粒的各个结构,非结构蛋白参与基因组复制和功能性多聚蛋白的合成。当寨卡病毒入侵宿主细胞时,在低pH值环境下,病毒包膜E蛋白与细胞表面的受体结合,诱导病毒粒子与细胞膜融合,通过受体介导的内吞作用(RMF)释放寨卡病毒本身的核酸到宿主细胞,囊膜(envelope,E)蛋白能诱导宿主产生特异性抗体,前体膜(Premembrane,PrM)蛋白在E蛋白构象的正确折叠和病毒出胞过程中起重要作用,因此目前这2种蛋白常作为黄病毒疫苗设计和研发的首选[5]。我们前期以实验室糖基工程酵母平台为基础,开展了糖基工程酵母制备寨卡病毒E蛋白亚单位疫苗的研究,结果表明商业化寨卡病毒E蛋白抗体效价较低,特异性较差,检测结果不理想。因此,在本研究中,我们根据文献报道选取了E蛋白抗原表位较集中的200个氨基酸片段(138~338)作为目的片段(图1)[6],用大肠杆菌表达系统获得重组蛋白,以该蛋白为抗原免疫小鼠,获得了针对寨卡病毒E蛋白的特异性多克隆抗体,为后续开展寨卡病毒E蛋白亚单位疫苗的研究提供检测工具。
1 材料与方法
1.1 材料
6周龄BALB/c雌鼠由维通利华公司提供;大肠杆菌DH5α、BL21(DE3)感受态细胞,Q5热启动高保真DNA聚合酶,TaqDNA聚合酶购自全式金生物技术有限公司;质粒pET22b由本室保存;DNA提取试剂盒及琼脂糖凝胶基因片段回收试剂盒购自天根生物科技有限公司;限制性内切酶、T4DNA连接酶购自NEB公司;弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司。
LB/Amp培养基:10 g/L胰蛋白胨,5 g/L酵母抽提物,10 g/L氯化钠,100 mg/L氨苄青霉素。
Ⅰ号培养基:20 g/L酵母抽提物,10 g/L胰蛋白胨,PB缓冲液(pH7.0)浓度为50 mmol/L。
1.2 目的基因的获取
从NCBI网站获取寨卡病毒E蛋白全基因序列(GenBank:KU312315.1),由上海生工生物工程有限公司合成该基因。以合成的基因为模板,根据文献报道选取抗原表位较集中的200个氨基酸(138~338)作为插入片段,设计引物ZIKVE5(5'-GCTCTTAAGATGAGAATCATGTTGTCCGTTCAT-3',下划线序列为EcoRⅠ酶切位点)和ZIKVE3(5'-GTCGAGCTCACCACCACCACCACCGTCAGTACCAG CGTATTGAAC-3',下划线序列为XhoⅠ酶切位点),PCR扩增ZIKV-E200基因片段,用DNA片段回收试剂盒回收PCR片段。
1.3 原核表达载体的构建
质粒pET22b和回收的片段用EcoRⅠ/XhoⅠ双酶切,DNA回收试剂盒分别回收载体和片段,用T4DNA连接酶连接回收后的载体和片段,将连接后的重组载体热转化大肠杆菌DH5α感受态细胞,菌落PCR鉴定阳性克隆。

图1 寨卡病毒E蛋白
1.4 重组载体在原核细胞中的表达
将测序正确的单克隆进行质粒扩增,在5 mL LB/Amp液体培养基中于37℃培养15 h,用质粒提取试剂盒提取重组表达质粒,将该重组质粒热转化大肠杆菌BL21(DE3)感受态细胞,挑取单菌落接种于5 mL LB/Amp液体培养基,37℃培养15 h,按10%的接种量接到200 mLⅠ号培养基中,待菌密度(D600nm值)为0.6时,用IPTG(终浓度1 mmol/L)诱导,37℃继续培养8 h。用同样方法培养和诱导大肠杆菌BL21(DE3)作为阴性对照。
1.5 目的蛋白的分离
回收重组表达菌体和对照菌体,超声波破碎,破碎后的对照菌体于-20℃保存备用。破碎后的重组菌体于12 000 r/min离心10 min,沉淀用2 mol/L尿素溶解2 h,12 000 r/min离心10 min,将上清液和沉淀分开,分别用15%分离胶进行SDS-PAGE分析,用6 mol/L尿素继续溶解沉淀2 h,12 000 r/min离心10 min,上清和沉淀用15%分离胶进行SDS-PAGE分析,将表达的目的蛋白切胶回收,用研钵研细至1 mL注射器可抽吸,用少量生理盐水重悬,加入等量的弗氏佐剂,冰浴超声波混匀。
1.6 抗寨卡病毒E蛋白多克隆抗体的制备
将制备好的抗原皮下注射BALB/c小鼠,21 d后进行第2次免疫,再21 d后进行第3次免疫,14 d后每只小鼠眼眶取血约600 μL,12 000 r/ min离心10 min,取上清,-80℃保存备用。
1.7 Western印迹检测血清中多克隆抗体的特异性
用糖基工程酵母表达的带有His-tag标签的寨卡病毒E全长重组蛋白检测多克隆抗体的特异性。将表达寨卡病毒E蛋白的酵母菌裂解液和空白酵母菌裂解液分别用15%的SDS-PAGE分离,半干法转印到PVDF膜上(15 V,20 min),用5%脱脂奶粉封闭1 h,以收集的鼠血清为一抗(稀释度1∶3000)孵育1 h,以辣根过氧化酶(HRP)标记的兔抗鼠IgG为二抗(稀释度1∶10 000)孵育1 h,对照组用抗His-tag抗体孵育,化学发光检测试剂盒检测荧光强度。
2 结果
2.1 目的基因的获取
按照方法1.1所述,以ZIKVE5和ZIKVE3为引物,PCR扩增出约600 bp的目的片段(图2),用EcoRⅠ和XhoⅠ双酶切,克隆到载体pET22b相应的酶切位点上(图3),构建成pET22b-ZIKV-E200重组质粒,转化大肠杆菌DH5α感受态细胞,用菌落PCR鉴定阳性克隆(图4),测序结果显示插入表达载体pET22b-ZIKV-E200的ZIKV-E200编码基因序列完全正确。
2.2 重组载体在原核细胞中的表达

图2 ZIKV-E200基因的PCR扩增产物图谱M:Trans 2K plusⅡDNA marker;1:ZIKV-E200基因(600 bp)
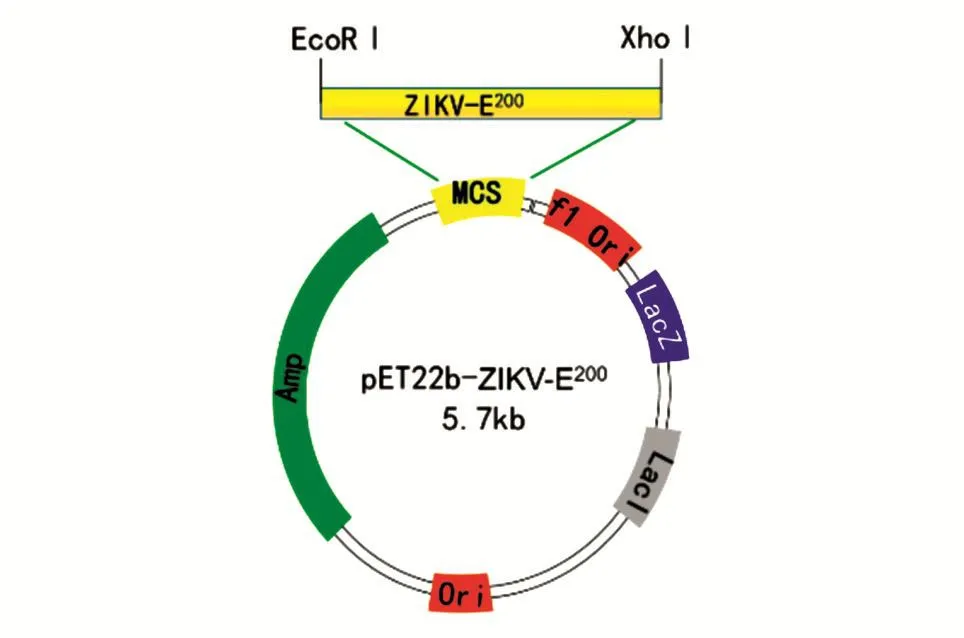
图3 pET22b-ZIKV-E200表达质粒

图4 菌落PCR筛选阳性克隆M:Trans 2K plusⅡDNA marker;1~5:阳性克隆
回收的菌液12 000 r/min离心5 min后,吸除培养上清,湿菌称重,按重量比1∶100加水重悬菌体,超声波破碎菌体,12 000 r/min离心15 min,沉淀按原湿菌重加水重悬,用15%SDS-PAGE分析,发现目的条带相对分子质量约为25 000,与理论值一致,并且目的蛋白以包涵体形式存在于破菌沉淀中(图5)。破碎后的离心沉淀用2 mol/ L尿素溶解,溶解后的上清液和沉淀分别用15%分离胶进行SDS-PAGE分析(图6),用6 mol/L尿素继续溶解沉淀,溶解后的上清液和沉淀分别用15%分离胶进行SDS-PAGE分析(图7),表达蛋白大部分存在6 mol/L尿素溶解上清中。
2.3 Western印迹检测血清中的多克隆抗体
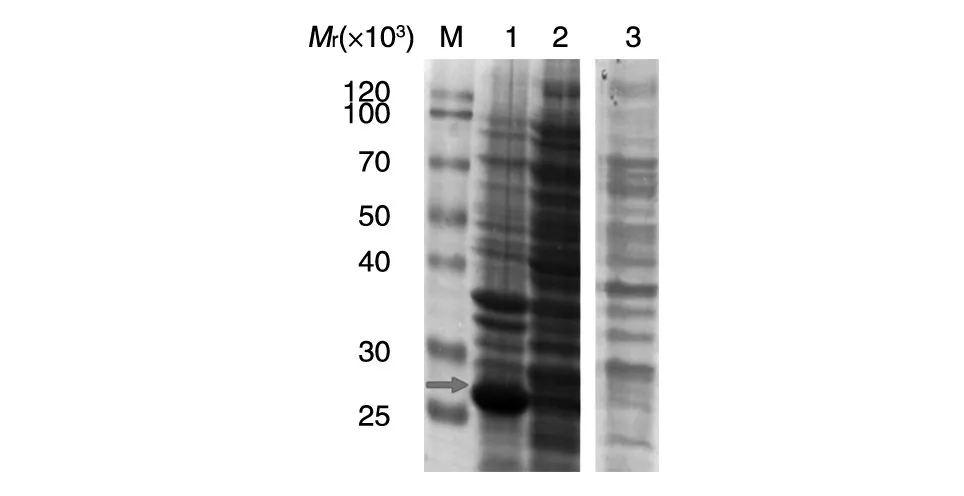
图5 重组菌表达的SDS-PAGE图谱M:Blue plusⅡprotein王佳美、marker;1:菌液离心沉淀;2:菌液离心上清

图6 2 mol/L尿素溶解后SDS-PAGE图谱M:Blue plusⅡprotein王佳美、 marker;1:2 mol/L尿素溶解后离心沉淀;2:2 mol/L尿素溶解后离心上清

图7 6 mol/L尿素溶解后SDS-PAGE图谱M:Blue plusⅡprotein王佳美、 marker;1:6 mol/L尿素溶解后离心上清;2:6 mol/L尿素溶解后离心沉淀
利用3次免疫后获得的鼠血清为一抗、HRP标记的兔抗鼠IgG为二抗进行Western印迹,检测该血清中多克隆抗体的特异性,用抗His-tag抗体作为对照,检测实验室利用糖基工程酵母表达的寨卡病毒E蛋白的全长片段。结果在相对分子质量50 000~60 000处出现了特异性条带,与理论值(54 000)接近,而在空白酵母菌裂解液中没有检测到特异性条带,与抗His-tag抗体检测结果一致(图8)。
3 讨论
我们利用大肠杆菌BL21(DE3)表达了ZIKVE200蛋白,免疫小鼠后获得的多克隆抗体检测到了酵母表达的寨卡病毒E蛋白,蛋白大小与抗His-tag抗体检测结果一致,表明该多克隆抗体可用于酵母表达的寨卡病毒E蛋白的检测等研究。
近年来寨卡病毒疫情迅速蔓延,已成为威胁全球人类健康的潜在因素,目前尚无针对性的特效药和预防性疫苗,因此对于寨卡病毒致病机制、免疫策略、治疗手段的研究已经是当务之急。在前期研究中,我们用糖基工程酵母表达了寨卡病毒E蛋白,因为商业化寨卡病毒E蛋白抗体,灵敏度不够,难以检测寨卡病毒E蛋白基因在工程酵母中的表达情况,所以本研究的目的是获得寨卡病毒E蛋白的检测抗体。为提高表达效率,我们根据文献报道选取E蛋白抗原表位较集中的200个氨基酸片段作为目的片段[6],利用大肠杆菌培养条件简单、生长速度快、表达产量高的优点,在大肠杆菌BL21(DE3)中诱导表达了ZIKV-E200重组蛋白截短片段。可能由于蛋白自身疏水性较高,蛋白是以包涵体形式表达的,包涵体须经过复杂的溶解、复性、纯化才能获得有活性的蛋白,因此采用尿素溶解、切胶回收目的蛋白的方法制备免疫抗原,免疫BALB/c小鼠后获得了多克隆抗体,针对酵母表达的寨卡病毒E蛋白特异性较高,为寨卡病毒亚单位疫苗后续研究提供了检测抗体。

图8 抗ZIKV-E200多克隆抗体的Western印迹M:EasySeeⅡWestern marker;1:ZIKV E蛋白以抗His-tag抗体为一抗;2:空白菌(裂解液)以抗His-tag抗体为一抗;3:ZIKV E蛋白以抗ZIKV-E200血清为一抗;4:空白菌(裂解液)以抗ZIKV-E200血清为一抗
[1] 刘颖,陈照立,李君文,等.寨卡病毒的生物学特征、致病特点及其防控寨卡病毒及其疫苗研究[J].解放军预防医学杂志,2016,34(1):1-3.
[2] 廖勇,曾志笠,胡国良,等.中国大陆首例输入性寨卡病毒病病例调查分析[J].中华流行病学杂志,2016,37 (5):593-596.
[3] Cao-Lormeau V M,Blake A,Mons S,et al.Guillain-Barré syndrome outbreak associated with Zika virus in⁃fection in French Polynesia:a case-control study[J]. Lancet,2016,387(10027):1531-1539.
[4] 田德桥,陈薇.寨卡病毒及其疫苗研究[J].生物工程学报,2017,33(1):1-15.
[5] Hamel R,Dejarnac O,Wichit S,et al.Biology of Zi⁃ka virusinfection in human skin cells[J].Virology, 2015,89:8880-8896.
[6] Ashfaq U A,Ahmed B.De novo structural modeling and conserved epitopes prediction of Zika virus envel⁃op protein for vaccine development[J].Viral Immunol, 2016,29:436-443.
[7] Dai L P,Song J,Lu X S,et al.Structures of the Zi⁃ka virus envelope protein and its complex with a flavi⁃virus broadly protective antibody[J].CellHostMi⁃crobe,2016,19(5):696-704.
[8] Hou W,Cruz-Cosme R,Armstrong N,et al.Molecu⁃lar cloning and characterization of the genes encoding the proteins ofZika virus[J].Gene,2017,628(17): 30572-30573.
[9] 卢昌,李娜,薛璞,等.寨卡病毒包膜PrM-E蛋白的结构和功能分析[J].中国人兽共患病学报,2017,33(1):81-84.

