人突触囊泡蛋白2C单克隆抗体的制备及鉴定
邱语进,孙志杰,赵鹏,付楚溪,霍江,熊向华,汪建华,万冬梅,张惟材
1.辽宁大学 生命科学院,辽宁 沈阳 110036;2.军事科学院 军事医学研究院 生物工程研究所,北京 100071;3.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;4.沈阳师范大学,辽宁 沈阳 110034;5.解放军第307医院 麻醉科,北京 100071
肉毒毒素(botulinum neurotoxin,BoNT)是一类由厌氧肉毒梭状芽孢杆菌(Clostridium botuli⁃num)产生的神经毒素,是迄今已知毒性最强的蛋白毒素[1-3]。肉毒毒素共有7种血清型(A~G),其中A型最为常见,近年来已应用于美容和治疗偏头痛、眼能动性、运动障碍等疾病[4-5]。A型肉毒毒素由一条重链和一条轻链通过二硫键连接构成,重链的N端为跨膜区、C端为受体结合区,轻链为依赖Zn2+的内肽酶。A型肉毒毒素(BoNT/A)在神经肌肉接头处与神经细胞表面的受体结合,借助重链N端跨膜将轻链送至胞内,通过切割突触囊泡相关蛋白SNAP25从而阻断神经递质的释放,引发肌肉持续的松弛性麻痹[6-7]。
突触囊泡蛋白2(synaptic vesicle protein 2,SV2)是一类在内分泌泡及突触囊泡广泛表达的跨膜糖蛋白,包含12次跨膜的疏水结构域(trans⁃membrane regions,TMR),具有调节神经递质释放、内分泌泡胞吐作用、维持突触囊泡稳态及参与神经肌肉接头形成等生物学功能。Dong等研究发现SV2的3个亚型SV2A、SV2B、SV2C均可作为BoNT/A的受体,其中SV2C与BoNT/A的亲和力最高[8],其TMR7、TMR8之间的突触泡大突环L4上的529~566位氨基酸与BoNT/A结合[7,9-10]。本研究中我们表达纯化了SV2C/L4蛋白,免疫小鼠后经2轮筛选得到13株单抗,其中30号抗体与SV2C的亲和力最高,且具有一定的中和活性。
1 材料与方法
1.1 材料
昆明小鼠购自军事医学研究院实验动物中心;大肠杆菌感受态细胞BL21(DE3)购自北京天根生化科技有限公司;pGEX-KG-SV2C/L4质粒由本课题组构建;脱脂奶粉购自生工生物工程股份有限公司;HRP标记的羊抗鼠IgG、TMB显色液购自康为世纪生物科技有限公司;Western印迹试剂盒、Proteinlso GST Resin购自北京全式金生物技术有限公司;抗体亚类鉴定试剂盒购自北京博奥龙免疫有限公司;酶标板、细胞培养板购自康宁公司;PVDF膜购自Merk Millipore公司;HiTraP Protein G HP购自GE Healthcare公司。
1.2 制备抗原SV2C
将构建的pGEX-KG-SV2C/L4质粒转化大肠杆菌BL21(DE3),挑取阳性克隆接种于200 mL含氨苄青霉素(Amp)的LB培养基中,于37℃、220 r/min培养至D600nm为0.5~0.8,加入终浓度0.5 mmol/L的IPTG于20℃诱导18 h,4℃、12 000 r/ min离心收集菌体,加20 mL裂解液重悬,置于冰上超声波裂解菌体,4℃、12 000 r/min离心收集上清,按1∶2000的比例加入GST琼脂糖珠,4℃结合2 h,先用洗涤缓冲液漂洗4次,后用洗脱缓冲液洗脱并收集洗脱液进行SDS-PAGE检测。
1.3 杂交瘤细胞筛选
采用4只SPF级BALB/c雌性小鼠,每只小鼠初次免疫经皮下多点注射60 μg SV2C/L4蛋白,加强免疫3次后测定小鼠血清效价,选择效价最高的小鼠提高免疫用量进行腹腔冲击,培养10 d后分离小鼠脾细胞,采用PEG法与生长对数期的Sp2/0细胞融合,用半固体培养基(含HAT)筛选培养14~21 d,间接ELISA筛选阳性克隆。动物免疫与杂交瘤细胞初筛交由北京华大蛋白研发中心有限公司完成。
1.4 抗体效价测定
用5 μg/mL的SV2C抗原37℃孵育2 h,PBST洗涤3次;用5%脱脂牛奶37℃封闭2 h,PBS-T洗涤3次;细胞上清按1∶200稀释作为起始浓度,然后按1∶2梯度稀释共10个浓度,取100 μL依次加入酶标板,37℃孵育1 h,PBS-T洗涤3次;二抗羊抗鼠1∶2000稀释,37℃孵育1 h,PBS-T洗涤3次;显色5~10 min,终止反应后读数。
1.5 抗体亚型鉴定
取细胞培养上清,按试剂盒说明书鉴定抗体亚型。
1.6 抗体制备
每只BALB/c小鼠腹腔注射0.5 mL液体石蜡预处理1周,之后经相同途径注射0.5 mL浓度为2×106/mL的细胞悬液,7~10 d见小鼠腹部明显膨大即可剖腹收集腹水,离心收集上清。用结合缓冲液稀释小鼠腹水,4℃、12 000 r/min离心10 min,取上清,Protein G亲和柱上样,平衡至基线平稳,加入洗脱缓冲液洗脱,收集洗脱峰,SDSPAGE鉴定后分装于-20℃保存。
1.7 抗体结合表位类型鉴定
取20 μL纯化蛋白进行SDS-PAGE,半干法转膜,5%脱脂牛奶封闭2 h,PBS-T洗膜,待测抗体按1∶1000的比例稀释,室温孵育1 h,PBS-T洗膜,二抗羊抗鼠按1∶2000的比例稀释,室温孵育1 h,PBS-T洗膜,显色。
1.8 抗体亲和力常数测定
将不同浓度(5、2.5、1.25、0.625 μg/mL)的SV2C/L4抗原依次加入酶标板中包被,空白孔加入包被缓冲液,37℃孵育2 h;用5%脱脂牛奶37℃封闭2 h,PBS-T洗1次;将不同浓度(288 μg/mL,1/2梯度稀释16个浓度)的一抗依次加到包被好的酶标板中,37℃孵育1 h,PBS-T洗3次;羊抗鼠二抗按1∶2000稀释,37℃孵育1 h,PBS-T洗3次;避光显色5~15 min后终止反应,双波长测定吸光度值,记录数据。
以抗体浓度的对数值为横坐标,D值为纵坐标,利用GraphPad Prism 5软件拟合出不同抗原浓度的EC50,按Beaty[11]推导的公式计算K值并求平均值,即为亲和力常数。
1.9 抗体中和活性实验
参照Diamant等的方法[12]进行。
2 结果
2.1 抗原SV2C/L4的纯化
重组菌pGEX-KG-SV2C/L4/BL21(DE3)诱导表达后超声波裂解,取裂解上清用于GST亲和层析纯化,SDS-PAGE分析显示得到特异性纯化蛋白条带,与融合蛋白理论相对分子质量相符,Gel-Pro Analyzer软件分析蛋白纯度达到95%以上(图1)。
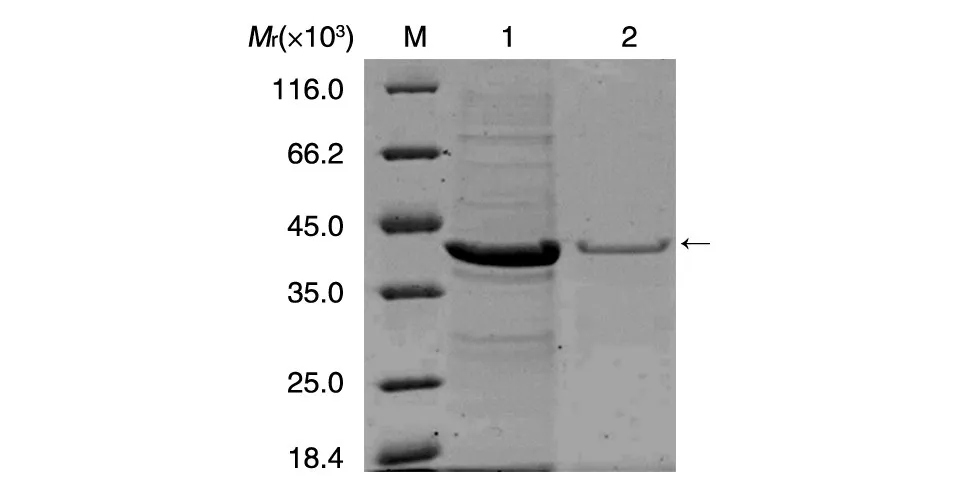
图1 目的蛋白纯化的SDS-PAGE检测M:蛋白marker;1,2:SV2C/L4纯化蛋白
2.2 杂交瘤细胞筛选和抗体分型
用间接ELISA测定3次加强免疫后的4只小鼠的血清效价,结果见表1,1号小鼠血清效价最高,选取1号小鼠进行细胞融合实验。
细胞融合实验共进行2轮筛选,获得13株阳性杂交瘤细胞,间接ELISA测定这13株细胞上清效价为6.4×103~1.024×105(表2),其中30号细胞上清的效价最高为1.024×105。测得抗体的重链大部分为IgG1、IgG2a型,轻链均为κ型(表2)。
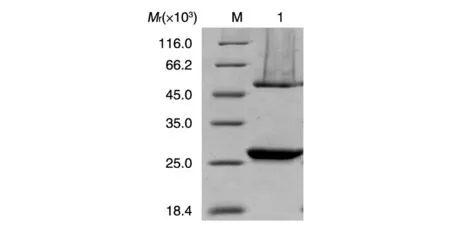
图2 SV2C抗体纯化的SDS-PAGE检测M:蛋白marker;1:SV2C抗体
2.3 抗体纯化
小鼠腹水经Protein G柱亲和层析纯化,SDSPAGE分析抗体纯度大于95%(图2)。
2.4 抗体结合表位类型鉴定
Western印迹显示并无明显条带,而ELISA结果表明鼠单抗可以与抗原SV2C/L4反应,由此推测该抗体结合表位类型是空间表位。
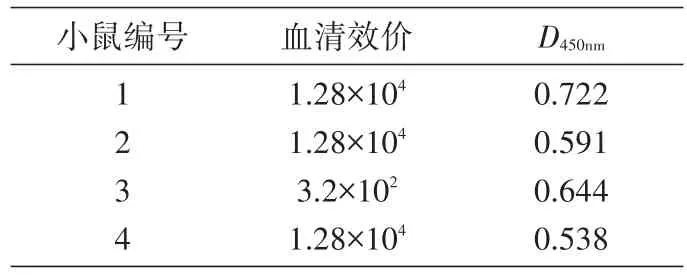
表1 小鼠血清效价
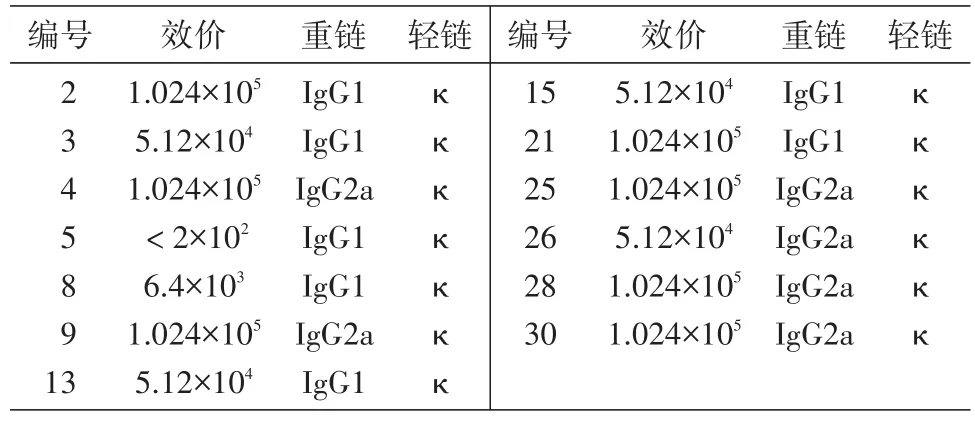
表2 13株抗体效价及亚型
2.5 抗体亲和力常数测定
间接ELISA测定30号单抗与SV2C/L4抗原的亲和力常数,结合反应曲线如图3。用GraphPad Prism 5分析实验数据,抗原浓度为5、2.5、1.25、0.625 μg/mL时所对应的EC50分别为0.570、1.083、2.334和2.203 ng/mL。代入公式K=2(nAbx-Aby)/(n-1)(n=x/y,x>y),计算所得K值的平均值即为亲和力常数。最终计算得到30号单抗与SV2C/L4抗原的亲和力常数K=6.7 nmol/L。
2.6 抗体的中和活性
中和活性实验结果表明,针对BoNT/A的30号抗体中和活性为100 LD50/mg。
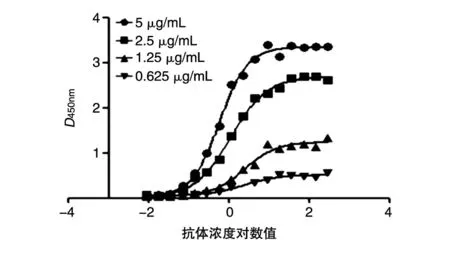
图3 抗体SV2C与抗原亲和力常数
3 讨论
传统理论认为BoNT/A在神经细胞表面有神经节苷脂GT1b和SV2等2种受体[13-16]。GT1b是一种酸性鞘糖脂,在神经细胞表面数量较丰富,在细胞分化、信号转导、细胞增殖等方面发挥重要作用[18];SV2位于脊椎动物的突触泡与内分泌泡上,与神经肌肉接头形成、神经递质的释放相关。当BoNT/A进入神经肌肉接头后,首先与神经细胞表面的GT1b结合并完成对毒素的富集[17];富集的毒素再与神经细胞表面的蛋白受体SV2结合,并在SV2的介导下完成内吞[16]。但是,2013年Jacky等研究发现成纤维细胞生长因子受体3(fi⁃broblast growth factor receptor 3,FGFR3)是BoNT/ A的一种新受体[18],其与毒素结合后会引发毒素内吞。目前BoNT/A的3种受体特别是2种蛋白受体(SV2/FGFR3)的相互关系还不明确,我们希望制备2种蛋白受体的抗体来研究它们之间的相互关系。本研究中我们通过免疫小鼠筛选阳性杂交瘤细胞来制备SV2C特异性抗体,经4次皮下注射和1次腹腔注射免疫BALB/c小鼠,选取血清效价最高的小鼠完成杂交瘤细胞制备,采用间接ELISA法进行2轮筛选,最终得到了13株抗体。选取效价最高的30号抗体制备纯化腹水,纯化抗体与SV2C抗原的亲和力常数为6.7 nmol/L,对BoNT/A的中和活性为100 LD50。我们得到1株高纯度、高亲和力并对BoNT/A具有一定中和活性的抗SV2C鼠单抗,为我们研究BoNT/A受体的相互关系奠定了基础。
目前,针对BoNT/A中毒的治疗尚无有效的化学药物,而临床使用的马多抗存在过敏反应等安全隐患,基因工程单抗是发展的主流方向。Nowakowski等获得的S25、C25、3D12[19]和XOMA公司研发的NX01、NX02、NX11[20]单抗均具有很好的中和活性,但这些单抗都是针对BoNT/A的受体结合区。本研究筛选得到针对BoNT/A的SV2C受体的具有一定的中和活性的单抗,这一结果提示可以通过直接封闭BoNT/A的受体来达到治疗目的,为肉毒中毒治疗提供了新的途径。
[1] Peck M W.Biology and genomic analysis of Clostridi⁃um botulinum[J].AdvMicrob Physiol,2009,55:183-265.
[2] Hill K K,Smith T J.Genetic diversity within clostridi⁃um botulinum,serotypes,botulinum neurotoxin gene clusters and toxin subtypes[M]//Botulinum Neurotoxins. Springer Berlin Heidelberg,2012:1.
[3] Gill D M.Bacterial toxins:a table of lethal amounts [J].Microbiol Rev,1982,46(1):86.
[4] Giménez D F,Giménez J A.The typing of botulinal neurotoxins[J].Int J Food Microbiol,1995,27(1):1.
[5] Montal M.Botulinum neurotoxin:a marvel of protein design[J].Annu Rev Biochem,2010,79(1):591.
[6] Montecucco C,Papini E,Schiavo G.Bacterial protein toxins penetrate cells via a four-step mechanism[J]. FEBS Lett,1994,346(1):92-98.
[7] Dong M,Yeh F,Tepp W H,et al.SV2 is the pro⁃ tein receptor for botulinum neurotoxin A[J].Science, 2006,312(5773):592-596.
[8] Rummel A.Double receptor anchorage of botulinum neurotoxins accounts for their exquisite neurospecificity [M]//Botulinum Neurotoxins.Springer Berlin Heidel⁃berg,2012:61-90.
[9] Levy R,Forsyth C M,Laporte S L,et al.Fine and domain-level epitope mapping of botulinum neurotoxin type A neutralizing antibodies by yeast surface display [J].J Mol Biol,2007,365(1):196-210.
[10]韦娜,张惟材.突触泡蛋白2研究进展[J].生物技术通讯,2007,18(3):519-523.
[11]王越剑,王建武,刘庆良.单克隆抗体亲和力常数的简易测定[J].上海免疫学杂志,1991,(2):48-13.
[12]Diamant E,Lachmi B E,Keren A,et al.Evaluating the synergistic neutralizing effect of anti-botulinum oli⁃goclonal antibody preparations[J].PLoS One,2014,9(1): e87089.
[13]Montecucco C.How do tetanus and botulinum toxins bind to neuronal membranes[J].Trends Biochem Sci, 1986,11(8):314-317.
[14]Rummel A,Eichner T,Weil T,et al.Identification of the protein receptor binding site of botulinum neurotox⁃ins B and G proves the double-receptor concept[J]. Proc Natl Acad Sci USA,2007,104(1):359.
[15]Berntsson R P,Peng L,Dong M,et al.Structure of dualreceptorbinding to botulinum neurotoxin B[J]. Nat Commun,2013,4(3):2058.
[16]Binz T,Rummel A.Cell entry strategy of clostridial neurotoxins[J].J Neurochem,2009,109(6):1584-1595.
[17]Huwiler A,Kolter T,Pfeilschifter J,et al.Physiology and pathophysiology ofsphingolipid metabolism and signaling[J].Biochim Biophys Acta,2000,1485(2-3):63.
[18]Jacky B P S,Garay P E,Dupuy J,et al.Identifica⁃tion of fibroblast growth factor receptor 3 as a protein receptor for botulinum neurotoxin serotype A[J].PLoS Pathog,2013,9(5):210-216.
[19]Nowakowski A,Wang C,Powers D B,et al.Potent neutralization of botulinum neurotoxin by recombinant oligoclonal antibody[J].Proc Natl Acad Sci USA,2002, 99(17):11346-11350.
[20]余云舟,孙志伟,郑涛,等.肉毒毒素防治药物的研究进展[J].军事医学,2012,36(12):954-958.

